反义寡核苷酸药物在精准治疗中的应用进展及其作用机制
2020-08-10周海燕ZHOUHaiyan
周海燕 (ZHOU Haiyan)
(伦敦大学学院,伦敦 WC1N 1EH)

周海燕,英国伦敦大学学院终身首席研究员,伦敦大学儿童健康研究所生物医学研究中心青年学术委员会主席,转化医学研究生教学负责人。
本科与硕士就读于青岛大学医学院,2002年于中国协和医科大学(中国医学科学院)获得博士学位。随后在瑞士巴塞尔大学、英国伦敦帝国理工大学和伦敦大学学院任博士后研究员、高级研究员、学科带头人、首席研究员等职务,担任“Action Duchenne”、“Muscular Dystrophy UK”、“AFM-TELETHON”、“Myotubular Trust”、“Kidney Research UK”等多项国际基金的评审,是《Nature Communications》、《America Journal of Human Genetics》、《Brain》等十多家国际学术杂志的特约审稿人。
目前主要从事神经肌肉疾病的基础与临床研究及核苷酸分子治疗在多种疾病中的转化医学研究。共发表SCI论文50余篇,获奖10余项,其中2006年在比利时第11届世界肌肉学会国际会议上获颁“President Prize”,并被评选为当年度青年肌病学家;2011年获英国脊髓性肌肉萎缩症信托基金颁发“青年科学家奖”。2015—2017年周海燕及其团队连续三年在世界肌肉学会国际会议上获“The Léa Rose 脊髓性肌萎缩奖”。
在过去一个世纪里,小分子药物及以蛋白质为治疗靶点的药物开发研究取得了显著的成绩,但是与人类疾病密切相关的治疗靶点仍然只是了解了其中的一小部分,因此寻找新的治疗靶点是目前临床上迫切需要解决的问题。核糖核酸是其中最具代表性的一类靶点,特别是调节mRNA或前体mRNA(pre-mRNA)均可以作为治疗的新靶点,从而扩展了靶点治疗的研究范围。随着近20年来人类基因组测序技术的快速发展,在新药开发领域,特别是精准医学领域,根据基因组信息而设计的特异性核苷酸治疗也取得了迅猛的发展。
目前已有的用以调节细胞中RNA功能的治疗方案包括微小干预RNA(siRNA)、基因治疗、基因组编辑、mRNA治疗以及合成的反义寡核苷酸的治疗。本文主要集中讨论部分反义寡核苷酸药物在遗传疾病中相关的临床应用及其作用机制。
1 反义寡核苷酸药物对相关疾病治疗的作用机制
反义寡核苷酸为化学合成的单链核苷酸分子,通常为13~30个核酸序列的短片段(故称为“寡核苷酸”),这一核酸序列被设计成为与靶向基因序列互补(故称为“反义”),通过沃森-克里克(Watson-Crick)碱基配对的方式与特异的RNA序列结合。在生物信息学指导下通过精心设计,使该核苷酸片段对目标RNA具有高度的特异性,从而达到基因靶向治疗的目的。
与目标基因结合后的反义寡核苷酸通过几种不同的作用机制来调节目标mRNA的功能,其中最常见的作用机制包括:①通过激活内源性RNA酶促反应而促进对目标mRNA的消化降解;②通过调节目标pre-mRNA的剪接模式(pre-mRNA splicing)从而改变目标RNA终极蛋白产物表达,这包括外显子跳跃(exon skipping)和外显子保留(exon inclusion)。
1.1 反义寡核苷酸药物对目标mRNA的切割降解
目前美国食品药品监督管理局(FDA)批准的6种反义寡核苷酸药物当中,有3种,即Fomivirsen、Mipomersen和Inotersen都是通过对目标mRNA的切割降解而达到降低与疾病相关的mRNA及其蛋白质产物的表达。其共同作用机制为通过反义寡核苷酸与目标mRNA核苷酸序列的互补结合,其中来源于合成的反义寡核苷酸中的部分DNA序列与目标mRNA结合后形成的DNA-RNA杂合体将会吸引内源性RNA酶H(RNase H)至该位点,对目标mRNA进行切割与降解,从而达到降低目标基因产物表达的效果(图1A)。
Fomivirsen(Vitraven)是第一个被FDA批准用于疾病治疗的反义寡核苷酸药物。该药物由21个硫代脱氧核苷酸组成,通过与人类巨细胞病毒中的关键基因UL123的序列互补结合,抑制其编码蛋白IE2的合成而抑制该病毒的复制。Fomivirsen主要是用于治疗艾滋病病人中巨细胞病毒性视网膜炎[1]。该药于1998年获FDA批准上市,后来由于其他有效抗艾滋病病毒药物的应用,于2002年及2006年分别退出欧洲及美国市场。
Mipomersen(Kynamro)于2013年获FDA批准用于治疗纯合子型家族性高胆固醇血症患者。该药通过与载脂蛋白Apo B-100 mRNA核酸序列特异性互补结合,导致其被切割及降解。Apo B-100是低密度脂蛋白(LDL)及其代谢前体极低密度脂蛋白(VLDL)的主要载脂蛋白,可降低肝脏中LDL的生成,达到治疗作用[2]。由于该药在部分患者中会造成一定程度的肝功能损伤,故仅用于经过其他降脂药物和饮食治疗仍不能控制的顽固性高胆固醇血症患者。
Inotersen(Tegsedi)于2018年被FDA批准用于治疗家族性淀粉样多发神经病变(FAP)。该病是由于甲状腺素转运蛋白(TTR)基因突变而诱导蛋白产物的错误折叠,进而导致淀粉样沉积物在体内多个组织中积聚,包括周围神经元和心脏内而致病。Inotersen通过与TTR mRNA核酸序列的特异性互补结合,切割并降解该目标mRNA,从而达到抑制TTR蛋白在肝脏的生成,从而降低其在血液循环中的水平[3]。
1.2 反义寡核苷酸药物对pre-mRNA剪接的校正
除了针对成熟mRNA进行的基因表达抑制作用外,反义寡核苷酸还可以通过空间位阻,阻断其他功能基团与pre-mRNA中参与基因剪接的功能序列的结合,调节或改变该pre-mRNA的基因剪接模式,诱导产生新的功能性蛋白质异形体,从而达到治疗作用。这其中以反义寡核苷酸诱导的外显子跳跃治疗和外显子保留治疗最具代表性(图1B)。
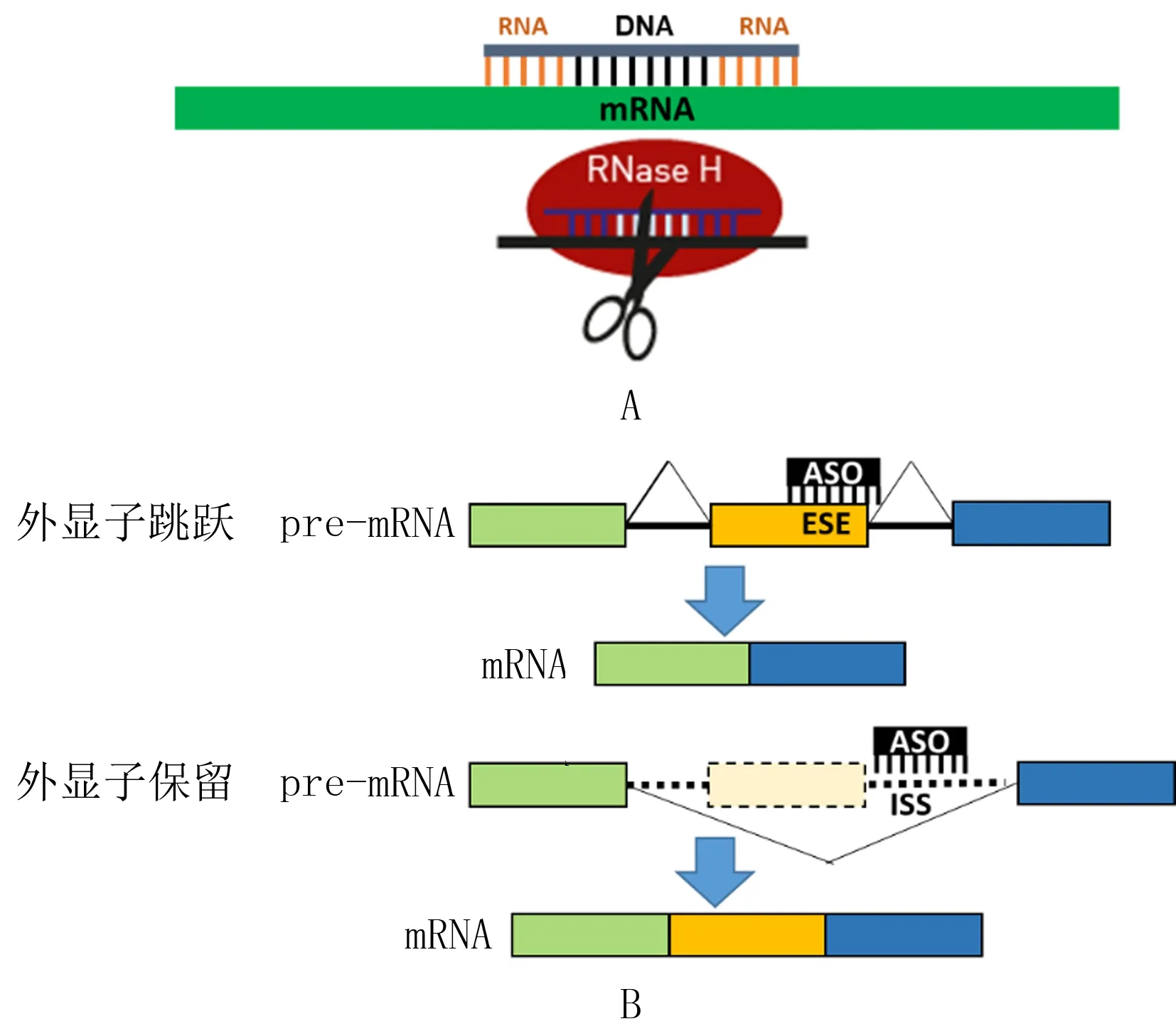
A:通过内源性核糖核酸酶介导的mRNA降解;B:通过空间位阻对pre-mRNA的剪接进行调节
1.2.1反义寡核苷酸药物在杜氏肌营养不良症(DMD)中的治疗应用 DMD是由于编码抗肌萎缩蛋白Dystrophine(DMD)基因的突变而引发的致死性神经肌肉疾病,其中约80%的DMD患者是由于外显子缺失或重复引发的转录本读码框的破坏,从而导致抗肌萎缩蛋白的缺失。反义寡核苷酸可通过诱导与突变位点邻近的外显子跳跃,恢复mRNA的阅读框及后续的蛋白合成。这样形成的抗肌萎缩蛋白虽然短于正常蛋白,但仍然包含有基本的蛋白质功能,可以减缓肌纤维变性并延缓疾病进展,使其临床表现类似于轻型的贝克尔肌营养不良症[4]。
Eteplirsen(Exondys 51)于2016年被FDA批准用于DMD患者外显子51跳跃治疗[4-5]。DMD基因包含有79个外显子。该反义核苷酸药物通过与DMDpre-mRNA中外显子51的核苷酸序列互补结合,在mRNA合成的过程中去除了外显子51的转录,从而在骨骼肌中生成较短但仍具功能性的抗肌萎缩蛋白。外显子51的跳跃治疗适用于大约13%的DMD患者。
基于相似机理,Golodirsen(Vyondys 53)通过诱导DMD基因中外显子53的跳跃从而达到治疗的目的[6]。该反义核苷酸于2019年被FDA批准用于DMD患者外显子53的跳跃治疗。这是第二个被FDA批准的用于治疗DMD的反义核苷酸药物,适用于大约8%的DMD患者。
1.2.2反义寡核苷酸药物用于脊髓性肌萎缩症(SMA)的治疗 SMA是由于运动神经元存活基因(SMN1)突变引起的SMN蛋白缺乏所致。SMN2与SMN1是旁系同源基因。虽然两者的编码序列几乎一致,然而由于SMN2外显子7中的第6个核苷酸的碱基变化,故而导致SMN2中的外显子7不能被有效地转录并且翻译成SMN蛋白。在SMA中,尽管SMN1基因已经发生了突变,但SMN2的基因序列是没有被改变的。多项体内试验及体外实验证明反义寡核苷酸药物能有效地促进SMN2基因中外显子7的剪接机制,从而增强功能性SMN蛋白的合成[7-8]。
Nusinersen(Spinraza)是第一个用于治疗临床所有类型的SMA患者的反义核苷酸药物[9-10]。该药含有18个核苷酸序列,与SMN2的内含子7中的一段序列(ISS-N1)进行互补结合,从而增强外显子7的剪接及其后续的功能性SMN蛋白的合成。自2016年获得FDA批准后,该药目前已经在世界多个国家获得批准上市。
2 反义寡核苷酸药物的研发进程与挑战
通过使用化学合成的反义寡核苷酸来调节目标RNA功能作为疾病治疗手段最早始于1978年,用于抑制Rous肉瘤中RNA病毒的翻译与复制[11-12]。然而直到1998年,FDA才批准了第一个反义寡核苷酸药物Fomivirsen。在过去的几十年间,生物信息学以及新一代基因测序技术的飞速发展解决了过去许多未被发现的新的致病基因及遗传缺陷,这为反义寡核苷酸提供了新的治疗靶点。同时,各种新的核苷酸合成技术的出现,以及对核苷酸分子的不同化学修饰,提高了该类药物在体内的稳定性及治疗效果,降低了药物生产的成本,从而突破了该类药物开发中化学合成与制造中的瓶颈[13]。最近几年来一些高效的新型反义核苷酸药物在临床上的应用,比如Eteplirsen和Golodirsen在DMD中的应用,Nusinersen在SMA中的应用,使反义寡核苷酸药物又得以复兴。虽然在过去几年,反义寡核苷酸药物取得了相当大的进展,但其在不同疾病中的广泛应用仍存在一些亟待解决的问题,包括药物的安全性以及药物对靶器官的有效递送等方面。
反义核苷酸药物治疗应用中最常见的副作用包括如下几种:①免疫炎性反应:一些寡核苷酸可与Toll样受体(TLR)结合,而诱发患者注射部位及全身的炎性反应,包括注射部位皮肤炎性反应,以及发热、寒战和僵直等。②肾脏或肝脏毒性:在硫代磷酸酯修饰的寡核苷酸治疗后,部分患者会出现蛋白尿和肝脏转氨酶增高,极少数患者有肾小球肾炎或急性肾小管坏死的报道。③血小板计数减少:这些副作用均与剂量有关,可以随着剂量降低或暂停用药而消失[14]。
可通过两方面的措施对药物的安全性进行控制:①在前期设计时要尽量降低反义核苷酸序列与靶向基因之外的其他基因的互补结合,即所谓的“序列脱靶效应”。②对相应的核苷酸进行适当的化学修饰[13,15]。最常用的修饰包括对核糖2′位置的甲基(2′-O-methyl)或者对甲氧乙基(2′-O-methoxye-thyl)修饰,从而增加了对其同源序列的亲和力;或者使用硫代磷酸酯键代替核糖之间的磷酸二酯键使其对核酸酶具有抵抗性,不易被内源性核酸酶降解,从而延长了药物半衰期,降低了给药频率。
作为大分子亲水性的化合物,寡核苷酸药物在体内对靶器官的递送是目前药物发展遇到的最大难题之一[16]。就目前已开发的药物,寡核苷酸药物在局部给药的疾病中的疗效明显优于需全身给药的疾病,如Nusinersen采取的就是鞘内注射给药方式。Nusinersen是目前最成功的反义寡核苷酸药物,全球治疗的SMA病例已达上万例。由于寡核苷酸不能通过血脑屏障,因此需要重复鞘内注射给药,从而使药物能集中作用于中枢神经系统,特别是运动神经元。而对于其他需要全身给药的疾病,如何将药物有效递送至靶组织一直是寡核苷酸药物开发中的关键难题。Eteplirsen在DMD临床疗效相对较低的一个原因就是大部分药物经静脉注射后,会经肾小球滤过而迅速排出,而体内剩余的药物则只有一小部分被骨骼肌吸收。
配体结合的反义核苷酸技术(LiCA)是目前正在开发的用以解决这一难题的代表性技术。其可通过与靶器官上的特异受体结合,而将核苷酸药物递送到靶细胞内。如寡核苷酸可以与N-乙酰半乳糖胺(GalNAc)结合,而后者是肝细胞特异的脱唾液酸糖蛋白受体(ASGPR)的配体。这种配体-受体介导的药物传递,不但可将寡核苷酸药物特异地递送到靶细胞内,而且还可以大幅度降低所需的寡核苷酸药物的剂量以及治疗频率[17]。以GalNAc-ASGPR介导的反义寡核苷酸治疗目前还处于试验治疗阶段,主要针对的是与肝细胞来源的蛋白质产物相关疾病的治疗[18]。
3 反义寡核苷酸药物在精准医学中的应用
反义寡核苷酸药物的开发极大地促进了精准医学的发展。除了能特异性地调控靶基因达到治疗目的外,反义寡核苷酸还可以准确地针对特异的基因突变进行修复,例如Eteplirsen以及Golodirsen在DMD中的治疗即是如此。反义寡核苷酸药物的应用极大地促进了该类药物在基因突变所致罕见遗传病中的治疗应用。同时,美国FDA及欧洲EMA等权威认定机构针对罕见病治疗的孤儿药(又称罕见药)开通了快速资格认定通道,也进一步促进了反义寡核苷酸药物在罕见病中的治疗开发。
Milasen是另一个具有代表性的反义寡核苷酸药物,可用来治疗巴顿病,目前仅发现1例患儿患有该罕见病[19]。研究者借助于下一代基因测序技术,在该患儿的MFSD8基因中发现了能引起该基因剪接异常的突变,该突变导致了罕见的致死性的神经元蜡样脂褐质沉积症,而设计出的反义寡核苷酸药物Milasen可有效纠正这一罕见的基因缺陷,从患儿确诊到最终接受Milasen治疗仅用了10个月时间。临床证实Milasen不仅有效改善了患儿的症状,还迅速延缓了该例患儿快速恶化的进程。尽管Milasen的例子在当前尚不具有普遍性,但是它的成功为将来更多针对不同疾病而特异设计的反义核苷酸药物的精准应用开创了先河。
4 结语
随着生物信息学、分子遗传学、药理学及化学合成技术的日益成熟,反义寡核苷酸药物研究取得了飞速发展。反义寡核苷酸药物已经显示了其在治疗肿瘤、病毒、代谢性疾病以及神经肌肉和神经退行性疾病中的广泛应用,为很多目前无法解决的医学难题提供了潜在的治疗方案,是目前最有应用前景的基因靶向治疗药物[20]。然而,反义核苷酸技术仍处在发展中阶段,仍然有很多困难需要解决。如何提升该类药物在体内的疗效,增强对靶器官的特异递送,降低其在人体内的副作用,以及对该类药物长期疗效与毒副作用的更进一步认识,是目前反义寡核苷酸药物研发正在研究的问题。另外,随着对RNA调节机制认识的提高,以及生物信息学的迅猛发展,我们期待更多的新药作用机制被发现,并将基因组信息应用于药物设计,从而进一步推进反义寡核苷酸药物在精准医学中的应用。
