肺癌与肺良性疾病特异血清免疫炎性蛋白质N-糖基化修饰差异
2020-08-10杜钰莹赖治臻田志新李智立
杜钰莹,王 悦,赖治臻,田志新*,李智立*
(1.中国医学科学院基础医学研究所 北京协和医学院基础学院 生物物理及结构生物学系, 北京 100005;2.同济大学 化学科学与工程学院 上海市化学品分析风险评估与控制重点实验室, 上海 200092)
肺癌(lung cancer)是全球高发的恶性肿瘤之一[1]。慢性肺炎的症状与早期肺癌相似[2]。肺部疾病与多种蛋白质的结构改变相关[3-4],N-糖基化修饰是蛋白质结构变化的常见形式之一,它对蛋白质结构和功能发挥着重要的调控作用[5],在不同的病生理状态下蛋白质N-糖基化修饰存在显著差异[6-7]。目前大部分研究主要关注总蛋白质的N-糖基化修饰[7],对疾病特异蛋白质N-糖基化修饰报道的较少[8-10]。
大量临床样本的研究证实,血液中免疫炎性相关蛋白复合物(immunoinflammation-related protein complexes, IIRPCs)与慢性疾病发生、发展密切相关[11],且其中的免疫球蛋白G(IgG)保守区(Fc)N-糖基化修饰可个体化区分良性疾病和癌[8,10]。本研究采用高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)技术,鉴定了肺癌和慢性肺炎患者血清中IIRPCs的蛋白质N-聚糖和连接位点。
1 材料与方法
1.1 材料
1.1.1 研究对象:肺腺癌患者和慢性肺炎患者血清样本各1份。样本收集严格遵循人体医学研究伦理要求,并经中国医学科学院基础医学研究所伦理审查委员会批准(伦理审批编号:020-2014)。
1.1.2 主要试剂:甘氨酸、甲叉双丙烯酰胺、丙烯酰胺、三羟基甲基氨基甲烷、考马斯亮蓝G250、过硫酸铵、硼酸和四甲基乙二胺(Amresco公司);碳酸氢铵(Sigma-Fluka公司);色谱级乙腈和色谱级三氟乙酸(Thermo Fisher Scientific公司);测序级改良胰蛋白酶(Roche 公司)。
1.2 方法
1.2.1 样本前处理:采用非变性聚丙烯酰胺凝胶电泳(native-polyacrylamide gel electrophoresis,native-PAGE)从血清中分离IIRPCs[8]。血清用量为200 μL,电泳前以1∶1比例与1×native-PAGE上样缓冲液混合。每块凝胶以10 mA恒流电泳1.5 h,之后调整为25 mA恒流电泳3 h,凝胶用考马斯亮蓝G250染色。依据文献报道方法将IIRPCs目标条带切下[8,11],18.2 MΩ超纯水清洗,置于600 μL离心管中。用胰蛋白酶(12.5 ng/μL,25 mmol/L NH4HCO3)酶解目标条带内蛋白。吸取酶解液,用真空冷冻浓缩仪低温干燥。采用石墨相氮化碳富集糖肽[9]。将肺癌(或良性疾病)样本处理液平均分为两份,一份用0.025%的氨水溶液洗脱,另一份用0.1%三氟乙酸水溶液洗脱。将两份洗脱液混合后用真空冷冻浓缩仪浓缩,得到干燥的富集样本。将干燥后的样本用18.2 MΩ超纯水重溶,浓度约为1 g/L。
1.2.2 高效液相色谱分离条件:完整N-糖肽采用DionexUltiMate 3000 RSLCnano-HPLC系统进行分离,实验室自制分析柱(75 μm×75 cm,5 μm)和富集柱(200 μm×5 cm,5 μm)中的固定相均为Jupiter C18填料(5 μm,300 Å)。流动相A为H2O(含0.2%甲酸),流动相B为乙腈(含0.2%甲酸和4.8%的H2O)。上样量为10 μL,以300 nL/min的流速进行洗脱,梯度为:0~10 min(2% B),10~40 min(2%~40% B),40~45 min(40%~95% B),45~48 min(95% B)。
1.2.3 质谱检测:洗脱的完整N-糖肽,用Q Exactive质谱仪进行在线鉴定。离子传输管的温度设定为280 ℃,喷雾电压为2.8 kV,一级质谱m/z采集范围为700~2 000,质量分辨率70 k(m/z 200),自动增益控制(Automatic Gain Control,AGC)目标值为2×105,最大注射时间为50 ms;二级质谱质量分辨率设定为17.5 k,采用数据依赖性扫描模式(data-dependent acquisition,DDA)获取强度前20的离子二级质谱图,设置高能碰撞诱导解离(higher-energy collisional dissociation,HCD)梯度碎裂能量依次为20%、30%和40%,AGC为5×105,最大注射时间为250 ms,隔离窗口宽度为3.0(m/z),动态排除时间设定为20.0 s。
1.3 数据分析
用GPSeeker蛋白质及糖肽搜索软件对上述采集到的质谱数据进行分析。筛选与参考文献[11]在IIRPCs中鉴定到的相同蛋白质作为本次研究的目标蛋白质,依据文献报道的方法[12]对这些蛋白质和糖肽进行鉴定,其中糖基化残基使用如下的单字母符号表示:岩藻糖,F;半乳糖,G;甘露糖,M;唾液酸,S。
2 结果
2.1 蛋白质及其糖肽的鉴定
共鉴定了来自12种蛋白质的89种糖肽(代表性质谱图见图1),其中28种糖肽(31.5%)来源于IgG2,17种(19.1%)来源于IgG1,17种(19.1%)来源于IgA2,11种(12.4%)来源于触珠蛋白,5种(5.6%)来源于补体C4b,2种(2.2%)来源于补体C3,2种(2.2%)来源于凝血酶原,2种(2.2%)来源于触珠蛋白相关蛋白,2种(2.2%)来源于β2-糖蛋白1(图2A)。89种糖肽中,21种仅在慢性肺炎样本中测出,38种仅在肺腺癌样本中测出(图2B)。
2.2 N-糖型结构
N-糖型通常含有1个五糖核心,根据其末端单糖残基的结构特点可分为高甘露糖型、复杂型和杂合型。本研究筛选出的89种糖肽包含63种糖型,其中55种糖型为复杂型,5种为杂合型,3种为高甘露糖型。10种糖型仅在慢性肺炎样本中测出,21种糖型仅在肺腺癌样本中测出(图3)。
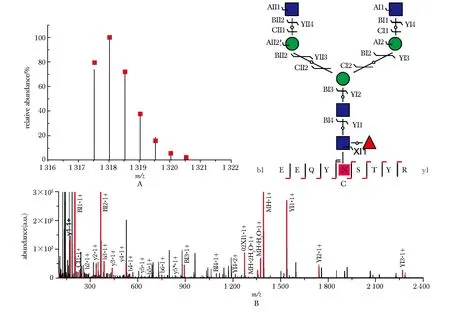
A.mass spectrum of intact N-glycopeptide (glycoform: G0F) from IgG2 heavy chain at Asn176 site(black line: experimental isotopic peaks; red square: theoretical isotopic peaks); B.tandem mass spectrum of the intact N-glycopepetide; C.structure of intact N-glycopeptide including glycoform and sequence of amino acids
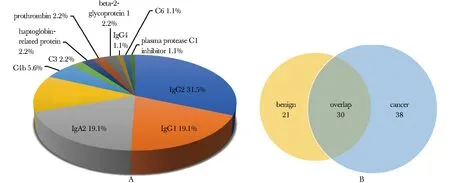
A.glycopeptide distribution of the detected proteins; B.glycopeptide distribution between lung cancer and lung pneumonia图2 糖肽的来源和分布Fig 2 Source and distribution of the detected glycopeptides
2.3 N-糖基化修饰位点
免疫球蛋白IgG1、IgG2和IgG4重链Fc N-糖基化修饰位点分别为γ1的Asn180位点、γ2的Asn176位点和γ4的Asn177位点。免疫球蛋白IgA2的N-糖基化修饰的位点为Asn205。触珠蛋白的N-糖基化修饰位点为Asn241。补体C4b的N-糖基化修饰位点分别为Asn226和Asn1328,补体C3的N-糖基化修饰位点为Asn85,补体C6的N-糖基化修饰位点为Asn324。凝血酶原的N-糖基化修饰位点为Asn121。触珠蛋白相关蛋白的N-糖基化修饰位点为Asn126。β2-糖蛋白1的N-糖基化修饰位点为Asn162。血浆蛋白C1抑制因子的N-糖基化修饰位点为Asn238(图4)。
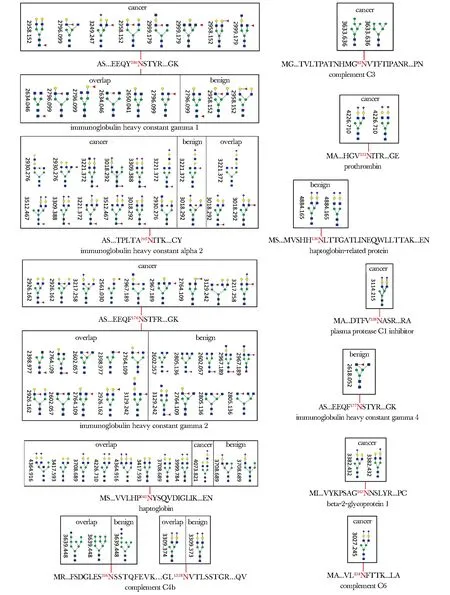
图4 糖蛋白质的糖基化修饰结构图Fig 4 Structural diagram of the detected glycoprotein
2.4 疾病特异糖型
肺癌特异糖型(21种)中含有岩藻糖残基的共18种, 占其总数的85.71%, 而慢性肺炎特异糖型(10种)中含有岩藻糖残基的共8种,占其总数的80%。对肺癌,含有半乳糖残基和唾液酸残基的特异糖型分别为19种和10种,分别占其总数的90.48%和47.62%。对肺炎,含有半乳糖残基和唾液酸残基的特异糖型分别为5种和2种,分别占其总数的50%和20%(表1)。

表1 不同糖型所占百分比Table 1 Percentage of different glycoforms
慢性肺炎特异糖型中仅有2种单唾液酸化修饰糖型,而肺癌特异糖型中有6种单唾液酸化修饰糖型和4种双唾液酸化修饰糖型。
2.5 同一糖基化位点上的糖型与病理类型
对肺炎,IgG1的Asn180位点可检测到3种特有糖型,且均不含唾液酸残基;对肺癌,该位点上可连接8种特有糖型,其中1种含有唾液酸残基。IgG2的Asn176位点上在慢性肺炎中检测到9种含有半乳糖残基的特有糖型,在肺癌中仅检测到4种含有半乳糖残基的特有糖型。IgG4的Asn177位点上仅在慢性肺炎中检测到1种糖型。
对慢性肺炎,IgA2的Asn205位点上仅连接2种特有糖型,对肺癌,可检测到12种特有糖型。对慢性肺炎,触珠蛋白的Asn241位点上可连接2种特有糖型,肺癌仅有1种。IgA2与触珠蛋白的N-糖型大部分含有唾液酸残基。
补体C4b的Asn226和Asn1328位点上各有1种慢性肺炎特有糖型。在肺癌中,补体C3的Asn85位点、凝血酶原的Asn121位点和β2-糖蛋白1的Asn162位点分别检测到2种糖型,而在慢性肺炎中均未测出。触珠蛋白相关蛋白的Asn126位点上连接的2种糖型仅出现在慢性肺炎中。血浆蛋白C1抑制因子的Asn238位点和补体C6的Asn324位点上各连接1种糖型,且仅出现在肺癌中。
2.6 同一种N-糖型连接的位点与病理类型
带有一个半乳糖残基的岩藻糖基化的糖型(G1F)连接在肺癌的IgG1上,而在慢性肺炎中它连接在IgG2上。带有两个半乳糖残基的岩藻糖化的糖型(G2F)可以连接在肺癌的IgG1和IgG2上,但在慢性肺炎中仅发现连接在IgG2上。凝血酶原的Asn121位点、触珠蛋白相关蛋白的Asn126位点与补体C4b的Asn1328位点均可连接2种糖型,分别为双天线G2S2结构与三天线G2S2结构。对于凝血酶原,这2种糖型仅出现在肺癌中;对于触珠蛋白相关蛋白,这2种糖型仅出现在慢性肺炎中;对于补体C4b,双天线结构G2S2仅出现在慢性肺炎中,三天线结构G2S2在两种病理状态下均出现。
3 讨论
不同蛋白质N-糖基化修饰与疾病状态密切相关,如血清IgG、触珠蛋白、受体酪氨酸激酶和E-钙黏蛋白等[6,13]。目前,大部分研究主要对总蛋白质的N-糖基化修饰进行分析,对疾病特异蛋白质糖基化修饰的研究较少[8-9]。分析疾病特异蛋白质在病理状态下的结构变化,对深入认识发病机制和区分良恶性疾病具有重要的临床意义。
蛋白质N-聚糖结构的变化是由多种酶促反应介导[13]。与肺炎相比,复杂的肺癌疾病特异免疫炎性蛋白质N-糖型可能表明肺癌涉及更加复杂的酶促反应。同一蛋白质的特定N-糖基化修饰位点连接的不同糖型与疾病状态和蛋白质的功能调节相关[14]。与肺良性疾病相比,非小细胞肺癌的IIRPCs中触珠蛋白Asn241位点的G2和G2S两种糖型、Asn207/211位点的G2G3S糖型的表达显著升高[9],同时IgG核心岩藻糖基化修饰水平显著升高[10]。与慢性肺炎相比,肺腺癌患者的血清IgG的N-糖基化修饰可能会使其更易于与Fcγ结合,介导相关免疫反应,这可能与IgG Fc N-半乳糖基化修饰可促进IgG与Fcγ受体之间的结合,导致抗体依赖的细胞介导的细胞毒性作用和补体依赖的细胞毒性作用改变有关[15]。
同一糖型连接在不同蛋白质的N-糖基化修饰位点上,出现在不同的疾病状态中,表明这种差异具有疾病特异性;同一糖型连接在同一蛋白质的不同位点上也表现出疾病特异性[14]。因此,忽略糖型的连接位点或连接位点的特殊环境,单纯从聚糖结构探讨疾病特异性具有一定的局限性。
综上所述,基于native-PAGE凝胶电泳和HPLC-MS/MS法,首次对疾病特异免疫炎性蛋白质N-糖型的结构进行了鉴定,发现了一批具有疾病特异的糖蛋白质及相关的糖型。但由于本研究样本量较小,研究具有一定的局限性,后续将进行大样本量的验证研究。
