小热休克蛋白家族和自噬相关蛋白在自发性2型糖尿病db/db小鼠海马组织中的表达
2020-08-10李金凤李小承殷小红马卫国
李金凤,李小承,殷小红,马卫国,李 亚
(西安医学院第一附属医院 内分泌科,陕西 西安 710075)
小热休克蛋白家族(small heat shock proteins,sHSPs)是一类分子质量为15~45 ku的热休克蛋白(heat shock proteins,HSPs)。在哺乳动物中sHSPs又被称作HSPB家族,已明确的包括10个成员即HSPB1-HSPB10[1]。作为分子伴侣的sHSPs,广泛表达于动物组织中,在高糖等应激条件下,部分表达量升高,参与与错误折叠蛋白质的结合[2],通过调节自噬途径影响蛋白质合成和降解的速率,维持正常细胞蛋白稳态[3]。据研究小热休克蛋白与糖尿病及其并发症发病关系密切,且作为小热休克蛋白家族一员的HSPB8,高表达于神经组织中,参与BAG3介导的巨自噬过程,与多种神经退行性病变发病相关[4]。但目前系统研究小热休克蛋白家族在海马组织中表达情况的课题较少,本课题将初步筛查自发2型糖尿病小鼠模型 (db/db) 小鼠海马组织与正常小鼠海马组织中是否存在小热休克蛋白家族mRNA表达水平差异。并重点检测HSPB8、BAG3、P62和LC3-Ⅱ蛋白表达情况,了解8周龄db/db小鼠海马组织中是否存在BAG3介导的自噬改变。
1 材料与方法
1.1 材料
1.1.1 动物:SPB级,雄性,8周龄, db/db小鼠及正常野生型(db/m) 小鼠各10只,即db/db 糖尿病小鼠和表型正常的db/m小鼠(lepr-/m)[南京大学-南京生物医药研究院提供,合格证编号:SCXK(黑)2018-0008],监测小鼠体质量及日血糖,将对照组、模型组小鼠颈椎脱臼处死, 立即低温条件取小鼠海马组织,迅速液氮冷冻后,置于-80 ℃冰箱中保存。
1.1.2 试剂:HSPB1-HSPB10、LC3和P62引物(奥科鼎盛生物公司);EasyScript First Strand cDNA Synthesis SuperMix反转录试剂盒(北京全式金生物有限公司)、兔抗鼠 HSPB8,BAG3、P62和LC3抗体(Proteintech 公司);兔抗鼠Actin山羊抗兔二抗(武汉博士德生物工程有限公司);全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒(南京凯基生物技术有限公司)等。
1.2 方法
1.2.1 荧光定量PCR(real-time PCR)检测HSPB1-HSPB10、自噬基因mRNA表达:收集海马组织用匀浆机TransZol裂解,依TransZol总RNA抽提试剂盒说明提取RNA, RNA溶于无核酸酶水中NanoDrop 2 000c测定核酸浓度,用EasyScript First Strand cDNA Synthesis SuperMix试剂盒反转录为cDNA,将1 μg的cDNA进行qPCR,同时使用同种属的β-actin作为内参。常规进行RT-PCR 检测,结果的相对定量值计算公式:2-[(实验组-GAPDH)-(对照组-GAPDH)]。特定引物序列(5′-3′)(表1)。

表1 实时定量 PCR 所用引物Table 1 Quantitative PCR primer sequences
1.2.2 Western blot检测HSPB8、BAG3、P62和LC3-Ⅱ蛋白表达:取海马组织指甲盖大小,秤取重量,按50 mg/mL加入相应体积的细胞裂解液RIPA,无菌剪刀剪碎组织,置于冰上匀浆,冰上裂解15 min,14 000×g离心5 min,取上清液;用BCA法测定蛋白质浓度,经10% SDS-PAGE 电泳分离蛋白质后,恒压25 V半干转膜20 min,将含有蛋白质的PVDF膜在7.5%脱脂奶粉中室温封闭1 h,一抗4 ℃摇床过夜(actin抗体1∶800稀释,BAG3抗体1∶2 000稀释,LC3、P62蛋白抗体1∶800稀释),PBST 洗膜4 次,每次10 min;二抗室温摇床1 h(二抗为HRP标记的羊抗兔IgG,1∶2 000 稀释),PBST洗膜4次后,ECL显影。以β-actin为内参,图像分析软件Image J进行图像分析。
1.3 统计学分析

2 结果
2.1 db/db小鼠体质量及血糖变化
db/db小鼠体质量及血糖较db/m组显著升高(P<0.01)(表2)。

表2 db/m及db/db组小鼠体质量及血糖对比
2.2 Real-time PCR检测db/db组与db/m组sHSPs及LC3、P62 mRNA表达
小热休克蛋白家族基因mRNA在db/db和db/m小鼠海马组织中均有表达。 与db/m组相比,db/db小鼠中HSPB1、HSPB3、HSPB5、HSPB6和HSPB8的表达较低(P<0.05)(表3)。而HSPB2、HSPB9和HSPB10表达较db/m组高(P<0.05)(表4)。其次,db/db和db/m海马组织中均有LC3及P62表达, LC3在db/db小鼠中的表达均高于db/m组,P62表达反之,提示在8周龄糖尿病小鼠海马组织中可能存在自噬改变(P<0.05)(表5)。
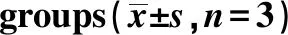
表5 db/m组、 db/db组中 HSPB4、HSPB7、LC3和P62 mRNA 表达Table 5 Expressions of HSPB4, HSPB7,LC3 and P62 in db/m and db/db
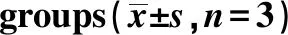
表3 db/m、db/db 组中HSPB1、 HSPB3、 HSPB5、HSPB6和HSPB8 mRNA的表达Table 3 Expressions of HSPB1, HSPB3, HSPB5, HSPB6 and HSPB8 in db/m and db/db
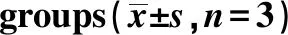
表4 db/m组、 db/db组中 HSPB2、HSPB9和 HSPB10 mRNA 表达
2.3 Western blot检测HSPB8、BAG3、P62、LC3-Ⅱ蛋白的表达
与db/m组相比,db/db组HSPB8、BAG3和LC3-Ⅱ表达均增高(P<0.01),而P62蛋白表达降低(P<0.05)(图1)。

*P<0.05,**P<0.01 compared with db/m图1 实验组及对照组中BAG3、HSPB8、LC3Ⅱ和P62蛋白表达Fig 1 Expression of BAG3, HSPB8, LC3-Ⅱ and P62 proteins in experimental group and control
3 讨论
小热休克蛋白(sHSPs)由80~100个氨基酸残基的保守序列构成,其特征为保守的C-末端α-晶状体蛋白结构域[5],sHSPs蛋白的活性由丝氨酸残基的磷酸化晶状体蛋白介导。sHSPs在不同组织中表达存在差异,如HSPB5主要在晶状体结构中高表达;HSPB2(MKBP)和HSPB3在心肌和骨骼肌中高表达。HSPB9、HSPB10在睾丸中高表达[6]。也有报道HSPB1、HSPB2、HSPB3、HSPB5、HSPB6和HSPB8基因均在大鼠脑组织及海马神经元中表达[7]。
众多研究表明sHSPs与糖尿病关系密切。例如,HSPB4、HSPB5、HSPB6和HSP8在糖尿病视网膜中表达,参与慢性糖尿病中视网膜神经元的保护[8]。HSPB2、HSPB3和HSPB5在慢性高血糖作用下的小鼠心肌细胞中表达增加[9]。HSPB6表达下降可能导致糖尿病引起的心脏损伤。而HSPB5过表达可显著减轻糖尿病模型小鼠的心脏损伤[10]。HSPB1在2型糖尿病肾病患者血浆中表达升高,且HSPB1可能作为糖尿病肾病的标志物[11]。然而,目前针对小热休克家族在糖尿病海马组织中的研究较少。本课题首次研究,发现小热休克蛋白家族成员基因mRNA均在db/m及db/db组小鼠海马中表达,且存在差异,较db/m组,HSPB1、HSPB3、HSPB5、HSPB6和HSPB8转录水平降低,提示这可能与高糖对海马神经元损伤相关,而HSPB2、HSPB9和HSPB10转录水平升高,可能参与高糖刺激时海马神经元的应激保护。
小热休克蛋白家族与自噬关系密切。近年HSPB8参与Bcl-2相关抗凋亡基因3(Bcl-2 associ-ated athanogene 3,BAG3)介导的选择性自噬被广泛研究[12]。
作为补充泛素-蛋白酶体系统可降解一些细胞中突变、损伤及错误折叠的蛋白。 识别底物后,BAG3,HSPB8,HSP70和CHIP/STUB1形成伴侣辅助的选择性自噬(CASA)复合物,CASA复合物与自噬受体SQSTM1/p62相互作用,并与LC3 (LC3-Ⅱ)作用将靶向蛋白结合到自噬体上对底物进行降解[13]。研究发现糖尿病中枢病变的发生与自噬关系密切, 如在海马C1区糖尿病大鼠LC3及P62表达均上调,提示自噬活性减弱[14]。也有报道自噬可使海马神经细胞免于高糖毒性损害;且高糖可削弱海马神经元中自噬体合成,进而减少自噬通量,抑制自噬[15]。然而目前就db/db小鼠海马组织中BAG3介导的选择性自噬尚未见报道。
本研究发现8周龄糖尿病小鼠海马组织中HSPB8蛋白表达升高,且BAG3、LC3-Ⅱ蛋白表达升高,而P62蛋白表达减低,提示8周龄小鼠海马组织中, HSPB8蛋白表达升高,自噬激活。此结果与LI等[13]研究SMZ小鼠神经组织中的研究一致。其具体机制期待将是进一步研究的课题。
