基于多成分药物代谢的秦艽质控成分遴选研究
2020-08-07杨文宁韩星杨海洋李雪岩刘洋林瑞超
杨文宁 韩星 杨海洋 李雪岩 刘洋 林瑞超
摘要 目的:基于中药多成分作用特点,探讨秦艽多成分在体内的代谢情况,遴选秦艽质控成分。方法:制备秦艽水提物,采用相应的实验操作手术,收集秦艽的肠代谢、肝代谢以及综合代谢样品,结合超高效液相色谱-四级杆/静电场高分辨质谱联用技术(UPLC-Q-Exactive MS),对秦艽水提物、肠代谢样品、肝代谢样品及综合代谢样品中的成分进行鉴别,遴选秦艽的质控成分。结果:秦艽水提物中共鉴定出33个化学成分,其中有12个成分在经肠代谢样品中可检测到,有9个成分在先经肠代谢后经肝代谢样品中可检测到,有11个成分在经灌胃给药后的综合代谢样品中检测到。结论:根据质谱数据分析结果,遴选出秦艽中9个可以以原型的形式进入血液循环的成分作为该药材的质控成分,包括马钱苷酸、secologanoside、6′-O-β-葡萄糖龙胆苦苷、獐牙菜苦苷、龙胆苦苷、獐牙菜苷、异牡荆素、淫羊藿苷、齐墩果酸,作为秦艽的质控成分。
关键词 秦艽;多成分药物代谢;质控成分;质量控制;超高效液相色谱-质谱联用技术(UPLC-MS/MS)
Abstract Objective:To investigate the metabolism of Radix Gentianae Macrophyllae and to select the quality control components of Radix Gentianae Macrophyllae based on the action features of multicomponent of Chinese medicines.Methods:The water extract of Radix Gentiana Macrophylla was prepared.Corresponding experimental operations was used.Gentiana macrophylla samples were collected for intestinal metabolism,hepatic metabolism and comprehensive metabolism of Radix Gentianae Macrophyllae,combined with ultra-high performance liquid chromatography-quadrupole/electrostatic field high-resolution mass spectrometry(UPLC-Q-Exactive MS).The components in the water extract,intestinal metabolism sample,liver metabolism sample and comprehensive metabolism sample were identified,and the quality control components of Gentiana macrophylla were selected.Results:A total of 33 chemical constituents were identified in the water extract,of which 12 components could be detected after intestinal metabolism samples,9 components could be detected after intestinal metabolism followed by liver metabolism,and 11 components could be detected in comprehensive metabolic samples after intragastric administration.Conclusion:According to the results of MS data analysis,9 prototypes that can enter the blood circulation in the form of a prototype can be used as the quality control component of the medicinal material,and they were selected as quality control components of Radix Gentiana Macrophylla,including loganic acid,secologanoside,6′-O-β-D-glucosyl-gentiopicroside,swertiamarine,gentiopicroside,sweroside,isovitexin,icariin and oleanolic acid.
Keywords Radix Gentianae Macrophyllae; Multicomponent drug metabolism; Quality control ingredients; Quality control; UPLC-MS/MS(R)
中圖分类号:R284.1文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.13.009
秦艽药材主产于中国西北地区,为龙胆科植物秦艽Gentiana macrophylla Pall.、麻花秦艽Gentiana straminea Maxim.、粗茎秦艽Gentiana crassicaulis Duthie ex Burk.和小秦艽Gentiana dahurica Fisch.的干燥根。在2015年版的《中华人民共和国药典》中,以龙胆苦苷和马钱苷酸作为秦艽药材含量测定的质控标准[1]。然而,秦艽中含有环烯醚萜苷类、黄酮类及三萜类等多类化学成分[2],仅仅以这2个指标性成分作为质控无法全面评定药材的质量。另外,如何筛选药材中的药效活性成分,并将其运用于中药材生产和加工等各个环节的质控过程,一直以来是中药多学科交叉研究的难题。现代药理学研究认为,药物发挥药效的前提在于,药物能够透过层层的生物屏障到达作用靶点[3]。因此,本研究运用动物在体肠道灌流等精细的手术方法结合精密的液质联用检测技术,全面表征药材本身和药材在不同部位血液的成分并将其从时间和空间维度关联,以系统描绘药材中化学成分进入人体血液循环的动态变化,从而获得药材的血中移行成分作为中药质控的潜在指标性成分。该研究可以为进一步提升秦艽药材的质控标准提供可靠的依据,也可以为药材后期的药理研究和临床运用提供参考。
1 材料与方法
1.1 材料
1.1.1 动物 SD雄性大鼠,SPF级,质量约200~250 g,购自斯贝福(北京)生物技术有限公司,实验动物生产许可合格证号:SCXK(京)2016-0002,并已通过北京中医药大学伦理部的伦理审批。实验前将大鼠置于昼夜节律光照条件下,自由进食进水,适应性饲养7 d。
1.1.2 药物 秦艽药材采集于青海省互助县和湟中县,经北京中医药大学王晶娟副教授鉴定为麻花秦艽Gentiana straminea Maxim.的干燥根。马钱苷酸对照品(中国食品药品检定研究院,批号:111865-201704),异牡荆素对照品(上海源叶生物科技有限公司,批号:Y07J8H39516),齐墩果酸对照品(中国食品药品检定研究院,批号:110709-201808),龙胆苦苷对照品(上海源叶生物科技有限公司,批号:Y30J9Q66926),淫羊藿苷对照品(中国食品药品检定研究院,批号:110737-201516),异荭草苷对照品(中国食品药品检定研究院,批号:111974-201401),獐牙菜苦苷对照品(中国食品药品检定研究院,批号:110785-201404),獐牙菜苷对照品(上海源叶生物科技有限公司,批号:P29N8F49264)。
1.1.3 试剂与仪器 固相萃取柱(美国Waters公司,型号:OASIS PRIME HLB Cartridge),娃哈哈纯净水(杭州娃哈哈集团有限公司,批号:20190519),甲醇(赛默飞世尔科技有限公司,批号:193728),乙腈(赛默飞世尔科技有限公司,批号:186350)为色谱级,其余试剂均为分析纯。超高效液相色谱-四级杆/静电场轨道阱高分辨质谱联用仪(赛默飞世尔科技公司,美国,型号:UltiMate 3000-Q-Orbitrap),包括UltiMate 3000超高效液相色谱仪、Q-Exactive四级杆-静电场轨道阱高分辨质谱仪、DAD检测器、Xcalibur质谱工作站;电子分析天平(Sartorius公司,德国,型号:BSA2202S);电子分析天平(Sartorius公司,德国,型号:BSA124S);超声波清洗器(昆山市超声仪器有限公司,型号:KQ5200E);电热恒温水浴锅(北京科伟永兴仪器有限公司,型号:HH-2A);高速离心机(北京白洋医疗器械有限公司,型号:BY-400C);水浴氮吹仪(北京成萌伟业科技有限公司,型号:CM-12);蠕动泵(保定兰格恒流泵有限公司,型号:BT-100-1F)。
1.2 方法
1.2.1 分组 将大鼠分为肠代谢手术组、肝代谢手术组与综合代谢手术组。
1.2.2 给药方法 1)秦艽水提液制备:称取秦艽药材1.02 g,加入100 mL蒸馏水回流1 h,过0.22 μm滤膜过滤,弃去初滤液,即得。2)肠代谢手术组:取4只禁食12 h大鼠(不禁水),腹腔麻醉,腹主动脉采血置于预先涂抹肝素钠的离心管中。收集的血液置于37 ℃水浴中,用于补充手术鼠实验过程中损失的血液。另取一只同样禁食大鼠腹腔麻醉,小心剖离颈静脉,插管。管的另一端通過蠕动泵连接到刚刚取出的血液中。沿腹中线剪开腹腔,选取空肠段约10 cm作为供试肠段,结扎实验用肠段以外的血管。37 ℃生理盐水缓慢冲出肠内容物,至流出液澄清,继续充入空气将生理盐水排净。注射泵与肠段进口端相连,灌流(0.2 mL/min)一定量秦艽水提液(1 g/mL)。用37 ℃生理盐水润湿的纱布覆盖在裸露肠段上,保温灯加热。结扎肝门静脉及旁支有干扰的细血管,同时开启蠕动泵,进行颈静脉输血(流速0.3 mL/min),肠系膜静脉采血。连续采血2 h,平行操作3组。空白组给药生理盐水,其余操作相同。3)肝代谢手术组:不结扎肝门静脉,在股静脉处采血,其余操作同“肠代谢手术组”。4)综合代谢手术组:选取12只SD大鼠,将大鼠随机分为4组,每3只为1组,灌胃给与秦艽水提液(1 g/mL),各组分别于0.5 h、1 h、1.5 h、2 h用10%水合氯醛腹腔注射进行麻醉处理,于腹主动脉处采集血液样品。空白组灌胃给与等量生理盐水,其余操作相同。
1.2.3 检测指标与方法 1)对照品溶液制备:分别精密称取上述8个对照品适量,加适量甲醇完全溶解后稀释至浓度约为10 ng/mL,0.22 μm滤膜过滤,取续滤液即得各化合物的对照品溶液。2)血浆样品前处理:1.5 mL血浆样品+1.5 mL 4 %磷酸,涡旋1 min,放置5 min后3 mL全部上样固相萃取柱,接收的流出液标为1;再用5%甲醇1 mL进行清洗,接收流出液标为2;最后用90:10的乙腈:甲醇1 mL进行洗脱,用另一个离心管接收流出液并标为3;在洗脱过程中尽量降低流速使其成滴流下,将洗脱液3过0.22 μm滤膜,进行LC-MS分析。空白血浆处理方法除将1.5 mL血浆样品换成1.5 mL空白血浆外,其余操作步骤一致。3)测定条件:液相条件:色谱柱:CORTECS UPLC T3(100 mm×2.1 mm,1.6 μm);流速:0.3 mL/min;流动相:0.1%甲酸(A)-乙腈(B),梯度洗脱(0~1 min,95%→95% A;1~20 min,95%→5% A;20~21 min,5%→5% A;21~21.1 min,5%→95% A;21.1~22 min,95%→95% A);进样体积:2 μL;检测波长:190~400 nm(DAD检测器);柱温:40 ℃;质谱条件:电喷雾电离源(HESI源);正、负离子检测模式;扫描范围:100~1 500 Da;喷雾电压:+3.5 kV(正离子模式),+3.0 kV(负离子模式);鞘气体积流量:35 arb;辅助气体积流量:10 arb;辅助气温度:250 ℃;离子传输管温度:300 ℃;扫描模式:Full MS/dd-MS2,Full MS分辨率为70 000,dd-MS2分辨率为17 500;碰撞能为:20、30、40 eV。4)数据处理及代谢物鉴定:通过精确相对分子质量及二级碎片离子信息,与对照品的保留时间、mzVault 2.0质谱数据库、HMDB数据库及相关文献报道数据比对,对秦艽水提液及代谢样品中的成分进行鉴定。
2 结果
2.1 秦艽水提液中化学成分鉴定
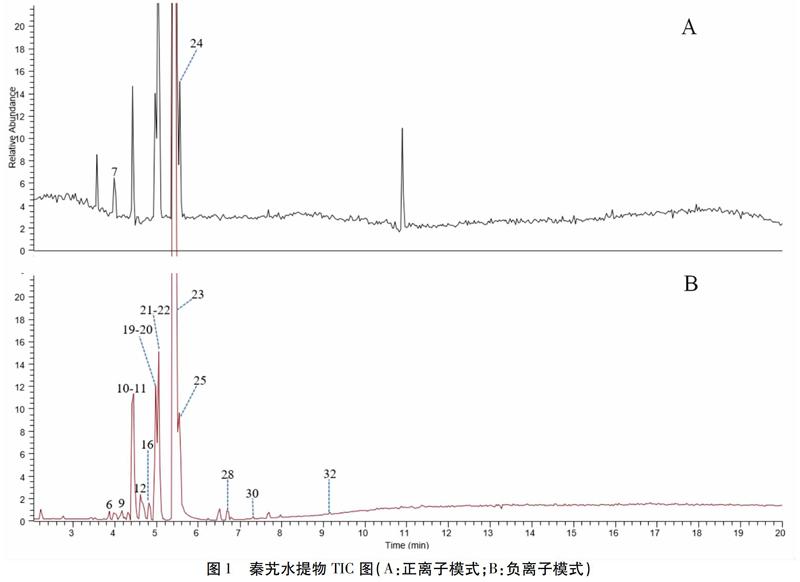
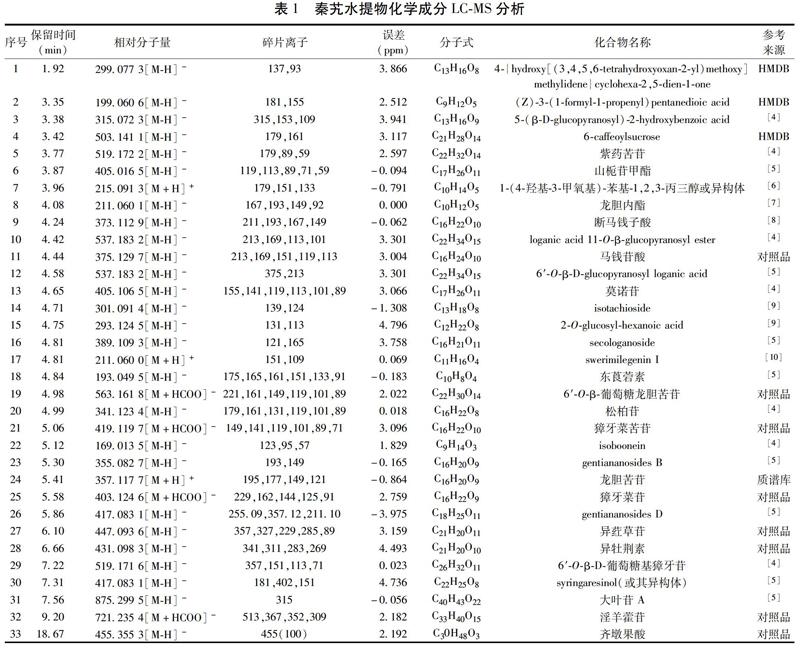
秦艽水提液的总离子流图(TIC图)见图1,共鉴定出33个化学成分,其中3个有机酸类成分、3个黄酮类化合物、1个香豆素类化合物、1个木脂素类化合物、1个三萜类化合物、17个环烯醚萜类化合物和7个其他类化合物,结果见表1,具体分析如下:
化合物1 一级质谱分子离子峰为m/z 299.077 3[M-H]-,软件给出的精确分子式为C13H16O8(Error in ppm为3.866),其二级碎片离子有m/z 137和m/z 93,通过与HMDB数据库中图进行比较,推测化合物1为4-{hydroxy[(3,4,5,6-tetrahydroxyoxan-2-yl)methoxy]methylidene}cyclohexa-2,5-dien-1-one。
化合物2 一级质谱分子离子峰为m/z 199.060 6[M-H]-,軟件给出的精确分子式为C9H12O5(Error in ppm为2.512),有二级碎片离子m/z 181[M-H-H2O]-,m/z 155[M-H-CO2]-,通过与HMDB数据库中图谱进行比较,推测该化合物为(Z)-3-(1-formyl-1-propenyl)pentanedioic acid。
化合物3 一级质谱分子离子峰为m/z 315.072 3[M-H]-,软件给出的精确分子式为C13H16O9(Error in ppm为3.941),二级碎片离子有m/z 153[M-H-162]-,m/z 109[M-H-162-CO2]-,通过与文献[4]对比推测该化合物为5-(β-D-glucopyranosyl)-2-hydroxybenzoic acid。
化合物4 一级质谱分子离子峰为m/z 503.141 1[M-H]-,软件给出的精确分子式为C21H28O14(Error in ppm为3.117),m/z 179[M-H-C15H17O8]-,m/z 161[M-H-C15H17O8-H2O]-,通过与HMDB数据库中图谱进行比较,推测该化合物为6-caffeoylsucrose。
化合物5 一级质谱分子离子峰为m/z 519.172 2[M-H]-,软件给出的精确分子式为C22H32O14(Error in ppm为2.597),其二级碎片离子有m/z 179、m/z 89、m/z 59,与文献[4]给出的碎片离子相同,推测该化合物5为紫药苦苷。
化合物6 一级质谱分子离子峰为m/z 405.016 5[M-H]-,软件给出的精确分子式为C17H26O11(Error in ppm为-0.094),其二级碎片离子有m/z 119、m/z 113、m/z 89、m/z 71、m/z 59,与文献报道[5]的碎片离子相同,故推测化合物6为山栀苷甲酯。
化合物7 一级质谱分子离子峰为m/z 215.093 1[M+H]+,软件给出的精确分子式为C15H14O5(Error in ppm为-0.791),其二级碎片离子有m/z 179[M+H-2H2O]+,m/z 151[M+H-2H2O-CO]+,m/z 133,根据与文献[6]对比推测该化合物为1-(4-羟基-3-甲氧基)-苯基-1,2,3-丙三醇或其异构体。
化合物8 一级质谱分子离子峰为m/z 211.060 1[M-H]-,软件给出的精确分子式为C10H12O5(Error in ppm为0),其二级碎片离子有m/z 193[M-H-H2O]-,m/z 149[M-H-H2O-CO2]-,m/z 93[M-H-H2O-C4H7O2]-,结合文献报道[7],推测该化合物为龙胆内酯。
化合物9 一级质谱分子离子峰为m/z 373.112 9[M-H]-,软件给出的精确分子式为C12H22O10(Error in ppm为-0.062),其二级特征碎片有丢失葡萄糖残基形成的 m/z 210.93[M-H-C6H11O5]-和继续丢失羧基上的一分子羟基形成的m/z 193[M-H-C6H11O5-H2O]-,推测该化合物为断马钱子酸[8]。
化合物10和12为同分异构体,一级质谱分子离子峰均为m/z 537.183 2[M-H]-,软件给出的精确分子式为C22H34O15(Error in ppm为3.301)。化合物10的二级碎片离子有m/z 213、m/z 169、m/z 113、m/z 101,与文献报道[24]的碎片离子相同,故推测化合物10为loganic acid 11-O-β-glucopyranosyl ester。化合物12的碎片离子有m/z 375和m/z 213,通过与文献[5]比较推测化合物12为6′-O-β-D-glucopyranosyl loganic acid。
化合物11 保留时间为4.44 min,一级质谱分子离子峰为m/z 357.1297[M-H]-,其二级特征碎片有丢失葡萄糖基的m/z 213[M-H-C6H11O5]-和m/z 169[M-H-C6H11O5-CO2]-。通过与马钱苷酸对照品保留时间和质谱数据对比,确定该化合物为马钱苷酸。
化合物13 一级质谱分子离子峰为m/z 405.106 5[M-H]-,软件给出的精确分子式为C17H26O11(Error in ppm为3.066),其二级碎片离子有m/z 155、m/z 141、m/z 119、m/z 113、m/z 101,与文献[4]报道的碎片离子相同,故推测化合物13为莫诺苷。
化合物14 一级质谱分子离子峰为m/z 301.091 4[M-H]-,软件给出的精确分子式为C13H18O8(Error in ppm为-1.308),其二级碎片离子有m/z 139[M-H-162]-,为丢失一分子葡萄糖基形成的碎片离子,m/z 139[M-H-162-CH3]-为丢失一分子葡萄糖基和甲基后的碎片离子,根据文献[9]推测该化合物为isotachioside。
化合物15 一级质谱分子离子峰为m/z 293.124 5[M-H]-,软件给出的精确分子式为C12H22O8(Error in ppm为4.796),有丢失一分子葡萄糖基后产生的碎片离子m/z 131[M-H-162]-和丢失一分子葡萄糖基又丢失一分子H2O的碎片离子m/z 131[M-H-162-H2O]-,根据文献[9]推测该化合物为2-O-glucosyl-hexanoic acid。
化合物16 一级质谱分子离子峰为m/z 389.103 9[M-H]-,软件给出的精确分子式为C16H21O11(Error in ppm为3.758),二级特征碎片离子有m/z 165和m/z 121,根据文献[5]推测该化合物为secologanoside。
化合物17 一级质谱分子离子峰为m/z 211.060 0[M+H]+,软件给出的精确分子式为C11H16O4(Error in ppm为0.069),二级特征碎片离子有m/z 151和m/z 109,根据文献[10]推测该化合物为swerimilegenin I。
化合物18 一级质谱分子离子峰为m/z 193.049 5[M-H]-,软件给出的精确分子式为C10H8O4(Error in ppm为-0.183),其二级碎片离子有m/z 175、m/z 165、m/z 161、m/z 151、m/z 133,与文献报道[5]的碎片离子相同,故推测化合物18为东莨菪素。
化合物19 一级质谱分子离子峰为m/z 563.161 8[M+HCOO]-,通过与对照品的保留时间和质谱数据比较确定该化合物为6′-O-β-葡萄糖龙胆苦苷。
化合物20 一级质谱分子离子峰为m/z 341.123 4[M-H]-,软件给出的精确分子式为C16H22O8(Error in ppm为-0.183),二级碎片离子有丢失一分子葡萄糖基的碎片离子m/z 179[M-H-162]-和丢失一分子葡萄糖基与一分子H2O的碎片离子m/z 161[M-H-162-H2O]-,根据参考文献[4]推测该化合物为松柏苷。
化合物21 一级质谱分子离子峰为m/z 419.119 7[M+HCOO]-,通过与对照品的保留时间和质谱数据比较确定该化合物为獐牙菜苦苷。
化合物22 一级质谱分子离子峰为m/z 169.013 5[M-H]-,软件给出的精确分子式为C9H14O3(Error in ppm为1.829),二级特征碎片离子有m/z 123[M-H-C3H11]-、m/z 95[M-H-C4H11O]-和m/z 57,根据文献[4]推测该化合物为isoboonein。
化合物23 一级质谱分子离子峰为m/z 355.082 7[M-H]-,软件给出的精确分子式为C16H20O9(Error in ppm为-0.165),二级特征碎片离子为丢失一分子葡萄糖基后的苷元m/z 193[M-H-162]-和丢失一分子羧基与葡萄糖残基的碎片离子m/z 193[M-H-162-CO2]-,由于gentiananosides B与葡萄糖基团有2个键连接,其苷元只有一个双键,根据二级碎片裂解规律和文献[5]推测该化合物为gentiananosides B。
化合物24 一级质谱分子离子峰为m/z 211.060 0[M+H]+,软件给出的精确分子式为C16H20O9(Error in ppm为-0.864),特征二级碎片离子有m/z 195[M+H-162]+、m/z 177[M+H-162-H2O]+、m/z 149[M+H-162-H2O-CO]+,经过与mzVault 2.0质谱库进行对比确定该化合物为龙胆苦苷。
化合物25 一级质谱分子离子峰为m/z 403.124 6[M+HCOO]-,通过与对照品的保留时间和质谱数据比较确定该化合物为獐牙菜苷。
化合物26 一级质谱分子离子峰为m/z 417.083 1[M-H]-,软件给出的精确分子式为C18H25O11(Error in ppm为-3.975),二级碎片离子有m/z 357、m/z 255、m/z 211,根据文献[5]分析推测该化合物为gentiananosides D。
化合物27 一级质谱分子离子峰为m/z 477.093 6[M-H]-,软件给出的精确分子式为C21H20O11(Error in ppm为3.159),特征二级碎片离子m/z 477.093 6[M-H-162]-,通过与对照品的保留时间和质谱数据进行对比,确定该化合物为异荭草苷。
化合物28 一級质谱分子离子峰为m/z 431.098 3[M-H]-,软件给出的精确分子式为C21H20O10(Error in ppm为4.493),二级特征碎片离子有m/z 341[M-H-C3H6O3]-,m/z 283[M-H-C3H6O3-C2H4O2]-,m/z 341[M-H-C6H5O-CO2]-,通过与对照品比较确定化合物28为异牡荆素。
化合物29 一级质谱分子离子峰为m/z 519.171 6[M-H]-,软件给出的精确分子式为C26H31O11(Error in ppm为0.023),二级特征碎片离子有m/z 357[M-H-162]-,根据文献[4]推测该化合物为6′-O-β-D-葡萄糖基獐牙苷。
化合物30 一级质谱分子离子峰为m/z 417.083 1[M-H]-,软件给出的精确分子式为C22H25O8(Error in ppm为4.736),二级特征碎片离子有m/z 402[M-H-CH3]-、m/z 181[M-H-C13H16O4]-,根据二级碎片裂解规律和文献分析[5]推测该化合物为syringaresinol。
化合物31 一级质谱分子离子峰为m/z 875.299 5[M-H]-,软件给出的精确分子式为C40H43O22(Error in ppm为-0.056),二级特征碎片离子有m/z 315,通过与文献[5]比较推测该化合物为大叶苷A。
化合物32 一级质谱分子离子峰为m/z 721.235 4[M+HCOO]-,软件给出的精确分子式为C40H43O22(Error in ppm为-0.056),通过与对照品的保留时间和质谱数据对比确定化合物32为淫羊藿苷。
化合物33 一级质谱分子离子峰为m/z 455.355 3[M-H]-,软件给出的精确分子式为C33H40O15(Error in ppm为2.192),通过与对照品的保留时间和质谱数据对比确定化合物32为齐墩果酸。
2.2 秦艽代谢成分鉴定
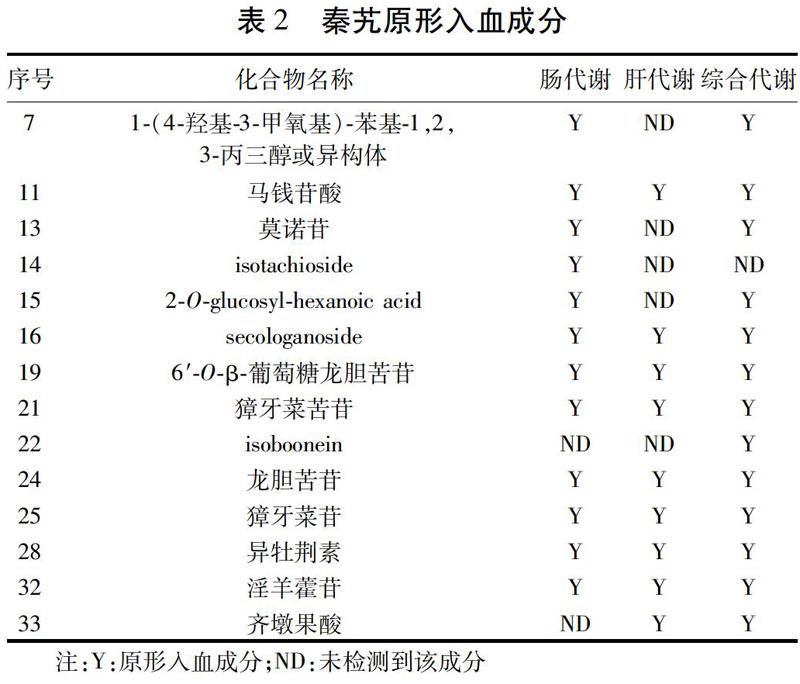
通过对各血浆样品进行LC-MS分析,并与水提物中化学成分对比,可获得各血液样本中的原型成分,结果见表2。1-(4-羟基-3-甲氧基)-苯基-1,2,3-丙三醇或其异构体、莫诺苷、isotachioside和2-O-glucosyl-hexanoic acid经过肠道后可以检测到,但在经肝脏代谢后的血浆中没有发现这些成分,推测其可能被肠壁吸收后在肝脏中被代谢;齐墩果酸经过到后未检测到,后经过肝脏又重新出现,其在综合代谢的血液样本中也可以检测到,说明其经过肠道被代谢,后经过肝代谢重新生成。isoboonein在灌流方法的血液样本中未检测到,但在综合代谢的样本中可以检测到,说明其存在通过胃黏膜吸收的可能,这也是灌流方法存在的一个重大缺陷。药典中的秦艽指标成分马钱苷酸和龙胆苦苷在所有的血液样本中均能检测到,说明这2个化合物吸收较好,性质较稳定。如表2所示,由于肝代谢后的9个成分均可以在综合代谢的样品中检测到,说明这9个成分出现在人体血中血液循环的可能性较高,是潜在的药效成分,因此可以将这9个成分作为秦艽质量控制的候选指标性成分。
3 讨论
本研究基于中药传统汤剂口服用药的特点,运用肠道灌流并行血液灌流的方法模拟并获得了中药在不同时间点和不同的代谢位点(空间)的多成分组成,并系统展示了药材提取物的多成分动态变化轮廓。通过表2分析可知,共有9个原型成分可以在肝代谢后的血液中检测到,说明这些成分可以进入人体的血液循环,是潜在的发挥药效作用的成分,可以初步作为秦艽药材质控的指标性成分。当然,药物在血中的移行成分除了原型成分外,还有其代谢物,由于其鉴定工作量大,含量较低,该研究暂不考虑。另外,就药材质控成分遴选而言,药材成分的代谢物不便于在药材中直接追溯,无法将其作为质控成分。同时,为了克服传统血浆样品溶剂萃取法的缺陷并尽可能富集血浆中各种不同化学结构类型的成分,我们借助SPE柱对中药血浆样品中的多成分进行检测。该技术的最大特点如下:1)该方法对于血中基质成分去除效果极其明显,可以最大限度减少基质效应的影响;2)该方法可以针对不同化学成分的极性,分别收集不同洗脱部位的流份;3)该方法可以针对拟处理的化学成分酸碱性不同而采用不同类型的SPE柱,从而达到更优的血浆成分富集的效果;4)该方法不仅可以去除血中蛋白、基质等影响,而且可以达到浓缩目标分析物的作用,从而提高检测的灵敏度。综上所述,该研究可以为中药或中药复方质控成分的遴选提供一套切实可行的研究方法。
参考文献
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:270-271.
[2]赵伟刚.小秦艽花化学成分及质量评价研究[D].呼和浩特:内蒙古医科大学,2019.
[3]李川.中药多成分药代动力学研究:思路与方法[J].中国中药杂志,2017,42(4):607-617.
[4]陈俊可,曾锐.基于UPLC-ESI-HRMS~n的代谢组学技术对粗茎秦艽不同部位化学成分研究[J].中草药,2018,49(10):2328-2335.
[5]王长生,董红娇,包雅婷,等.UPLC-Q-Exactive四级杆-静电场轨道阱高分辨质谱联用快速分析粗茎秦艽化学成分[J].中草药,2016,47(18):3175-3180.
[6]朱广伟,李西文,李琦,等.基于传统煎药工艺的龙胆饮片标准汤剂制备及质量评价方法研究[J].中草药,2017,48(20):4253-4260.
[7]Tan RX,Wolfender JL,Zhang LX,et al.Acylsecoiridoids and antifungal constituents from Gentiana macrophylla[J].Phytochemistry,1996,42(5):1305-1313.
[8]Xu M,Zhang M,Zhang YJ,et al.New acylated secoiridoid glucosides from Gentiana straminea(Gentianaceae)[J].Helv Chim Acta,2009,92(2):321-327.
[9]Li S,Wan C,He L,et al.Rapid identification and quantitative analysis of chemical constituents of,Gentiana veitchiorum,by UHPLC-PDA-QTOF-MS[J].Rev Bras Farmacogn,2017,27(2):188-194.
[10]He YM,Zhu S,Ge YW,et al.Secoiridoid glycosides from the root of Gentiana crassicaulis with inhibitory effects against LPS-induced NO and IL-6 production in RAW264 macrophages[J].J Nat Med,2015,69(3):366-374.
(2020-06-10收稿 責任编辑:徐颖)
