基于蛋白质组学技术测定全蝎中β-肌动蛋白的含量
2020-08-07梁瑞强孙姗姗曹进康帅林瑞超邹迪新
梁瑞强 孙姗姗 曹进 康帅 林瑞超 邹迪新


摘要 目的:通过蛋白质组学技术手段找到适用于药材全蝎含量测定的目标蛋白质及其特征肽段,用该特征肽段形成定量方法。方法:全蝎粉碎后经PBS缓冲溶液超声提取并过滤后,得到药材的蛋白质提取溶液。上述溶液经胰蛋白酶酶解后通过高分辨质谱进行分析,确定待测的目标蛋白质(β-肌动蛋白)和与之对应的特征肽段(IIAPPER),并进行特征肽段及其同位素内标物(IIA*(13C3,15N)PPER)的合成。用得到特征肽段做对照品,同位素内标物做内标进行含量测定。色谱柱为Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm),流动相为0.1%甲酸溶液(V/V)-水和乙腈,梯度洗脱。质谱使用电喷雾离子源(ESI)正离子模式,采用多反应监測模式(MRM)进行信号采集。定量方法为内标法。结果:β-肌动蛋白的特征肽段在0.1~40 nmol/L浓度范围内线性良好,相关系数(r2)在0.999以上。方法检出限为0.04 mg/kg,定量限为0.13 mg/kg。加标回收率在87%~93%,重复性的RSD为5.2%,中间精密度的RSD为4.8%,供试品溶液在4 h内稳定。利用该方法对来自不同产地的37批次全蝎药材中的β-肌动蛋白进行含量测定,结果在4.66~100.26 mg/kg之间。结论:该方法灵敏度高,准确度较好和重复性较稳定,可以为全蝎药材药材的质量控制提供一种有效的手段。
关键词 全蝎;超高效液相色谱串联质谱法;蛋白质组学;β-肌动蛋白;含量测定;质量控制
Abstract Objective:To find the target protein and its characteristic peptides suitable for the determination of the whole scorpion of medicinal materials by means of proteomics,and to use this characteristic peptide to form a quantitative method.Methods:After the whole scorpion was crushed,it was ultrasonically extracted with PBS buffer solution and filtered to obtain the protein extract solution of the medicinal material.The above solution was analyzed by high-resolution mass spectrometry after trypsin digestion to determine the target protein to be tested(β-actin)and the corresponding characteristic peptide(IIAPPER),and the characteristic peptide and its isotope internal standard synthesis(IIA*(13C3,15N)PPER).The obtained characteristic peptide was used as a reference substance,and the isotopic internal standard was used as an internal standard for content determination.The column was Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm),the mobile phase was 0.1% formic acid solution(V/V)-water and acetonitrile,and the gradient eluted.Mass spectrometry used the electrospray source ion(ESI)positive ion mode and the multi-reaction monitoring mode(MRM)for signal acquisition.The quantitative method was the internal standard method.Results:The characteristic peptide of β-actin was well linear in the concentration range of 0.1-40 nmol/L,and the correlation coefficient(r2)was above 0.999.The detection limit of the method was 0.04 mg/kg,and the limit of quantification was 0.13 mg/kg.The recovery rate of spiked standard was 87%-93%,and the repeatable RSD is 5.2%.The intermediate precision RSD was 4.8%,and the test solution was stable within 4 h.Using this method,the content of β-actin in 37 batches of whole scorpion medicinal materials from different origins was determined,and the result was between 4.66-100.26 mg/kg.Conclusion:The method has high sensitivity,good accuracy and stable repeatability,and can provide an effective method for the quality control of the whole scorpion medicinal materials.
Keywords Whole scorpion; UPLC-MS; Proteomics; β-actin; Content determination; Quality Control
中图分类号:R284.1文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.13.002
全蝎为东亚钳蝎Buthus martensii Karsch的干燥体,生物学分类属于节肢动物门蛛形纲蝎目钳蝎科,作为平肝熄风的常用药材之一,多被用于中医临床治疗痉挛抽搐、疮疡中毒、瘰疬结核、风湿顽痹和顽固性偏正头痛等疾病,同时具有抗凝血、抗肿瘤、抗癫痫和抗菌等药理作用[1-5]。全蝎作為药用始于五代的《蜀本草》,称之为“主簿虫”“蛜虫祁”[6]。在《中华人民共和国药典》2015年版一部中以“全蝎”为正名,目前该药材的定质量标准主要由性状、显微鉴别、黄曲霉毒素检查项、浸出物组成[7]。这些检测项目虽然在一定程度上能反映全蝎药材的质量,但整体内容相对简单。为更好地控制全蝎的质量,保障临床用药的安全性和有效性,有必要针对该药材的特点对其质量标准进行完善和提升。
全蝎作为由动物干燥体入药的药材,本身含有较多的蛋白质。其功效成分之一的蝎毒也包括蛋白质和非蛋白质2个组成部分[8]。通过测定具有一定代表性的蛋白质的含量,可以在一定程度上反映全蝎的质量。而针对蛋白质的检测方法中,与依赖于抗体技术的酶联免疫吸附(ELISA)等方法相比,质谱技术不仅可以通过不同离子间的质荷比(m/z)差异来分离并确定其相对分子质量且可以同时鉴定多种蛋白质,具有高灵敏度、高准确度、易自动化、专属性强等优点,故而成为该研究的热门方向之一[9]。将蛋白质酶解成不同长度的多肽进行质谱分析可以同时实现蛋白质鉴定与定量的需求[9-10]。
本研究基于蛋白质组学技术,使用经高分辨质谱筛选出的全蝎的生物标志物(特征肽段),使用该特征肽段作为对照品来形成在超高液相色谱串联三重四级杆质谱上的含量测定检测方法,并用特征肽段的合成同位素内标肽段为内标物,进行内标法定量。由于筛选后的特征肽段的摩尔浓度在数值上等于β-肌动蛋白质的摩尔浓度,根据公式:样品蛋白质的含量(m/m)=特征肽段的物质的量×蛋白质的分子量/样品取样量,可以计算出全蝎药材中β-肌动蛋白的含量。该方法可以用于全蝎药材的含量测定方法,为完善全蝎质量标准提供了一种可行的技术手段。
1 仪器与试药
1.1 仪器
高分辨质谱仪(美国Thermo Scientific公司,型号:Q-Extractive plus Orbitrap,配有美国Thermo Scientific公司的Dionex Ultimate 3000 RSLC纳流系统,并配有美国New Objective公司的DPV550 digital picoVIEW nanospray离子源);超高效液相色谱串联三重四级杆质谱仪(美国Waters公司,型号:UPLC-Xevo TQ-S);移液枪(德国Eppendorf公司,量程分别为10~100 μL、l00~1 000 μL和1~10 mL);超纯水器(德国Sartorius stedim公司,型号:H2Opro-DI-B);分析天平(瑞士METTLER TOLEDO公司,型号:AL204);分析天平(瑞士METTLER TOLEDO公司,型号:XP205);超声仪(昆山市超声仪器有限公司,型号:KQ-700DE);恒温水浴摇床(上海智城分析仪器制造有限公司,型号:ZWF-110X30);涡旋振荡混合器(美国Scientific Industries公司,型号:VORTEX-GENIE 2);离心机(日本HITACHI公司,型号:CF16RXⅡ);离心机(美国Thermo Scientific公司,型号:SORVALL Legend MICRO 21 R);C18毛细管柱(美国New Objective公司,75 μm×15 cm,3 μm);AcclaimTM PepMapTM 100 Trap C18柱(美国Thermo Scientific公司,100 μm×2 cm,5 μm,100 );ACQUITY UPLC HSS T3亲水柱(美国Waters公司,2.1 mm×100 mm,1.8 μm)。
1.2 试剂
β-肌动蛋白特征肽段IIAPPER(4.3 mg,HPLC纯度≥98.37%,M分子量=794.96 g/mol)(上海吉尔生化有限公司,批号:P190422-TL715280);β-肌动蛋白特征肽段内标IIA*(13C3,15N)PPER(4.5 mg,HPLC纯度≥98.63%%,M分子量=799.02 g/mol,A*(13C3,15N)为同位素标记丙氨酸)(上海吉尔生化有限公司,批号:P190828-MJ745241);甲酸(美国Sigma-Aldrich公司,质谱级,批号:BCBR6503V);乙腈(美国Fisher Scientific公司,质谱级,批号:194036);PBS片剂(北京索莱宝科技有限公司,批号:121D035,临用时取1片加入100 mL水中,超声溶解后得到PBS缓冲溶液);胰蛋白酶(美国Thermo Scientific公司,质谱级,批号:UA278568);实验用水均由超纯水器(Sartorius stedim,型号:H2Opro-DI-B)制备,电阻率为18.2 M·cm。
1.3 分析样品
本实验使用的37批全蝎药材采购于中药材公司、药店或由制药公司提供,经中国食品药品检定研究院康帅副研究员鉴定为钳蝎科动物东亚钳蝎Buthus martensii Karsch的干燥体,见表8,其中HB、HN、SX、SD、LN分别代表产地为河北、河南、山西、山东、辽宁,BC代表由步长制药提供。
2 方法与结果
2.1 色谱质谱条件
色谱条件:色谱柱:ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm);柱温:30 ℃;样品室温度:10 ℃;分析时间:11 min;流量:0.3 mL/min;进样量5 μL。流动相A为0.1%甲酸(V∶V)-水溶液,B为乙腈。梯度洗脱:0~1.0 min,5%B;1.0~7.0 min,5%B~90%B;7.0~7.1 min,90%B~100%B;7.1~9.0 min,100%B;9.0~9.1 min,100%B~5%B;9.1~11.0 min,5%B。
质谱条件:电喷雾离子源;正离子扫描模式;多反应监测(MRM)模式;毛细管电压3.5 kV,锥孔电压10 V,偏转电压50 V;脱溶剂气温度500 ℃;离子源温度150 ℃;锥孔气流量150 L/h,脱溶剂气流量800 L/h。
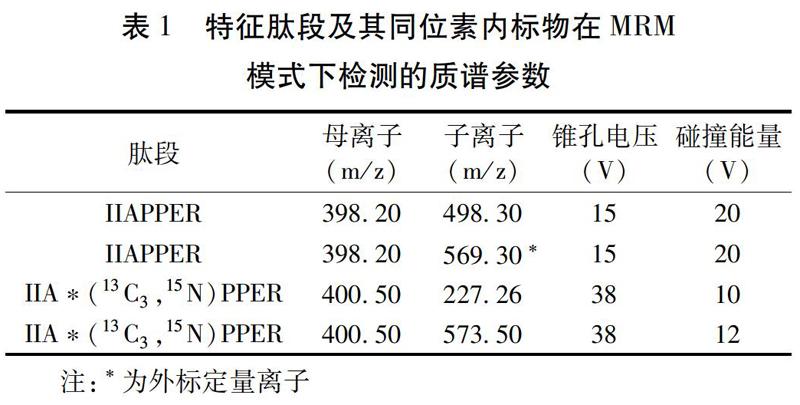
使用UPLC-Xevo TQ-S质谱的IntelliStart技术自动优化MRM通道,确定了特征肽段和同位素内标物的最佳质谱条件。见表1。
2.2 对照品溶液的制备
根据标准特征肽段的纯度和相对分子质量计算称样量,公式为n=mM,其中n为标准肽段的物质的量(mmol),m为称样量(mg),M为相对分子质量(g/mol)。精确称取适量的特征肽段IIAPPER和同位素内标IIA*(13C3,15N)PPER后,分别用PBS缓冲溶液溶解,用水稀释,得到标准曲线工作溶液浓度分别为0.1 nmol/L、1.0 nmol/L、5.0 nmol/L、10.0 nmol/L、20.0 nmol/L和40 nmol/L,标准曲线工作溶液中同时含有内标浓度为20 nmol/L。
2.3 供试品溶液的制备
全蝎药材经粉碎混匀,过三号筛,取药材粉末约0.1 g,精密称定,置10 mL纳氏比色管中,精密加入10 mL PBS缓冲溶液,密塞,称定重量,水浴提取30 min。放冷后,再称定重量,用上述PBS缓冲溶液补足减失的重量,溶液于10 000 r/min,离心半径10.7 cm,离心5 min,上清液经0.22 μm滤膜过滤。
酶解:精密量取上述滤液200 μL至1.5 mL EP管中,加入10 μg胰蛋白酶,加入0.1 mL 200 nmol/L内标溶液,涡旋混匀,于37 ℃反应6 h,加入10 μL甲酸终止反应,补加水至1.0 mL,10 000 r/min,离心半径8.6 cm,离心5 min,上清液供分析用。
2.4 专属性试验
精密量取用于药材提取的PBS缓冲液200 μL至1.5 mL EP管中,按2.3中酶解步骤进行处理(不添加内标溶液)得到方法空白溶液,进样分析。同时采集了对照品溶液(IIAPPER 5 nmol/L,IIA*(13C3,15N)PPER 20 nmol/L)和供试品溶液的图谱。结果表明,对照品溶液和供试品溶液中特征肽段和同位素内标均在3 min内出现相同保留时间的色谱峰,峰形符合定量要求且分离度良好,同时方法空白溶液在相同保留时间处未见色谱峰,故认为无干扰。对照品、供试品和方法空白的MRM、TIC谱图见图1~3。
2.5 线性关系考察
用特征肽段外标的物质的量浓度与同位素内标的物质的量浓度的比值为横坐标(X轴),特征肽段外标的峰面积与同位素内标峰面积的比值为纵坐标(Y轴),得到特征肽段的标准曲线方程Y=0.546 601X+0.005 914 11,相关系数r2=0.999 974(n=6),标准曲线见图4。表明特征肽段在0.1~40 nmol/L的3个数量级范围呈现良好的线性关系(r2>0.999)。
2.6 中间精密度试验
对同一全蝎药材粉末按照2.3的步骤在不同日期制备的5份供试品溶液进行检测,得到5次测定结果的RSD为4.8%,结果表明方法的精密度良好。见表2。
2.7 供试品溶液稳定性试验
称取3份同一全蝎药材粉末,按照2.3的步骤制备供试品溶液,于室温放置,分别在0 h,2 h,4 h,8 h,10 h,12 h进样测定含量,考察提取溶液的稳定性,结果见图5。在12 h内检测结果的RSD为3.3%,通过单因素ANOVA分析和两两比较(S-N-K),可知供试品溶液在4 h內稳定(P=0.075)。
2.8 重复性试验
平行称取同一全蝎药材粉末6份,按照2.3的步骤制备供试品溶液进行分析,得到6次测定结果的RSD为5.2%,说明该方法的重复性较好。见表3。
2.9 回收率试验
由于来源于全蝎的β-肌动蛋白目前没有市售的高纯度标准品,所以无法通过向样品中添加标准蛋白的方法考察回收率,因此本次实验考察了方法的酶解回收率。具体操作方法为,选取经测定对应酶解溶液中特征肽段浓度为5.217 nmol/L的全蝎药材提取溶液(即按2.3处理到酶解步骤前的溶液)进行回收率实验。由于酶解液的定容体积为1 mL,且用于酶解反应的提取溶液即为200 μL,故用移液枪分别量取200 μL全蝎药材提取溶液,该溶液中对应的特征肽段含量应为0.005 217 nmol。特征肽段加入量与全蝎药材提取溶液中特征肽段的含量比例分别为1.5∶1,1∶1,0.5∶1左右,即分别加入0.007 5 nmol,0.005 nmol,0.002 5 nmol的特征肽段,按照2.3中的酶解步骤进行处理得到供试品溶液。经检测得到在不同的添加水平下,平均回收率在87%~93%,见表4。以上结果说明该方法的准确度较高,可以用于含量测定。
2.10 检出限和定量限
通过对已知浓度的酶解溶液进行稀释,直至待测溶液中特征肽段的定量离子的信噪比(S/N)接近3时计算得到方法检出限(Limit of Detection,LOD)为0.04 mg/kg,当定量离子的信噪比(S/N)接近10时计算得到方法定量限(Limit of Quantitation,LOQ)为0.13 mg/kg。
2.11 样品测定结果
按照所建立的检测方法对市售的37批全蝎药材进行检测,经标准曲线分析,得到供试品溶液中特征肽段的摩尔浓度,同时运用了凯氏定氮法测定了全蝎样品中的蛋白质总量,含量在317~604 g/kg,通过计算后得到样品中2组β-肌动蛋白的含量数据,一组为β-肌动蛋白占样品干重之比(以样品计),另一组为β-肌动蛋白占总蛋白之比(以总蛋白质含量计)。见表8。
3 讨论
3.1 目标蛋白质及其特征肽段的选择
3.1.1 高分辨质谱鉴定特征肽段的方法
供试品溶液制备:称取药材粉末约1.5 g至15 mL离心管中,精密称定。精密加入10 mL PBS缓冲溶液,超声30 min,10 000 r/min,离心半径10.7 cm,离心5 min,上清液经0.22 μm滤膜过滤。
酶解:精密量取上述滤液400 μL至1.5 mL EP管中,加入10 μL胰蛋白酶溶液(1 mg/mL),涡旋混匀,于37 ℃反应过夜,加入10 μL甲酸终止反应,精密加入480 μL水,10 000 r/min,离心半径8.6 cm,离心10 min,上清液经0.22 μm滤膜过滤,供分析用。
取酶解后溶液5 μL进样,0~7 min,上样泵流速为5 μL/min,经在线Trap C18柱(75 μm×15 cm,3 μm)脱盐富集。后通过分离柱New Objective C18毛细管柱(75 μm×15 cm,3 μm)分析,流动相A为0.1%甲酸(V∶V)-水溶液,流动相B为0.1%甲酸(20%水+80%乙腈)溶液(V:V),流速为300 nL/min。梯度洗脱:0~7.0 min,5%B;7.0~95.0 min,5%B~70%B;95.0~95.1 min,70%B~90%B;95.1~100.0 min,90%B;100.0~100.1 min,90%B~5%B;100.1~130.0 min,5%B。
高分辨质谱参数:扫描模式为Full MS-ddMS2,扫描质荷比(m/z)范围300~3 000,一级MS分辨率70 000,二级分辨率35 000,隔离宽度(m/z)为2,毛细管温度250 ℃,喷雾电压2.1 kV。
数据分析采用PEAKS Studio的软件中的PEAKS算法,设定FDR<0.01%。在数据软件中采用从Uniprot(http://www.uniprot.org/)下载全蝎(Buthus martensii Karsch)的所有蛋白质全序列谱库匹配搜索原始数据。确定用于含量测定的高丰度蛋白质以及该蛋白质包含的被检测到的肽段,针对选定的高丰度蛋白质的氨基酸序列通过MEGA(7.0.21)软件,使用邻域连接方法推断推断进化历史,以明确选择的目标待测蛋白质序列在物种间的特异性。根据特征肽段筛选的要求[11],确定特征肽段。
3.1.2 目标蛋白质的选择 基于Bottom up的蛋白质测序方法[12]。样品经提取和酶解后经Nano-LC液相色谱进行分离进入高分辨质谱分析,采集得到的高分辨质荷比(m/z)数据通过蛋白质组学软件PEAKS Studio与数据库中全蝎所有蛋白质的理论氨基酸全序列进行了匹配,得到了高匹配蛋白质的登记号(Accession),见表5。将最高匹配度蛋白质(-10 lgP数值最大)的登记号“tr|E6Y2S5|E6Y2S5_MESMA”在Uniprot检索得到该蛋白为来源于全蝎的β-肌动蛋白(Beta-actin),图6。通过Uniprot的“基本的局部比对搜索工具”(BLAST)检索到与全蝎β-肌动蛋白序列近似的蛋白质,将这些蛋白质的完整氨基酸序列下载后通过MEGA(7.0.21)软件进行分析,使用邻域连接方法推断进化历史。进化距离使用Poisson校正方法计算,并以每个位点的氨基酸替换数为单位。分析涉及25个氨基酸序列。其中所包含空白和缺失数据的位置都被删除。最终得到了分枝长度之和为0.063 580 50的最优树,以明确全蝎β-肌动蛋白序列在物种间的特异性。经比对发现与东亚钳蝎(全蝎)β-肌动蛋白的氨基酸序列相似的物质在外形上与全蝎有明显差异,亲缘关系由近至远为红鳍东方鲀、二斑葉螨和条虫叶螨,而与全蝎形态相似的物种的蛋白质序列未出现在相似度钓取的进化树结果中,见图7,表明若采用全蝎的β-肌动蛋白作为标志性蛋白对该物种有一定的特异性。
3.1.3 特征肽段的选择 通过PEAKS Studio软件分析得到肽段在全蝎β-肌动蛋白的理论氨基酸全序列的匹配结果。见图8。
根据胰蛋白酶对精氨酸(R)和赖氨酸(K)肽链具有选择性水解作用的特点,排除胰蛋白酶误切造成的肽段结果,筛选后得到12条肽段,见表6,根据肽段筛选要求,独特性、酶解时的可重复性、易于液相色谱串联三重四级杆质谱(LC-TQMS)系统的检测性、稳定性、特定氨基酸上修饰少、长度6~12个氨基酸等条件,筛选得到适宜的特征肽段为IIAPPER(异亮氨酸-异亮氨酸-丙氨酸-脯氨酸-脯氨酸-谷氨酸-精氨酸)。图9和表7分别显示了在高分辨质谱的HCD碰撞模式下,特征肽段的MS2谱图和碎裂呈b+和y+离子的形式,肽段碎裂后在离子化过程中,通常都要带2个以上的电荷,从而使得其质量数降低适于质谱分析。但在选择二级特征子离子碎片时,应尽量选取质量数偏大的y+离子,以避免与其他小分子物质在鉴定过程中的混淆,确保方法的准确性。在保障准确性的前提下,选取质谱响应较高的碎片,来提高检测方法的灵敏度[9]。经过筛选后,特征肽段的优选子离子分别为y5+(569.3),作为含量测定方法中的定量离子。
3.2 样品检测结果分析
37批全蝎样品的β-肌动蛋白含量(以样品干重计)在4.66~100.26 mg/kg,另一组β-肌动蛋白含量(以总蛋白质含量计)的测定范围在9.42~185.77 mg/kg。由于全蝎的炮制工艺会引入样品干重上的较大误差(水分、盐分含量不可控),且有文献报道显示不同炮制方法会在一定程度上引起总氨基酸含量差异[13-14],故干燥体质量可能不适宜作为绝对含量测定方法的结果表述单位,如果以总蛋白质含量计可避免以上误差,但经过统计发现,β-肌动蛋白含量的2组数据之间存在着较高相关性(r=0.976),因此说明此检测方法以干重计,不但可以省去总蛋白质的测定步骤,且仍然可以准确地作为结果表述单位。另一方面,样品批间含量差异较大,可能是蛋白质自酶解或自降解的程度和存放时间成正相关性。由于动物的干燥体在存放过程中,其内部含有的少量耐高温且活性稳定的蛋白酶。这部分蛋白酶会将全蝎的组织蛋白质(包括β-肌动蛋白)进行酶解,同时样本的组织蛋白质本身也会随储藏时间的增长逐渐发生自降解现象。这2种情况都会导致组织蛋白质的原有氨基酸序列发生断裂,且断裂的位点具有随机性。以至于β-肌动蛋白特征肽段IIAPPER的任意位点都可能发生断裂,从而导致该方法中此特征肽段无法检出的现象。因此若样品的总蛋白质含量较其他样品的总蛋白质含量稳定一致的前提下,检出的β-肌动蛋白含量偏低时,则说明该样品的储存时间可能较长。通过该方法测得的结果可以在一定程度上反映全蝎药材的新旧程度。见表8。
4 结论
本研究根据全蝎所含蛋白质的生物信息学特点,筛选出了用于进行含量测定的β-肌动蛋白及其特征肽段。以特征肽段作为生物标志物并合成与其相似的同位素内标,形成了液相色谱-串联三重四级杆质谱的含量测定方法。该方法具有灵敏度高,准确度较好和重复性较稳定的特点。实验中对不同提取方式、不同提取时间、不同液料比和酶解时间进行了考察,以提取效率高,色谱信号强度大和节省前处理时间为指标,最终确定在液料比为1∶100,水浴加热30 min,酶解6 h作为供试品溶液的制备方法。
利用高分辨质谱进行蛋白质的序列鉴定是蛋白质组学的一种常用技术手段。目前已经有对于蛋白質含量较高的药材采用检测离子对进行鉴别的方法[15],而将特征肽段作为对照品进行药材中特定蛋白的含量测定也不失为一种有意义的尝试。该方法作为一种能够反映全蝎药材内源性成分含量的手段,可以对完善全蝎的质量标准起到一定的参考意义。今后,类似模式的蛋白质检测技术可以更广泛的应用于中药的质量控制领域。
参考文献
[1]高学敏.中药学[M].北京:中国中医药出版社,2002:481-483.
[2]孙志艺,张茹,赵丽萍,等.全蝎酶解液超滤物对三种细胞抗肿瘤活性比较研究[J].山东化工,2019,48(8):16-19.
[3]周牡娜.全蝎纯化液对凝血酶诱导血管内皮细胞表达血管活性物质的影响研究[D].长沙:湖南中医药大学,2014.
[4]安雅芳.全蝎联合石菖蒲对士的宁致痫小鼠行为及抗氧化机制的影响[J].世界最新医学信息文摘,2019,19(17):114-115.
[5]刘华清.节肢动物地龙和全蝎抗菌化学成分研究[D].洛阳:河南科技大学,2018.
[6]王二欢,马存德,常晖,等.全蝎资源古今考证[J].中国现代中药,2019,21(11):1582-1586.
[7]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:143.
[8]谭银合,郭建生.全蝎的化学成分及其镇痛作用的研究进展[J].湖南中医药导报,2001,7(5):210-212.
[9]孙姗姗,李婷婷,陈启,等.超高效液相色谱-串联质谱法测定牛源性酪蛋白方法中酶解条件的优化及酶解性能的评价[J].理化检测-化学分册,2019,55(10):1157-1163.
[10]赵方圆,吴亚君,韩建勋,等.蛋白质组学技术在食品品质检测及鉴伪中的应用[J].中国食品学报,2012,12(11):128-135.
[11]Koecher M.Next generation of food allergen quantification using mass spectrometric systems[J].J Proteome Res,2014,13(8):3499-3509.
[12]Zhang Y,Fonslow BR,Shan B,et al.Protein analysis by shotgun/bottom-up proteomics[J].Chem Rev,2013,113(4):2343-2394.
[13]王振霞,孔凡平.不同炮制工艺的全蝎中氨基酸含量对比[J].中国药业,2007,16(24):64.
[14]黄亮,张乐佳,郭茂军,等.不同方法加工全蝎的氨基酸含量及药理作用对比研究[J].中国医药导报,2009,6(16):71.
[15]张静娴,胡青,董洪霜,等.超高效液相色谱-三重四级杆质谱法用于阿胶糕类食品中阿胶的鉴别及马、牛、羊、猪皮源成分的检测[J].世界中医药,2019,14(4):828-832.
(2020-06-10收稿 责任编辑:徐颖)
