外阻对同步脱氮除硫燃料电池古菌群落的影响
2020-08-07胡安辉
蔡 靖, 胡安辉
(1. 浙江工商大学 环境科学与工程学院, 浙江 杭州 310018;2. 浙江环益资源利用有限公司, 浙江 杭州 311500)
1 前 言
微生物燃料电池(microbial fuel cell,MFC)是以酶或微生物作为催化剂,将化学能直接转化成电能的装置[1]。这一概念早在1911 年被提出,但在1991 年才被尝试应用于污水处理[2]。目前文献报道的MFC大多集中在以有机物作为基质[3]。随着研究的逐渐深入,科学家们在海底沉积物 MFC 中发现,MFC 电能的产生与硫化物的氧化紧密相关[4],且现有不少文献报道 MFC 可以废水中硫化物为基质产电[5-8]。然而迄今为止,国内外有关MFC 同时去除硫化物和硝酸盐的文献报道极为少见。LEE 等[9]于2013 年使用菌株Pseudomonas sp. C27 构建双室MFC 去除废水中的硫化物时,研究了阳极中添加硝酸盐作为电子受体对 MFC 性能的影响。魏炎等[10]则构建了以硫化物作为阳极电子供体和硝酸盐为阴极电子受体的双室型MFC,实现了硫化物和硝酸盐的同时去除。研究表明,在缺氧或厌氧状态下,某些微生物能够以硝酸盐为电子受体将硫化物氧化成单质硫[11]。以此为依据,研发出同步脱氮除硫工艺,可实现以废制废,达到对氮硫2 种污染物同时去除。据此,研究启动并运行了无机条件下的同步脱氮除硫燃料电池,并证实该MFC 可同时实现废水处理和生物发电,且产电功能与基质去除功能间是相互耦联的[12-13]。
在MFC 中,阳极室内微生物需要在有电环境中降解污染物质,这与普通污水处理(无电环境)存在明显不同。因此,MFC 中的产电微生物及微生物群落日益引起关注[14]。尤其是近年来,分子生物学手段不断发展,其中高通量测序技术因具有分析结果准确、高速等特点,被广泛应用于污水处理过程中微生物群落结构和多样性研究[15]。目前研究大多集中在细菌群落方面,古菌方面研究较少[14],且迄今未见同步脱氮除硫燃料电池中古菌群落方面的报道。基于此,本研究采用混合菌群,构建了4 个相同构型的同步脱氮除硫燃料电池,将其在不同外阻条件(100,1 000,10 000 Ω 和开路状态)下运行,考察其产电性能和基质去除性能,并采用高通量测序技术分析阳极室内古菌群落特征及群落多样性,探讨外阻条件对同步脱氮除硫燃料电池中古菌群落的影响。
2 材料与方法
2.1 实验装置
本研究中所采用的MFC 由有机玻璃制成,采用双室微生物燃料电池构型。其阳极室和阴极室的容积均为350 mL,有效容积为300 mL[13]。阳极室和阴极室中间用质子交换膜(Ultrax CMI-7000 Membrane International,USA)分隔。阳极和阴极均为石墨棒(尺寸为Φ1 cm×6 cm,表面积为18.80 cm2),两极间由钛丝和铜导线连接。
阴极液采用高锰酸钾溶液(浓度为100 mg·L-1,50 mmol·L-1磷酸缓冲液,pH=7.0),并用磁力搅拌器进行搅拌。阳极液为模拟废水[16],并将100 mL 富集污泥接种于阳极室内。为了加强进水与污泥的混合,并消除可能的基质抑制效应,阳极液采用回流泵回流,回流比约为2.5。
本试验通过间歇进水方式运行同步脱氮除硫燃料电池。采用蠕动泵一次性进水,每天更换基质。进水硫化物浓度约为540 mg·L-1。进水前,阳极室内通氮气5 min,以去除溶液中的氧气。试验采用4 个相同构型的微生物燃料电池,记为R1、R2、R3 和R4。其中R1 外阻为100 Ω(远低于内阻值),R2 外阻为1 000 Ω(与内阻值一致),R3 外阻为 10 000 Ω(远高于内阻值),R4 则在开路状态(对照组)下运行。
试验过程中,进水pH 值为(7.0±0.1)。
2.2 分析方法
硝氮(NO3--N)采用紫外分光光度法测定;亚硝氮(NO2--N)采用N-(1-萘基)-乙二胺光度法测定;氨氮(NH4+-N)采用水杨酸-次氯酸盐光度法测定;硫化物(S2--S)采用亚甲基兰分光光度法测定;硫酸盐(SO42--S)采用铬酸钡分光光度法测定[17]。pH 值采用PHS-9V 型酸度计测定。单质硫和氮气产量分别根据进出水元素质量守恒进行计算,则

MFC 输出电压(即外阻为 1 000 Ω 两端电压)数据由数据采集系统 (Agilent 34970A Data Acquisition/Switch Unit) 收集,每隔10 min 自动测定一次。电流密度则根据电流和电极净表面积进行归一化计算。
2.3 高通量测序及分析

3 结果与讨论
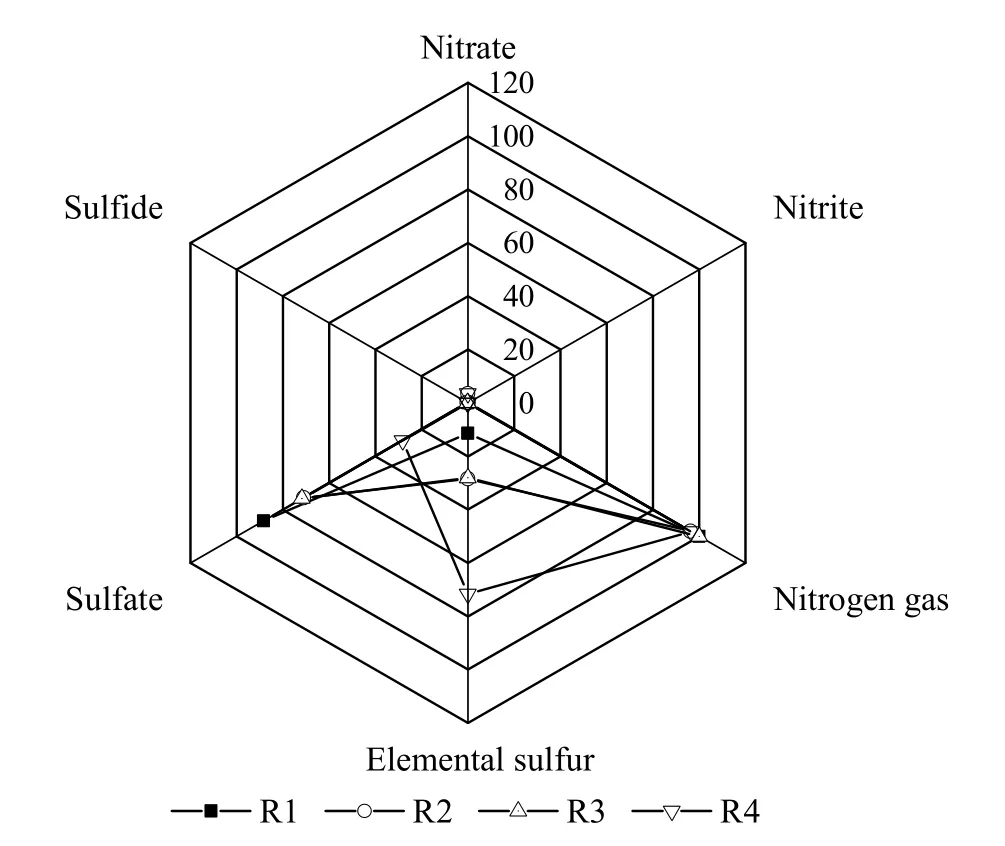
图1 同步脱氮除硫微生物燃料电池的基质去除情况Fig.1 Performance of substrate removal in MFCs with simultaneous desulfurization and denitrification
3.1 基质去除情况
当进水硫化物浓度维持在540 mg·L-1时,不同外阻时同步脱氮除硫燃料电池的基质去除情况如图1 所示。当外阻为100 Ω 时,R1 出水中未检测出硝酸盐,亚硝酸盐浓度仅为0.02 mg·L-1,硝酸盐去除率为100%,且氮气产率高达99.97%;随着外阻的增加,MFC 中硝酸盐去除率仍高于 96.50%,氮气产率高于 96.30%,这表明,不论外阻如何改变,同步脱氮除硫燃料电池中硝酸盐还原的主要产物为氮气。
与高硝酸盐去除情况类似,同步脱氮除硫燃料电池中硫化物去除率也很高,均高于99.60%。但硫化物氧化产物分布情况却有明显不同。当外阻为100 Ω 时,R1 硫酸盐产率最高,为88.35%;随着外阻分别提高至 1 000 和 10 000 Ω 时,R2 和 R3 中硫酸盐产率分别下降至71.14 %~71.75%。当开路状态时,R4 硫酸盐产率则降至28.3%。在同步脱氮除硫燃料电池中,硝酸盐为电子受体,硫化物为电子供体,即硫化物氧化提供电子用于硝酸盐还原。据文献报道,硫化物氧化提供的电子数量大于硝酸盐还原所接受的电子数量,且该电子数量差额与该微生物燃料电池产电性能呈正相关。因此推测硫化物氧化多余的电子用于产电[12]。而在开路状态时,MFC 内没有电子流动,因此硫化物无需提供多余电子用于产电,故硫酸盐产率较低。
同步脱氮除硫燃料电池的进水 S/N 比在 2.15~2.58,根据化学反应式, 理论产物为氮气和单质硫,但实际产物为氮气、硫酸盐和单质硫。这表明,外阻影响了同步脱氮除硫燃料电池的产物类型和浓度。
3.2 产电情况
在不同外阻情况下,同步脱氮除硫燃料电池的产电趋势与以往文献报道类似[20]。在本研究中,为了更好地统计分析产电情况,采用箱形图来表示不同外阻时同步脱氮除硫燃料电池中的输出电压及电流密度(图2)。箱形图中箱体代表第25% 和75% 之间的数据,或被称为上下四分位,这意味着其包含了50%的数据。
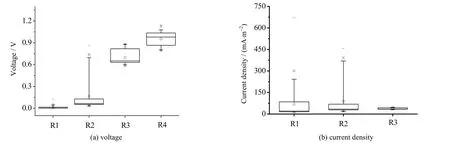
图2 同步脱氮除硫微生物燃料电池的电能产生情况Fig.2 Performance of electricity generation in MFCs with simultaneous desulfurization and denitrification
如图2(a)所示,当外阻为100 Ω 时,R1 产生电压的上下四分位范围为0.003~0.017 V,中值为0.004 V;当外阻为1 000 Ω 时,R2 产生电压的上下四分位范围为0.051~0.133 V,中值为0.064 V;当外阻为10 000Ω 时,R3 产生电压的上下四分位范围为0.630~0.820 V,中值为0.650 V。当脱氮除硫燃料电池处于开路状态时,R4 电极两侧电压的上下四分位范围为0.864~1.035 V,中值为0.979 V。这表明,随着外阻的增大,MFC 产生的电压值也逐渐增大,即阳极电势逐渐提高。
MFC 输出电压值与外阻值密切相关,因此,为了均一化外接电阻影响,更好地表示同步脱氮除硫燃料电池的产电情况,本文又采用电流密度来表示其产电能力(图2(b))。当同步脱氮除硫燃料电池处于开路状态时,R4 的电流密度则为0。当外阻为100 Ω 时,R1 上下四分位电流密度范围为15.50~89.19 mA·m-2,中值为 20.63 mA·m-2;当外阻为 1 000 Ω 时,R2 上下四分位电流密度范围为 27.09~70.52 mA·m-2,中值为34.18 mA·m-2;当外阻为 10 000 Ω 时,R1 上下四分位电流密度范围为 33.45~43.52 mA·m-2,中值为 34.52 mA·m-2。这表明,电流密度也随着外阻增大而增大,但其增大趋势并没有如电压那样明显。
3.3 群落情况
本试验中R1、R2、R3 和R4 样品测序所得的总序列数分别为44 221,57 258,54 877 和54 985,将所有序列按照97%相似性进行划分OTU,得到OTU 数量分别为255,210,379 和304,且 Coverage 值均高于99.9%,这表明样品文库覆盖率高,数据可靠。
如图3 所示,在4 个样品中,含量最高的是广古菌门(Euryarchaeota),其相对丰度分别为 53.36 %(R1)、63.49%(R2)、65.36%(R)和 62.31%(R4);排名第 2 的是未分类古菌门(Archaea_unclassified),其相对丰度分别为42.59 %(R1)、32.39%(R2)、32.73%(R3)和 32.99%(R4)。深古菌门(Bathyarchaeota)和奇古菌门(Thaumarchaeota)的排名不一致,在R1 和R4 中,Bathyarchaeota 的相对丰度略小于 Thaumarchaeota;而在 R2 和 R3 中,Bathyarchaeota 的相对丰度略大于Thaumarchaeota。不过,Bathyarchaeota 和Thaumarchaeota 相对丰度较小,均低于2.00%。
如图4,根据属分类水平上相对丰度,将污泥中古菌分为优势菌属(相对丰度≥10%) 、常见菌属(10%≥相对丰度≥1%)和稀有菌属(相对丰度≤1%)[21]。在属分类水平上,R1 中未分类古菌属(Archaea_unclassified,相对丰度为 42.59%),甲烷杆菌属(Methanobacterium,相对丰度为 31.16%) 为优势菌属;R2 中Archaea_unclassified (相对丰度为 32.39%),Methanobacterium (相对丰度为 30.32%) 和甲烷鬃菌属(Methanosaeta,相对丰度为 14.25%) 是优势菌属;R3 中 Archaea_unclassified (相对丰度为 32.73%),Methanobacterium (相对丰度为 18.17%),甲烷绳菌属(Methanoregula,相对丰度为18.07%)和Methanosaeta (相对丰度为17.20%)是优势菌属;R4 中Archaea_unclassified (相对丰度为32.99%),Methanobacterium (相对丰度为29.22%)和Methanoregula (相对丰度为15.79%) 是优势菌属。
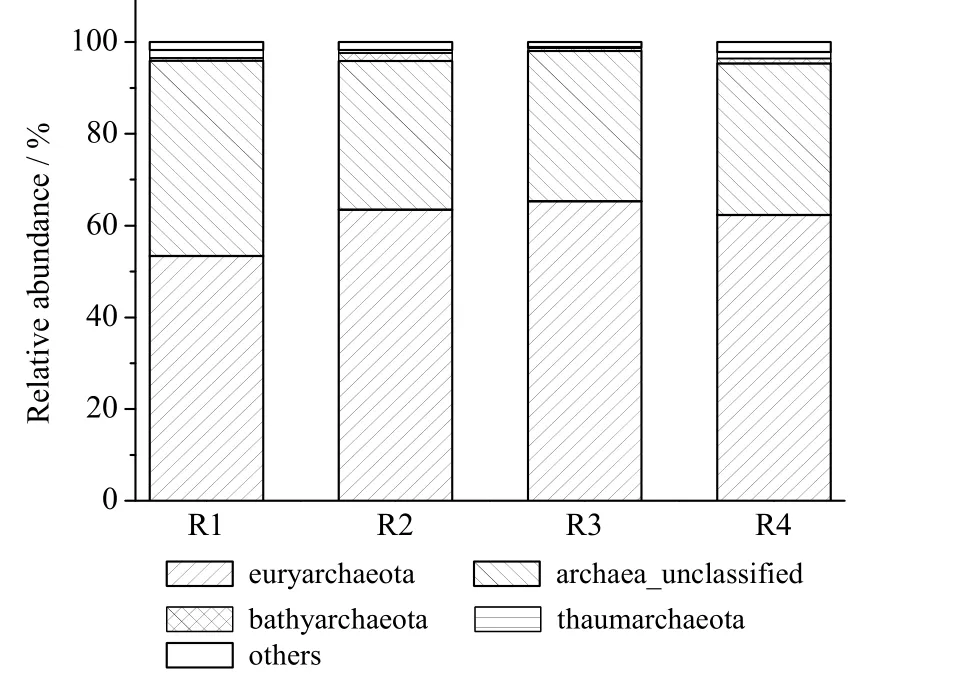
图3 门分类水平上的同步脱氮除硫微生物燃料电池古菌群落结构Fig.3 Archaeal community of MFCs with simultaneous desulfurization and denitrification at Phylum level
除了 Archaea_unclassified 以外,优势菌属均属于Euryarchaeota 门,且都是与产甲烷有关,这是一个很有意思的现象。罗剑飞[22]在研究含高浓度硫化物的印染废水处理系统的古菌群落结构时,构建了古菌16SrRNA 基因克隆文库,并发现古菌文库主要由甲烷微菌属(Methanomicrobia,占99%) 组成,而没有发现典型自养型硫氧化古菌Sulfolobales 的存在[23]。但在本研究中,进水基质中并没有添加有机物,为化能自养型环境。据文献报道,在生物电化学体系中,二氧化碳可以直接利用电子转化为甲烷,这意味着产甲烷菌可能是潜在的嗜电微生物[24],或被称为电营养型(Electrotrophic)微生物,如Methanococcus maripaludis 和Methanobacterium palustre F[25]。推测在同步脱氮除硫燃料电池阳极室中,产甲烷菌利用硫化物氧化提供的电子进行生长,具体机理还有待进一步研究。
3.4 多样性分析
表1 介绍了不同外阻时同步脱氮除硫微生物燃料电池中种群丰富度指数和群落多样性指数。ACE 指数和Chao 指数属于α 生物多样性指数,反映每个样品内部群落的丰富度,数值越大,说明样品中物种越丰富[26]。ACE 指数反应的趋势与 Chao 指数类似,其大小顺序为 R3>R4>R1>R2。这表明,当外阻为10 000 Ω 时,阳极室内古菌群落丰富度最高,后依次是开路情况、外阻为100 Ω 和外阻为1 000 Ω。
Shannon 指数和Simpson 指数也属于α 生物多样性指数,但反映的是每个样品的多样性程度。若以Shannon 指数作为评判依据, 其变化趋势是R1>R4>R3>R2;而以 Simpson 指数作为评价依据,其变化趋势是 R2>R3>R4>R1。若单纯从 Shannon 指数和Simpson 指数数值来看,两者变化趋势刚好相反。Shannon 指数越大,表明样品群落多样性越高[27]。然而,Simpson 指数体现的是优势物种生物量占群落生物总量的比重,该指数越大,表明优势菌群生物量占总生物量比重越小,反之则优势菌群生物量占总生物量比重越大[28],换言之,Simpson 指数值越小,说明群落多样性越高。因此,当外阻为1 000 Ω 时,阳极室内古菌群落多样性最高,其后是外阻为10 000 Ω,开路情况和外阻为100 Ω。

图4 属分类水平上的同步脱氮除硫微生物燃料电池古菌群落结构Fig.4 Archaeal community of MFCs with simultaneous desulfurization and denitrification at Genus level
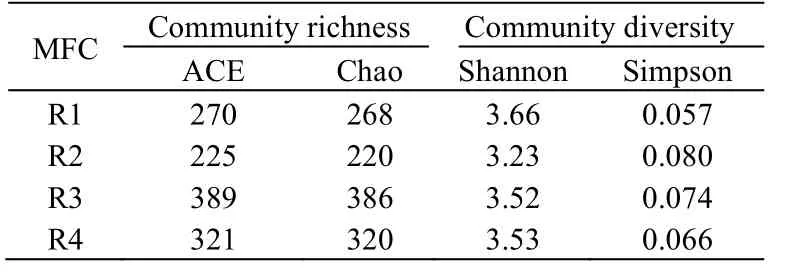
表1 不同外阻时种群丰富度指数和群落多样性指数Table 1 Richness and diversity indices under various external resistances
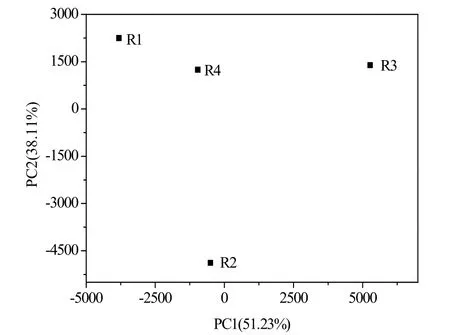
图5 不同外阻时MFC 中古菌群落PCA 图Fig.5 PCA analysis of archaeal community in MFCs with various external resistances
β 多样性指数是用来描述不同因素下群落结构间的差异性,是分析生物多样性的重要组成部分,PCA 就是其中重要一种分析方法。图5 为不同外阻时对同步脱氮除硫微生物燃料电池中古菌群落进行主成份分析。第 1主轴解释度为52.23%,第2 主轴解释度为38.11%,共解释了外阻变化的90.34%。在图5 中,R1 和R4 比较接近,在第2 象限,而R2 和R3 则分别在第3 和第1 象限中。这表明,从群落多样性角度来看,不同外阻的确对脱氮除硫燃料电池中的古菌群落发生了影响。这与以往文献报道的结果一致。吴义诚等[29]采用高通量测序技术研究了在开路和闭路条件下沉积物微生物燃料电池中阳极生物膜细菌结构差异,发现开路条件下菌群多样性更丰富,这表明MFC 运行过程中的电子传递影响了微生物群落结构。 KIM 等[30]采用单室MFC 处理低pH 酒精废水,并研究了其在不同外阻情况(100、500、1 000 和 5 000 Ω) 时的微生物群落。其测序结果表明,随着外阻改变,微生物群落在门水平上存在明显差异。
3.5 讨论
外阻是影响 MFC 中微生物群落的重要因素之一[31]。在同步脱氮除硫燃料电池中,外阻对阳极室内古菌群落的影响可分为直接和间接两方面。直接影响指的是MFC 产生电能,直接作用于阳极室内古菌群落,从而对其群落结构产生影响。外阻控制了从阳极流向阴极的电子数量(电流密度),这将对微生物群落产生显著影响。除此以外,外阻还影响输出电压,从而间接影响MFC 阳极电势。阳极电势是MFC 运行的重要参数,决定了微生物群落获得的能量。另一方面,间接影响指的是阳极室内的环境条件。外阻变化影响了阳极液中的产物类型和浓度,这将改变微生物的生存环境,从而间接影响了微生物群落结构。
为了分析外阻引起的电能变化对群落结构的影响,分别对电压及电流密度与群落丰富度及群落多样性指数进行Pearson 相关性分析(表2)。结果表明,ACE,Chao,Shannon 和Simpson 指数与电压之间呈正相关;而ACE,Chao,Shannon 指数与电流密度呈负相关,而Simpson 指数却与电流密度呈正相关。换言之,增加电压,有助于提高群落丰富度和多样性;然而提高电流密度,却使群落丰富度和多样性下降。但在所试范围内,电压(或电流密度)对所有指数均无显著性影响(p>0.05)。
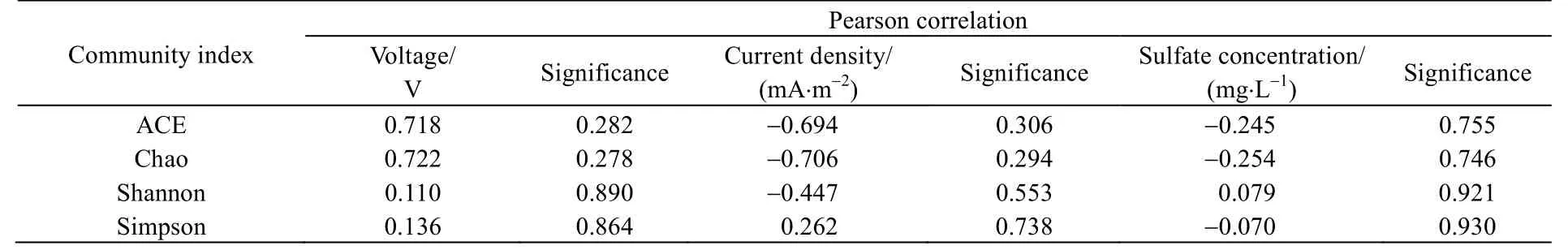
表2 Pearson 相关性分析Table 2 Pearson correlation analysis
在脱氮除硫燃料电池中,硝酸盐被还原为氮气,硫化物则氧化为硫酸盐和单质硫。在上述产物中,仅硫酸盐为离子态,其余为气体或固体,故选择阳极液中硫酸盐浓度作为外部环境因素。因此,为了分析外阻诱发的外部环境变化对群落结构的影响,将硫酸盐浓度与群落丰富度及群落多样性指数进行Pearson 相关性分析(表2)。结果显示,Shannon 指数与硫酸盐浓度呈正相关,ACE,Chao 和Simpson 指数呈负相关。这表明,随着硫酸盐浓度增加,群落丰富度下降,但多样性上升。但在所试范围内,硫酸盐浓度对所有指数均无显著性影响(p>0.05)。
综上所述,尽管改变外阻会对阳极室内微生物群落有所影响(图3~5),但并未对古菌群落的丰富度和多样性产生显著性影响(p>0.05)。以接种污泥作为对照,笔者曾采用聚合酶链反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)方法研究了4 种不同运行模式下的同步脱氮除硫燃料电池阳极室内细菌群落结构[32]。试验结果发现,尽管 MFC 产电性能存在明显差异,但群落多样性指数(Shannon 指数, Simpson 指数和Equitability 指数)与电能产生并无显著性联系。LYON 等[33]发现改变外阻确实会对 MFC 中微生物群落结构有所影响,但在不同外阻情况下建立的不同微生物群落结构,却产生了相似的发电量,这证明了MFC 系统的灵活性。
4 结 论
(1) 在所试外阻范围内(100、1 000、10 000 Ω 和开路状态),同步脱氮除硫燃料电池均表现出高基质去除性能;硫化物氧化产物主要为硫酸盐和单质硫,其产物类型随着外阻变化而有所改变。硝酸盐还原产物主要为氮气。同步脱氮除硫燃料电池中输出电压和电流密度均随着外阻增大而增大,但电流密度增长幅度较缓。
(2) 通过高通量测序,分别从门分类水平和属分类水平对阳极室内污泥古菌群落进行分类分析。在四个污泥样品中,Euryarchaeota 门相对丰度皆为最高。结果表明,改变外阻会对阳极室内微生物群落结构有所影响,但并未对同步脱氮除硫燃料电池中古菌群落丰富度和多样性产生显著性影响(p>0.05)。
