一种新型手性噁唑啉-氮杂环卡宾前体的合成
2020-08-07穆秋超陈小兵吴士泸徐利文
穆秋超,李 航,陈小兵,吴士泸,李 莉,徐利文
(1. 杭州师范大学材料与化学化工学院,浙江 杭州 311121;2. 杭州师范大学有机硅化学及材料技术教育部重点实验室,浙江 杭州 311121;3. 中国科学院兰州化学物理研究所苏州研究院羰基合成与选择氧化国家重点实验室,甘肃 兰州 730000)
0 引言
氮杂环卡宾(N-heterocyclic carbene, NHC)作为最重要的有机配体之一,具有较强的σ-供体特性及较弱的π-受体特性[1],既可作为非金属有机小分子催化剂[2-3],也能与多种过渡金属配位生成稳定的金属卡宾配合物.金属卡宾配合物中M-C键的解离能较高,表现出良好的热力学稳定性和对空气、水的稳定性,在许多反应中都表现出很好的催化活性[4-9].改变卡宾分子的空间布局或电子特性,都能使卡宾及金属卡宾配合物表现出不同的物理化学性质,并使其催化活性发生显著的变化,适用于不同的催化反应中.因此,设计、合成新颖结构的氮杂环卡宾在催化领域具有重要的研究意义,具有广阔的应用前景.
近年来,随着不对称催化领域的迅猛发展,新型手性配体的设计、合成及其应用吸引了化学家们浓厚的兴趣[10-13].其中,手性氮杂环卡宾配体所显示出的良好的过渡金属兼容性及优异的立体控制能力,更是吸引了众多科研工作者的关注[14-23].新型手性氮杂环卡宾配体的设计合成一直是卡宾化学的研究热点,其金属配合物在不对称催化反应中独特的催化模式为复杂手性分子的构建提供了新的研究思路.
手性噁唑啉结构单元存在于众多的手性配体中,广泛应用于不对称催化反应中,得到了很好的立体选择性[24-29].将噁唑啉单元作为手性源与氮杂环卡宾结合,可以合成许多具有不同骨架的手性噁唑啉-氮杂环卡宾配体,并在不对称催化反应中得到广泛应用 (图1)[30-37].因此合成基于手性噁唑啉结构的手性卡宾配体将为新型氮杂环卡宾金属配合物的制备提供更好的选择,有利于得到更好的不对称催化活性.氮杂环卡宾配体的空间位阻效应有利于过渡金属原子周围形成良好的手性环境,且具有刚性结构的卡宾配体更有可能产生较好的手性诱导.因此,设计合成新型手性噁唑啉-氮杂环卡宾配体并基于此开发新的催化体系对不对称催化领域的发展具有重要的研究意义.基于此,我们构建了一例基于手性噁唑啉的氮杂环卡宾配体,该配体具有以下特点:1)较大的空间位阻;2)配体具有刚性骨架;3)手性噁唑啉为金属中心提供手性环境;4)具有与多种金属配位形成金属卡宾配合物的潜质,并表现出独特的催化活性.本文以6-溴吡啶-2-甲醛为起始原料合成了一例新型手性噁唑啉-氮杂环卡宾配体,并对其进行了表征.

图1 手性噁唑啉-氮杂环卡宾配体Fig.1 Structure of the chiral oxazoline-NHC
1 实验部分
1.1 仪器与试剂
400 MHz核磁共振仪(Brucker AV 400,CDCl3为溶剂,TMS为内标),Q-Tof高分辨质谱仪(Bruker Daltonics).实验所用试剂均为市售分析纯试剂,用前无须进行处理.
1.2 实验方法
1.2.1 (E)-1-(6-溴吡啶-2-基)-N-(2,6-二异丙基苯基)甲胺(7)的合成
化合物7根据文献[38]报道的方法制备.
1.2.2 (S)-4-苄基-4,5-二氢噁唑(8)的合成
化合物8根据文献[39]报道的方法制备.
1.2.3 (S,E)-1-(6-(4-苄基-4,5-二氢噁唑-2-基)-吡啶-2-基)-N-(2,6-二异丙基苯基)甲胺(9)的合成
N2保护下,将化合物7(2.06 g, 6.0 mmol),化合物8(1.16 g, 12.0 mmol),乙酸钯 (0.13 g, 0.6 mmol),1,2-双(二苯基膦)乙烷(dppe)(0.48 g, 1.2 mmol),叔丁醇锂 (0.96 g, 12.0 mmol) 分别加入到干燥反应管中,随后加入干燥二氧六环(20 mL),N2置换3次,升温至100 ℃,反应24 h.TLC监测至反应结束,反应体系降至室温,硅胶过滤,滤液减压浓缩,粗品经硅胶柱层析分离(V石油醚∶V乙酸乙酯∶V三乙胺= 5∶1∶0.005)得到黄色半固体化合物9(1.33 g, 53%).1H NMR (400 MHz, CDCl3) δ 8.39 (d,J= 12.0 Hz, 2H), 8.11 (d,J=8.0 Hz, 1H), 7.89 (t,J=8.0 Hz, 1H), 7.24 (d,J=4.0 Hz, 2H), 7.19~7.16 (m, 3H), 7.10~7.04 (m, 3H), 4.66~4.58 (m, 1H), 4.43 (t,J=8.0, 12 Hz, 1H), 4.42 (t,J=8.0 Hz, 1H), 3.29~3.24 (m, 1H), 2.90~2.82 (m, 2H), 2.73~2.68 (m, 1H), 1.08 (s, 6H), 1.07 (s, 6H).13C NMR (100 MHz, CDCl3) δ 162.8, 162.4, 154.6, 148.0, 146.7, 137.7, 137.4, 136.9, 132.4, 129.2, 128.6, 126.6, 125.7, 124.5, 123.0, 122.9, 122.7, 118.5, 72.7, 68.2, 41.6, 27.9, 23.3, 22.4.
1.2.4Carbox的合成
N2保护下,将化合物9(0.77 g, 1.81 mmol) 加入到干燥Schlenk反应管中,随后加入氯甲基甲醚(MOMCl)(8 mL),升温至55 ℃,反应24 h.TLC监测至反应结束,反应体系降至室温,减压浓缩,粗品经硅胶柱层析分离(V二氯甲烷∶V甲醇=10∶1)得到浅棕色固体化合物Carbox(0.60 g, 65%).1H NMR(400 MHz, CDCl3) δ 10.71 (d,J=8.0 Hz, 1H), 9.87 (s, 1H), 8.70 (s, 1H), 8.02 (s, 1H), 7.88 (s, 1H), 7.58 (t,J=8.0 Hz, 1H), 7.50 (s, 1H), 7.35 (t,J=12.0, 8.0 Hz, 1H), 7.20~7.15 (m, 2H), 7.09 (t,J=8.0 Hz, 1H), 4.55 (d,J=8.0 Hz, 1H), 3.93 (d,J=8.0 Hz, 1H), 3.71 (t,J=4.0 Hz, 1H), 3.23~3.13 (m, 2H), 2.04 (s, 2H), 1.12 (d,J=4.0 Hz, 12H).13C NMR (100 MHz, CDCl3) δ 161.1, 144.9, 144.8, 137.9, 132.2, 129.3, 128.2, 126.2, 124.6, 124.5, 122.8, 115.9, 54.1, 45.9, 37.9, 28.5, 24.2. HRMS (ESI-TOF) Calcd for C29H32N3O [M]+: 438.2540, found: 438.2550.
2 结果与讨论
基于上述思路,我们设计了两条不同的合成路线(图2).路线1:首先以6-溴吡啶-2-甲醛为原料,对甲苯磺酸为催化剂,甲苯为溶剂,乙二醇保护醛基,以75%收率得到缩醛化合物2;在乙酸钯作为催化剂,1,2-双(二苯基膦)乙烷(dppe)为配体,叔丁醇锂为碱,干燥二氧六环作为溶剂的条件下,缩醛2与手性噁唑啉3发生偶联反应生成化合物4,收率为62%;化合物4在酸性条件下脱保护,以80%收率得到化合物5;以化合物5作为反应底物,参考相关文献合成方法,制备相应的席夫碱中间体,未得到目标化合物.推测化合物5中噁唑啉片段的引入降低了羰基碳的亲电性,使其不易与芳香胺反应生成席夫碱中间体.
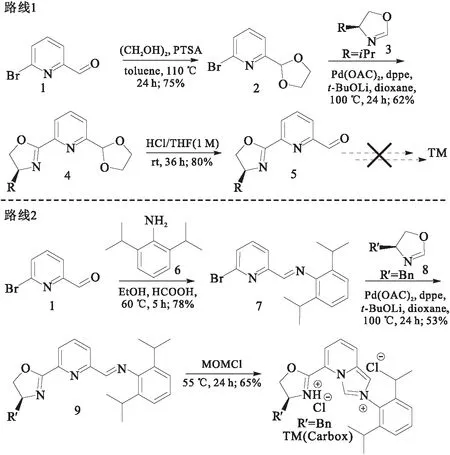
图2 手性噁唑啉-氮杂环卡宾Carbox的合成路线Fig.2 Synthetic route of chiral oxazoline-NHC(Carbox)
路线2:首先参考文献方法[38],以乙醇作为溶剂,甲酸为催化剂,60 ℃条件下,6-溴吡啶-2-甲醛与芳香胺6发生缩合反应得到席夫碱中间体7,由于席夫碱不稳定易分解,粗产物用正己烷重结晶纯化后低温储存;参考文献方法[36],以手性氨基醇和N,N-二甲基甲酰胺二甲缩醛(DMF-DMA)为起始原料,在酸性树脂催化条件下,合成了手性噁唑啉片段8;在过渡金属钯催化条件下,席夫碱中间体7与手性噁唑啉8发生偶联反应得到中间体9,鉴于中间体9含有不稳定的亚胺片段,粗产物须经硅胶过滤浓缩后,直接通过三乙胺碱化的柱层析纯化;最后在氮气氛围下,中间体9在氯甲基甲醚(MOMCl)中发生环化反应,其中氯甲基甲醚即作为反应溶剂,也作为反应试剂.TLC监测反应完全后,反应体系浓缩除去过量的氯甲基甲醚后,直接通过柱层析纯化得到手性噁唑啉-氮杂环卡宾配体(Carbox).通过1H-NMR、13C-NMR和HRMS对目标产物Carbox进行了表征.在1H-NMR谱图中,化学位移为10.69的单峰积分值为1,归属为咪唑环中两个氮原子之间碳原子上的氢,该氢具有较高的活性,易和过渡金属发生配位生成氮杂环金属卡宾配合物;化学位移为9.87的单峰积分值为1,归属为咪唑环中碳羰双键上的氢;化学位移为8.70的单峰积分值为1,归属为噁唑啉中氮所成盐酸盐的氢;HRMS谱图中,目标产物出现[M]+峰.
3 结论
本文以6-溴吡啶-2-甲醛为起始原料,噁唑啉为手性源,构建了一种新型手性噁唑啉-氮杂环卡宾配体Carbox,并通过核磁共振谱图及高分辨质谱进行了表征.磁共振结果表明,该化合物可形成两分子盐酸盐.基于该手性配体具有较大的空间位阻及较强的刚性骨架,使其在不对称催化领域具有潜在的重要的应用前景,其金属卡宾配合物制备及其不对称催化反应的应用研究正在进行中[40].
