巴戟天醇提物的提取优化及其抗氧化活性研究
2020-08-06林立王建荣郑燕梅
林立 王建荣 郑燕梅


【摘 要】 目的:优化巴戟天醇提物的提取工艺,并评价其体外抗氧化活性。方法:对巴戟天醇提物的提取进行单因素实验分析,然后通过清除ABTS、清除DPPH、清除超氧阴离子、还原力和总抗氧化五种方法评价巴戟天体外抗氧化活性。结果:最佳提取条件为乙醇提取浓度75 %,提取温度100 ℃,提取时间2 h;巴戟天75 %醇提物对ABTS自由基、DPPH自由基、超氧阴离子自由基均有一定的清除能力,对DPPH自由基和超氧阴离子自由基的最大清除率分别为48.016 %和28.782 %,还原力测试与总抗氧化能力实验数值均与浓度呈现量效关系。结论:巴戟天具有一定的体外抗氧化活性。
【关键词】 巴戟天;抗氧化;自由基
【中图分类号】R285.5 【文献标志码】 A 【文章编号】1007-8517(2020)12-0042-05
Abstract:Objective Optimize the extraction process of alcohol extraction from Morinda officinalis and evaluate its antioxidant activity in vitro.Methods The alcohol extraction of Morinda officinalis was analyzed by single factor experiment,and then the antioxidant activity of Morinda officinalis was evaluated by five methods which were scavenging ABTS,removing DPPH,removing superoxide anion,reducing force and total antioxidant capacity. Results The optimum extraction conditions were ethanol extraction concentration 75 %,extraction temperature 100 ℃,extraction time 2 h,The part of 75 % alcohol extraction had some scavenging ability for ABTS radical,DPPH radical and superoxide anion radical,and the maximum scavenging rate for DPPH radical and superoxide anion radical was 48.016 % and 28.782 %,respectively. The experimental values of reducing force test and total antioxidant capacity showed a quantitative effect relationship with the concentration.Conclusior Morinda officinalis has antioxidant activity in vitro.
Keywords:Morinda officinalis How; Antioxidant Activity; Free Radical
巴戟天(Morinda officinalis How)是茜草科巴戟天属多年生攀援性木质藤本植物,别名巴戟、巴吉、鸡肠风,产福建、广东、海南、广西等省区的热带和亚热带地区,中南半岛也有分布[1]。全年均可采挖,洗净,除去须根,其肉质根的根肉晒干即成药材“巴戟天”,和槟榔、益智、砂仁并称为我国四大南药,为福建省大宗道地药材。中医认为其性甘、辛、微温,归肾、肝经,具有补肾阳、强筋骨、祛风湿的功能,可用于阳痿遗精、宫冷不孕、月经不调、少腹冷痛、风湿痹痛,筋骨痿软等病症[2]。近年来,国内外对巴戟天属植物的化学成分及药理活性研究较多,其化学成分主要有蒽醌类、萘醌和萘氢醌类、环烯醚萜类、糖类、木脂素类、脂肪苷类、香豆素类、黄酮类、挥发油类等,并不断有新的化学成分被发现;现代药理学研究表明巴戟天能够抗抑郁、抗炎镇痛、抗菌、抗丙型肝炎病毒作用、抗疲劳、保肝、调节免疫、调控生精功能、抗肿瘤及细胞毒作用、抗骨质疏松、抗氧化等生物活性[3-9]。对于巴戟天的提取有多种方式,一般有水提取法、酸碱提取法、超声波提取法、超临界流体萃取法、酶解法、微波提取法等,这些方法虽然提取率较高,但存在条件要求严格,操作复杂,成本较高等问题,个别方法又会破坏巴戟天的活性[10]。而对于单纯乙醇提取的方法还少有提及,而且其实验成本较低,操作简单,提取物易于保存,因而选用乙醇为溶剂对巴戟天進行提取,研究巴戟天醇提物的生物活性。
现代医学表明,人体内多余的自由基,会破坏人体细胞结构,引起脂质的过氧化,进而干扰人体正常的代谢活动,引发疾病、加速人体衰老[11]。开发和利用高效无毒的天然抗氧化剂是一直是医学研究的重点,目前对巴戟天的体外抗氧化研究相对较少,特别是醇提取物的抗氧化活性研究比较缺乏,为了进一步发掘巴戟天的用药潜能,探究其抗氧化能力,本实验通过进行总抗氧化能力、DPPH自由基清除活性、还原力、ABTS自由基清除活性和超氧阴离子自由基清除活性五种方法对巴戟天的体外抗氧化活性进行研究,为巴戟天的进一步开发利用提供实验依据。
1 材料
1.1 药材 巴戟天药材为野外人工采集,采集点位于福建省南靖县,采集植物经福建中医药大学杨成梓教授鉴定,认定为茜草科植物巴戟天Morinda officinalis How的根。
1.2 试剂 ABTS、DPPH、NADH、NBT、PMS(美国Sigma公司);磷酸钠(联试化工试剂有限公司);硫酸(日本和光纯药工业株式会社);十二水合磷酸氢二钠、磷酸二氢钠、铁氰化钾(国药集团化学试剂有限公司);三氯乙酸(天津市福晨化学试剂厂);钼酸铵、乙醇为国产分析纯试剂。
1.3 仪器 DZF-6050电热恒温真空干燥箱(中新医疗仪器有限公司);RE-52旋转蒸发器(上海亚荣公司);HH80数显恒温水浴锅(常州亿能实验仪器厂);循环水式多用真空泵、低温冷却循环泵(郑州长城科技工贸有限公司);电热恒温鼓风干燥箱(黄石市恒丰医疗器械有限公司);超声波清洗器(昆山市超声仪器有限公司);多功能食品加工粉碎机(上海帅佳电子科学仪器厂);千分之一天平(上海舜宇恒丰科学仪器有限公司);万分之一天平(福建省计量科技研究所);十万分之一天平(德国赛多利斯);紫外-可见分光光度计(日本岛津制作所)。
2 实验方法
2.1 提取与分离 将巴戟天洗净,置于60 ℃恒温干燥箱中干燥12 h,粉碎,过筛。采用热溶剂提取法提取巴戟天醇提物,将药液静置一段时间后真空抽滤,合并两次滤液,置于旋转蒸发器中减压浓缩,温度保持30 ℃,回收乙醇至无醇味。取一定量巴戟天醇提物于真空干燥箱中烘干,备用。在巴戟天提取物的提取过程中主要涉及的因素是提取时的溶剂浓度、提取温度、提取时间等。实验分别探索它们对提取过程的影响,优化巴戟天的提取过程。
2.1.1 乙醇浓度对巴戟天醇提物得率的影响 称取巴戟天干燥物各等分,在温度100 ℃条件下,提取2 h,分别使用55、65、75、85、95 %的乙醇溶剂进行提取,计算乙醇浓度对巴戟天醇提物得率,三次重复试验。
2.1.2 提取温度对巴戟天醇提物得率的影响 用75 %乙醇回流提取,每次2 h,分别在70、80、90、100、110 ℃进行提取,计算提取温度对巴戟天醇提物得率,三次重复试验。
2.1.3 提取时间对巴戟天醇提物得率的影响 在温度100 ℃条件下,用75 %乙醇回流提取,分别提取1、1.5、2、2.5、3 h,计算时间对巴戟天醇提物得率,三次重复试验。
2.2 抗氧化活性
2.2.1 总抗氧化能力测定[12] 取0.25、0.5、1 mg/mL浓度的样品溶液各0.3 mL(31.25~500 μg/mL);加入3 mL的反应液(含0.6 M的硫酸,28 mM的磷酸钠和4 mM的钼酸铵),置于95 ℃的水浴中反应90 min,冷却至室温后,在紫外695 nm波长处测定吸光值(Ai),以BHT为阳性对照。各浓度样品均重复以上步骤3次,并记录数值。80 %乙醇替代样品溶液作空白调零。
2.2.2 DPPH清除活性[13] 取5、10、20 mg/mL浓度的样品溶液各2 mL,加入0.2 mol/L DPPH溶液2 mL,混匀后,置暗处30 min,使其充分反应,在紫外波长517 nm下分别测取各浓度吸光度(Ai),以Vc为阳性对照。各浓度样品均重复以上步骤3次,并记录数值。以80 %乙醇替代样品溶液为空白对照,测定吸光度(A0)。
公式:DPPH自由基清除率(%)=[(A0-Ai)/A0]×100
式中:A0为空白对照吸光值;Ai为样品吸光值。
2.2.3 还原力测定 [13] 取2.5、5、10 mg/mL浓度的样品溶液各2.5 mL,加入2.5 mL的磷酸盐缓冲液(pH 6.6)和2.5 mL的1 %铁氰化钾溶液,充分混匀,置于50 ℃条件下水浴保温20 min;加入2.5 mL的10 %三氯乙酸,摇匀并静置10 min;取5 mL混合溶液,加入5 mL蒸馏水与1 mL的0.1 %氯化铁,摇匀并静置10 min,在紫外700 nm波长处测取各浓度吸光度(Ai)。各浓度样品均重复以上步骤3次,并记录数值。以2.5 mL的80 %乙醇替代样品溶液作空白调零。
2.2.4 ABTS清除活性[14] 实验用ABTS+溶液的制备:取等體积7 mM的ABTS与2.45 mM过硫酸钾充分混匀,置23 ℃暗处反应12~16 h,得到ABTS+。加入80 %乙醇稀释,使ABTS+溶液在紫外波长734 nm下的吸光值在(0.7±0.02)之间。
取10、20、40 mg/mL样品溶液各0.1 mL,分别加入ABTS+(吸光度在0.7±0.02内)溶液3.9 mL,充分混匀,置23 ℃反应6 min,在紫外734 nm波长处分别测取各浓度吸光度(Ai)。各浓度样品均重复以上步骤3次,并记录数值。用80 %乙醇溶液替代样品溶液为空白对照,测定吸光度(A0)。
公式:ABTS自由基清除率(%)=(A0-Ai)×100/A0
式中:A0为空白吸光值;Ai为样品吸光值。
2.2.5 超氧阴离子清除活性[15] 取0.25、0.5、1 mg/mL不同浓度的样品溶液各1 mL,于体系中加入1 mL NBT溶液[156 μmol/L,由0.1 M的磷酸盐缓冲液(pH 7.4)配制],1 mL NADH溶液[468 没μmol/L,由0.1 M的磷酸盐缓冲液(pH 7.4)配制],混匀,反应从加入1 mL PMS溶液[60 μmol/L,由0.1 M的磷酸盐缓冲液(pH 7.4)配制]开始,置室温反应5 min,在紫外波长560 nm处测定各浓度样品Ai值。各浓度样品均重复以上步骤3次,并记录数值。以80 %乙醇替代样品溶液为空白对照,测定吸光度(A0)。以0.1 M的磷酸盐缓冲液(pH 7.4)调零。
公式:超氧阴离子清除率(%)=100×[A0-(Ai-Aj)]/A0
式中:A0为空白吸光值;Ai为样品吸光值;Aj为样品对照吸光值。
3 结果
3.1 优化巴戟天醇提物的提取过程
3.1.1 乙醇浓度对巴戟天醇提物得率的影响 乙醇浓度在55 %~75 %的浓度范围内,巴戟天的醇提物得率随着乙醇浓度的升高而增大,在75 %处有最大得率,为7.17 %,但随着乙醇浓度的继续增大,得率没有发生太大的变化。因而以下实验中,选择75 %的乙醇作为提取浓度进行提取。如图1所示。
3.1.2 提取溫度对巴戟天醇提物得率的影响 巴戟天醇提物的得率随着温度的升高而增大,呈一定的量效关系,但是过高的温度可能会使杂质的溶出度增加,破坏巴戟天抗氧化物的生物活性[16],因而以下实验中,选择100 ℃为提取温度进行提取。如图2所示。
3.1.3 提取时间对巴戟天醇提物得率的影响 巴戟天醇提物的得率随着提取时间的改变,虽然时间越久,得率越高,但2 h后开始趋近于平稳,时间越久需要耗费更多的财力物力,因而以下实验中,因而选择2 h作为提取时间进行提取。如图3所示。
3.2 巴戟天醇提物的抗氧化实验
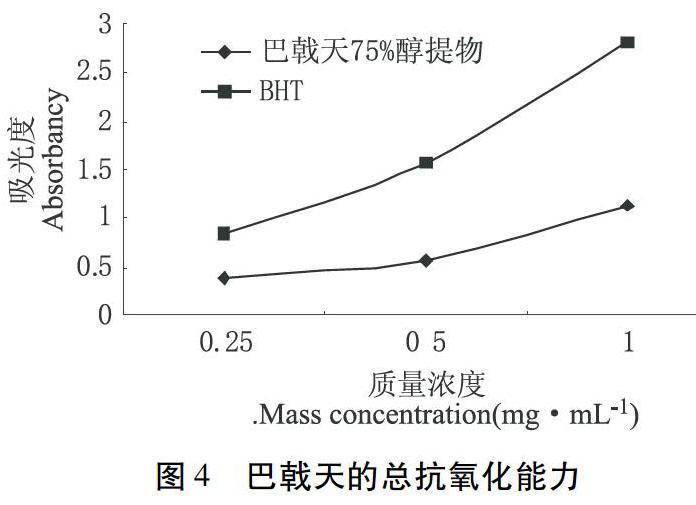
3.2.1 总抗氧化能力 钼酸铵法通过配制H2SO4、Na3PO4和H8MoN2O4三种溶液,形成磷钼复合物,使用紫外分光光度法通过测试溶液吸光度的变化,从而对抗氧化能力进行定量分析。由图4可知,吸光度A在1 mg/mL处数值为1.134,吸光度随着样品浓度的增大而增大,说明巴戟天75 %醇提取物有一定的总抗氧化能力。如图4所示。
3.2.2 DPPH自由基清除能力 DPPH(1,1-二苯基-2-三硝基苯肼)是以N为中心,一种稳定的有机自由基,在波长400~600 nm之间为中心处具有强烈的吸收,因此在溶液中呈现深紫色。与抗氧化剂单电子配对之后会褪色为无色或浅黄色,其吸光值的改变与抗氧化剂的清除能力成定量关系,溶液颜色随着该自由基的减少而变浅,吸光度降低,因而可用分光光度法进行定量分析。随着药物浓度的增加,吸光度变小,清除率变大,当巴戟天75 %醇提取物浓度达到20 mg/mL时,其对DPPH自由基清除率为48.016 %,说明巴戟天75 %醇提取物有清除DPPH自由基的能力。如图5所示。
3.2.3 还原力 还原力强的物质供应的电子可与自由基反应,使自由基成为稳定的物质;当体系中存在还原性物质时,铁氰化钾会被还原成亚铁氰化钾,Fe3+还原为Fe2+,该产物与三氯化铁反应,生成普鲁士蓝(Fe4[Fe(CN)6]3),其在紫外波长700 nm处有最大吸收峰,抗氧化剂的还原能力越强,则测量的吸光度越大。因此其抗氧化活性的能力可根据还原力的大小来进行判断。吸光度A随着样品浓度的增大而增大,呈量效关系,在10 mg/mL浓度下,吸光度为0.194,说明巴戟天75 %醇提取物含有抗氧化物质,具有一定的还原能力。见表1。
3.2.4 ABTS自由基清除作用 ABTS(2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸)被过硫酸钾氧化后,可生成蓝绿色的阳离子自由基ABTS+,该自由基在紫外波长734 nm处有最大吸收峰。当抗氧化剂有清除该自由基的能力时,其吸光值的改变与抗氧化剂的清除能力成定量关系,溶液颜色随着该自由基的减少而变浅,吸光度降低,因而可用分光光度法进行定量分析。随着药物浓度的增加,吸光度变小,清除率变大,当浓度在40 mg/mL时,清除率为8.858 %达到最高,说明巴戟天75 %醇提取物具有清除ABTS的活性,具有还原能力的物质存在。见表2。
3.2.5 超氧阴离子自由基清除作用 NBT(氯化硝基四氮唑蓝)在560 nm处有最大吸收峰。当抗氧化剂有清除该自由基的能力时,其吸光值的改变与抗氧化剂的清除能力成定量关系,溶液颜色随着该自由基的减少而变浅,吸光度降低,因而可用分光光度法对被测物质的还原能力进行定量分析。在1 mg/mL浓度条件下,巴戟天75 %醇提取物的清除率达到28.782 %,说明其对超氧阴离子有一定的清除作用,并且随着样品浓度的增大,清除率也跟着增大。见表3。
4 讨论
巴戟天作为福建本土的道地药材,具有很高的药用及经济价值,对其的开发与利用一直是研究热点。特别是近年来人们对人体健康的重视,从天然药物中寻找抗氧化剂亦是一个研究的方向。自由基学说认为,生物体内多余的自由基会使机体器官产生衰退性变化。在正常情况下,生物体内自由基的产生与消除会达到一个动态平衡,但内源性的抗氧化物防御机制不足以应对由于衰老带来的自由基,行之有效的办法是通过补充体外抗氧化剂来减少生物体长期积累的氧化损伤[17]。实验结果表明,巴戟天醇提物对ABTS自由基、超氧阴离子自由基具有一定的清除作用,活性不是很显著,但是能够清除DPPH自由基,具有良好的总抗氧化能力和还原能力,表明巴戟天醇提部位存在清除自由基的物质,但还需要对其活性物质进一步的研究。细胞以及动物模型的测定值比体外化学提取法更具有生物相关性。为了能深入分析巴戟天活性物质在生物体内抗氧化的生物利用率及其物质基础,后续还需要利用细胞模型和动物模型来做进一步的研究。参考文献
[1]罗献瑞,高蕴璋,陈伟球,等. 中国植物志[M]. 北京:科学出版社,1999,71(2):199.
[2]国家药典委员会中华人民共和国药典(一部)[M]. 北京:中国医药科技出版社,2015:55.
[3]沈杰,马恩耀,赵志敏,等. 巴戟天多糖的提取分离及生物活性研究进展[J]. 中药新药与临床药理,2020,31(2):246-250.
[4]苏现明,王洪庆,陈若芸,等. 巴戟天属植物化学成分及药理活性研究进展[J]. 中药材,2017,40(4):986-991.
[5]吴岩斌,吴锦忠,张巧艳,等. 巴戟天属植物化学成分及生物活性研究新进展[J]. 解放军药学学报,2009,25(1):64-67.
[6]CHOI J,LEE KT,CHOI M Y,et al. Antinociceptive anti-inflammatory effect of monotropein isolated from the root of Morinda officinalis [J]. Biol Pharm Bull,2005,28(10):1915-1918.
[7]LI Y F,GONG Z H,YANG M,et al. Inhibition of the oligosaccharides extracted from Morinda officinalis,a Chinese traditional herbal medicine,on the corticosterone induced apoptosis in PC12 cells [J]. Life Sci,2003,72(8):933-942.
[8]LI N,QIN L P,HAN T,et al. Inhibitory effects of Morinda officinalis extract on bone loss in ovariectomized rats [J]. Molecules,2009,14(6):2049-2061.
[9]WU Y B,ZHANG Q Y,WU J Z,et al. Antiosteoporotic Activity of Anthraquinones from Morinda officinalis on Osteoblasts and Osteoclasts [J]. Molecules,2009,14(1):573-583.
[10]陈忠,刘琳玲,何猛雄,等. 南药巴戟天多糖提取方法的比较研究 [J]. 科技通报,2004,20(6):546-548.
[11]王建英,任引哲,王迎新,等. 氧自由基与人体健康 [J]. 化学世界,2006,47(1):61-63.
[12]PRIETO P,PINEDA M,AGUILAR,M. Spectrophotometric quantitation of antioxidant capacity through the formation of a phosphomolybdenum complex:Specific application to the determination of vitamin E [J]. Analytical Biochemistry,1999,269(2):337-341.
[13]WANG H,GAO X D,ZHOU G C,et al. In vitro and in vivo antioxidant activity of aqueous extract from Choerospondias axillaris fruit [J]. Food Chemistry,2008,106(3):888-895.
[14]FOROOGH BIGLARI,ABBAS F M,M. Antioxidant activity and phenolic content of various date palm(Phoenix dactylifera)fruits from Iran [J]. Food Chemistry,2008,107(4):1636-1641.
[15]QIAO D,KE C L,HU B,et al. Antioxidant activities of polysaccharides from Hyriopsis cumingii [J].Carbohydrate Polymers:Scientific and Technological Aspects of Industrially Important Polysaccharides,2009,78(2):199-204.
[16]程力惠,王建壮,卢丽霞,等. 正交设计优选巴戟天中多糖提取工艺 [J]. 中药材,2010,33(1):125-127.
[17]王光慈. 食品营养学[M]. 北京:中国农业出版社,2001:190-191.
(收稿日期: 編辑:)
