基于增强CT放射组学预测肝细胞肝癌病理分级
2020-08-06宁培钢海金金武明辉朱绍成王梅云史大鹏
宁培钢,高 飞,海金金,武明辉,陈 健,朱绍成,王梅云,史大鹏*
(1.河南省人民医院 河南大学临床医学院 郑州大学人民医院医学影像科,河南 郑州 450003;2.战略支援部队信息工程大学信息系统工程学院,河南 郑州 450001)
多数肝细胞肝癌(hepatocellular carcinoma, HCC)的发生是经过多级别癌变进展而来,病理组织学分级和类型是其预后因素影响[1]。影像学对诊断HCC及病理分级具有重要作用,多项研究[2-4]结果显示HCC影像学与病理分级及分类之间存在相关性。放射组学可充分挖掘图像中隐藏的生物信息[5],反映组织的异质性[6-7]。本研究探讨增强CT放射组学术前预测HCC病理分级的可行性及其价值。
1 资料与方法
1.1 一般资料 回顾性分析2013年2月—2017年8月429例接受肝部分切除术的HCC患者,男385例,女44例,年龄18~81岁,平均(55.3±8.9)岁。纳入标准:①经手术病理证实为HCC,并有HCC组织学报告;②术前2周内接受肝脏CT平扫及多期增强扫描;③术前未接受过其他HCC相关治疗。排除标准:图像质量欠佳;临床资料不全。将患者随机纳入测试组(n=100)和训练组(n=329)。
1.2 仪器与方法 采用GE LightSpeed VCT、Seimens SOMATOM Definition Flash CT机或Philips Brilliance 16排螺旋CT仪行术前腹部CT平扫及多期动态增强扫描,参数:管电压120 kV,自动管电流,转速0.4、0.5、0.75 s/r,探测器准直64×0.625 mm/128×0.625 mm/16×0.625 mm,视野(300~500) mm×(300~500) mm,矩阵512×512,层间距5 mm,层厚5 mm,重建层厚2 mm;经肘静脉以流率3.0~3.5 ml/s注射对比剂优维显(370 mgI/ml)1.5 ml/kg体质量后行增强扫描,分别于注射对比剂后25~30 s及60~70 s开始动脉期及静脉期扫描。记录CT特征,包括肿瘤位置、大小、形态、边界、数目、动态增强方式,肿瘤包膜,静脉栓子、肝硬化表现及淋巴结肿大等特征;并记录患者临床特征,包括年龄、性别、相关实验室检查结果[血清谷氨酰转移酶、丙氨酸转氨酶、甲胎蛋白(alpha fetoprotein, AFP)]及病理分级等。根据病理报告将其HCC分为低级别和高级别HCC,低级别HCC对应Edmondson Ⅰ、Ⅰ-Ⅱ及Ⅱ级,高级别HCC对应Edmondson Ⅱ-Ⅲ、Ⅲ、Ⅲ-Ⅳ及Ⅳ级[8]。
1.3 分割肿瘤图像并提取放射组学特征 由1名具有11年影像学诊断经验的副主任医师采用免费软件ITK-SNAP(http://www.itk-snap.org)于动脉期及静脉期图像手动分割肿瘤体积感兴趣区(volume of interest, VOI);参考相关文献[9-10],以MATLAB 2010a(MathWorks, Natick, USA)软件提取其组学特征,包括灰度特征、形状特征、纹理特征和小波特征等。
1.4 筛选特征并建立组学模型 采用最小绝对值收敛和选择算子(the least absolute shrinkage and selection operator method, LASSO)逻辑回归模型,基于动脉期(arterial phase, AP)、静脉期(venous phase, VP)及AP与VP联合图像分别筛选最有价值的组学特征,用于预测HCC病理分级[11];对筛选所得特征及其系数相乘进行线性组合,计算患者的放射学评分(rad-score),进行二分类判别。以10倍交叉验证训练选择HCC病理分级的最优组学预测模型。
1.5 统计学分析 采用R软件3.4.2版(http://www.Rproject.org)及Medcalc 16.2版本(Medcalc software, http://www.medcalc.org)统计分析软件。以中位数(上下四分位数)表示非正态分布计量资料,以频数表示计数资料。采用Mann-WhitneyU检验比较训练组及测试组中高级别与低级别HCC的Rad-score的差异;以chi-square检验及Mann-WhitneyU检验比较2组患者临床特征差异。对临床特征进行标准化处理后行单因素及多因素Logistic回归分析,结合LASSO逻辑回归模型构建临床模型;对最优组学模型的特征和临床特征进行多元回归分析,共同构建联合模型进行二分类判别。绘制组学模型、临床模型及联合模型分别预测训练组及测试组病理分级的ROC曲线,计算其AUC,评价其诊断效能;以用德隆检验比较3种模型AUC的差异。P<0.05为差异有统计学意义。
2 结果
2.1 筛选组学特征及建立组学模型 共于增强图像中提取656个放射学特征,包括328个AP特征和328个VP特征。基于AP图像、VP图像及AP与VP联合图像,分别筛选出15、23及31个最有价值的组学特征;结合LASSOLogistic回归模型构建其放射组学模型,对2组患者进行分类,结果显示训练组及测试组中高级别与低级别HCC的Rad-score差异均有统计学意义(Z=6.50及2.51、6.63及2.17、8.58及3.24,P均<0.05)。见图1。最终以AP与VP的联合组学模型为最优组学模型。
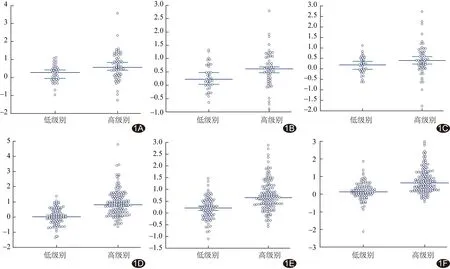
图1 2组基于AP+VP、AP及VP图像的rad-score A~C.测试组; D~F.训练组
2.2 2组临床特征比较 测试组与训练组患者临床特征差异均无统计学意义(P均>0.05)。见表1。
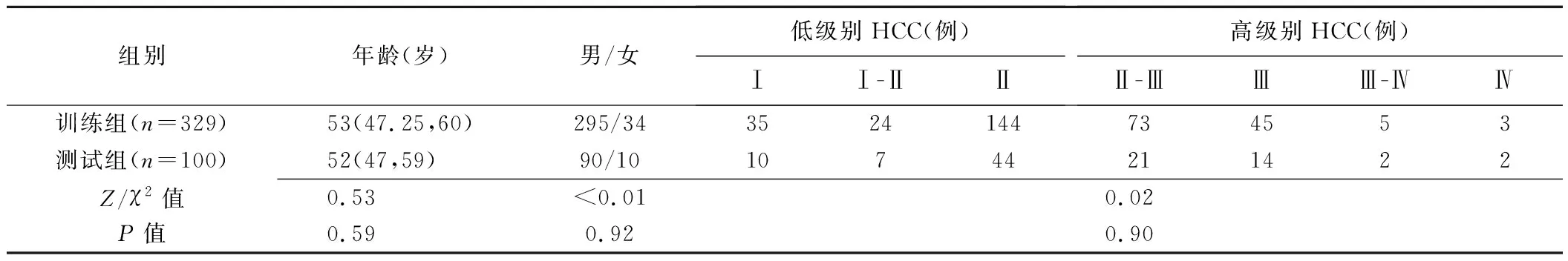
表1 2组HCC患者临床特征比较
2.3 3种模型的诊断效能 经单因素分析,年龄(P<0.01)、肿瘤直径(P<0.01)和血清AFP(P<0.01)为预测HCC病理分级的临床因素。多因素分析结果显示年龄、肿瘤直径及血清AFP为HCC病理分级的独立预测因子;结合LASSO逻辑回归模型构建临床模型,联合模型中,放射组学特征为预测HCC病理分级的独立危险因素(P<0.01),见表2。组学模型、临床模型和联合模型预测测试组和训练组HCC病理级别的ROC曲线结果见表3。测试组中,联合模型的AUC值(0.70)均大于组学模型(0.69)和临床模型(0.63),见图2;经德隆检验,3种模型间AUC差异无统计学意义(P均>0.05)。见图3。
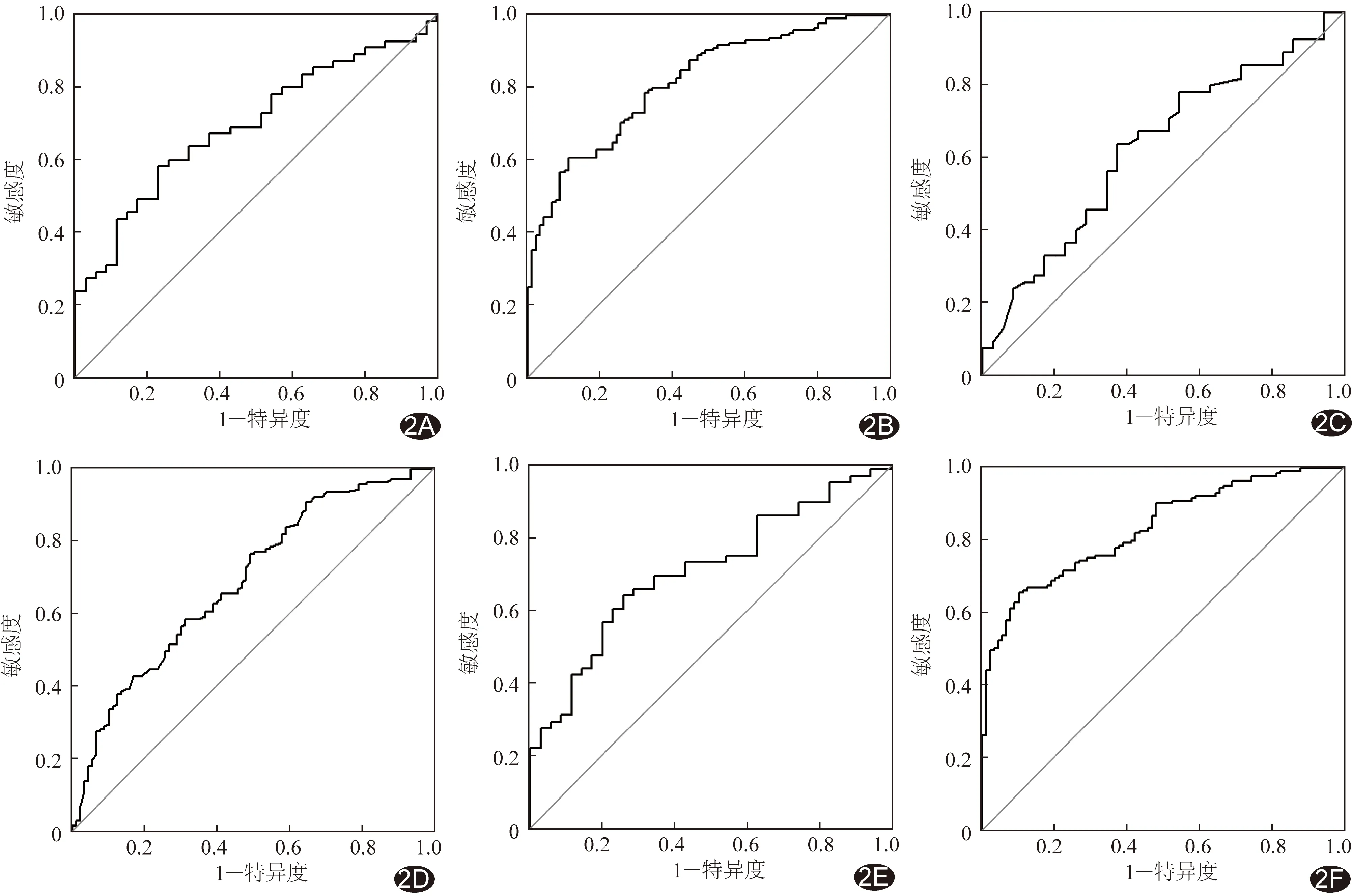
图2 放射组学模型、临床模型和联合模型预测2组病理级别的ROC曲线 A~B.基于测试组(A)和训练组(B)的组学模型; C~D.基于测试组(C)和训练组(D)的临床模型; E~F.基于测试组(E)和训练组(F)的联合模型
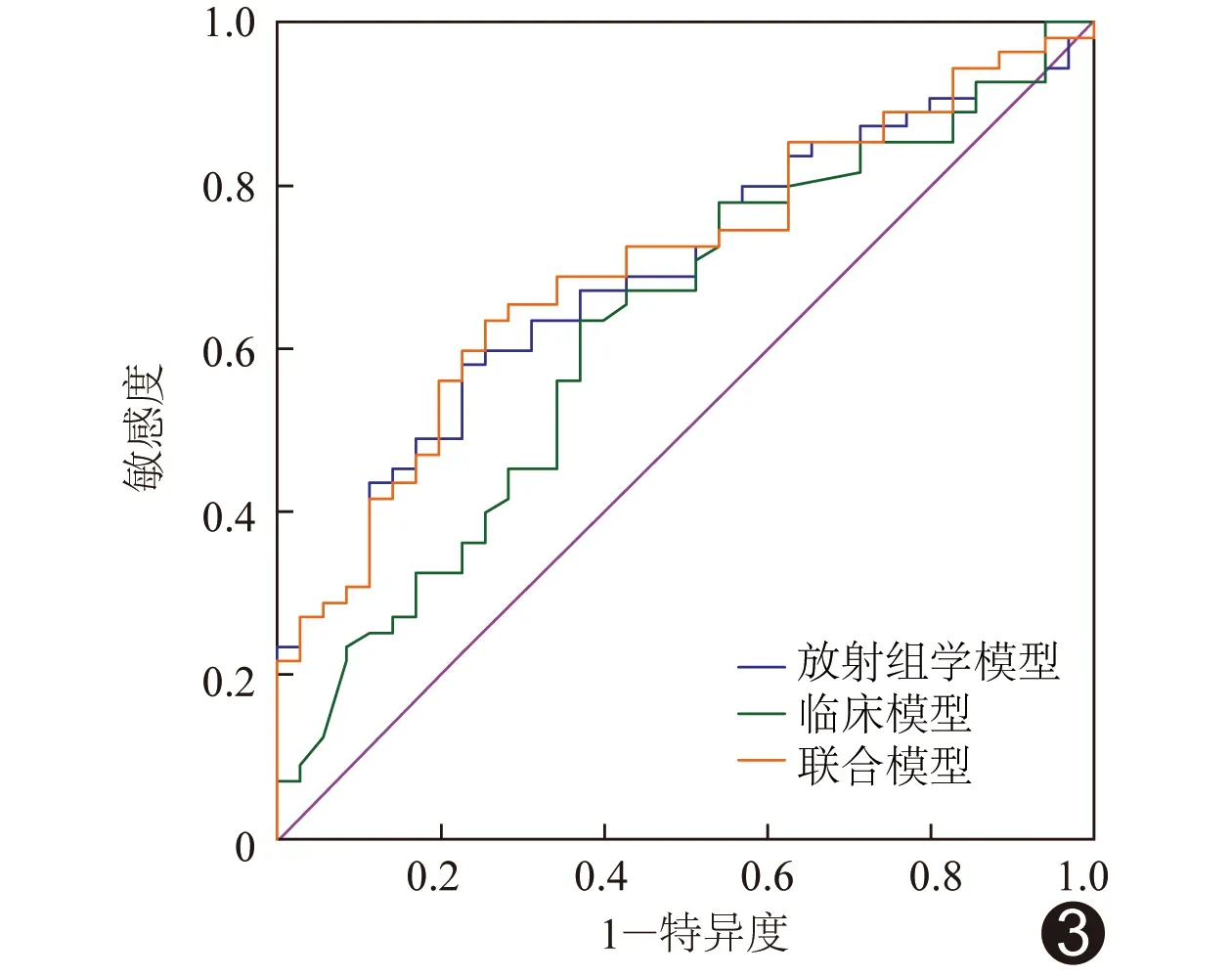
图3 3种模型预测测试组HCC病理级别的ROC曲线
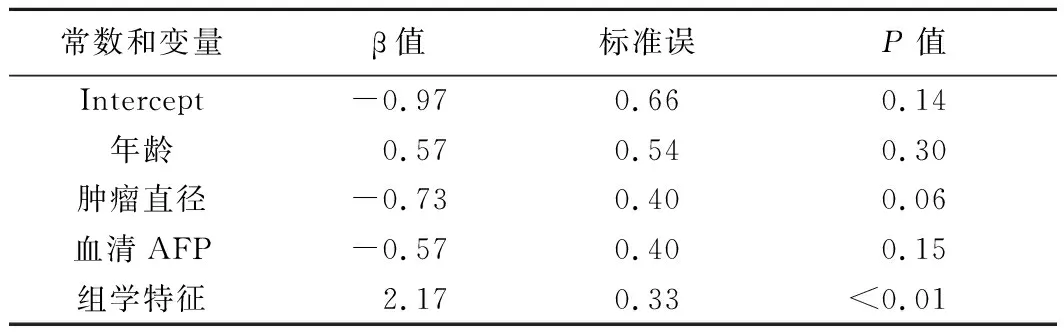
表2 临床特征及放射组学特征预测HCC病理分级的多因素分析结果
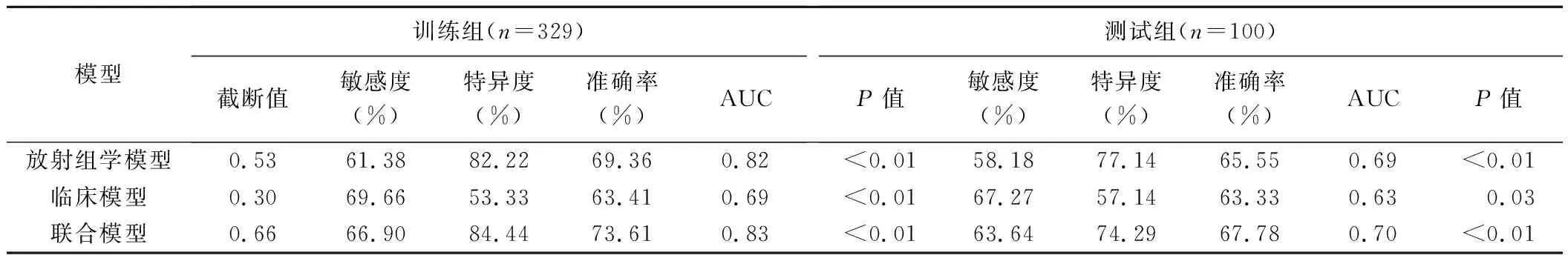
表3 放射组学模型、临床模型和联合模型分别预测2组HCC病理分级的ROC曲线分析结果
3 讨论
利用放射组学方法可捕获人眼无法识别的图像微观信息,反映组织的生物异质性,获得与肿瘤病理改变相关的更精准的信息,有利于鉴别诊断肿瘤、评估病理分级及预测预后等。本研究基于增强CT图像的放射组学特征术前预测HCC病理分级,均可将HCC分类为高级别HCC和低级别HCC,提示增强CT图像可反映肿瘤异质性,根据其放射学特征可识别肿瘤异质性所致微小密度差异。
研究[12]表明HCC病理分级Ⅰ级与Ⅱ级、Ⅲ级与Ⅳ级患者之间总生存时间或无瘤生存期差异无统计学意义,但Ⅲ级患者生存时间明显短于Ⅰ级及Ⅱ级。本研究将病理Ⅰ级、Ⅱ级及Ⅰ-Ⅱ级HCC归为低级别HCC,Ⅱ-Ⅲ级、Ⅲ级、Ⅲ-Ⅳ级及Ⅳ级归为高级别HCC。HCC本身的异质性导致其病理分级复杂多样,同一个肿瘤内可能同时存在分化程度不同的肿瘤细胞;鉴于高级别肿瘤具有更明显的血管侵犯倾向,其预后较低级别病变更差,故将整个肿瘤分级以较高级别部分为准[13]。
本研究结果显示,临床模型预测HCC病理分级的能力弱于放射祖学模型和联合模型,后者的预测能力最强,与基于放射学特征进行的结肠直肠癌分级研究结果[14]相符合。ZHOU等[15]采用基于增强MRI的纹理特征预测HCC病理分级的AUC值达0.83及以上,明显高于本研究采用CT增强图像的纹理特征的AUC,可能与增强MRI能提供更多肿瘤异质性相关信息有关;但该研究样本量较少(46例),且缺少测试组验证,可能导致过拟合现象,有待进一步验证。
与既往研究[16-17]不同,本研究临床模型中,患者年龄、肿瘤直径及血清AFP均为独立危险因素。CHEN等[18]认为年龄<40岁HCC患者1年生存率低于年龄≥40岁者,原因可能在于发生于年轻患者的肿瘤的生物学行为更具侵袭性;而血清AFP升高与HCC的侵袭性增加及细胞倍增时间缩短密切相关[19],血清AFP越高代表肿瘤恶性程度越高,病理分级也越高。联合模型中仅放射组学特征为独立危险因素,原因可能在于相对于放射组学特征,临床特征对HCC的影响较小,与OUYANG等[20]的结果一致,提示放射组学特征反映整个肿瘤的异质性,与患者预后相关。
本研究的主要局限性:①样本量相对仍显不足;②HCC病理分级仅分为低级别和高级别,不够细化;③手动分割肿瘤VOI,不可避免地影响其准确性及可重复性,有待扩大样本量进一步观察。
综上所述,基于增强CT图像的放射组学特征可用于术前预测HCC组病理学分级,为诊断及治疗HCC提供参考。
