抑瘤素M对人脐带间充质干细胞增殖和成骨分化的影响
2020-08-05周余来孙忠平邹颖刚
孔 宁,周余来,张 璐, 石 毅,石 艳,孙忠平,邹颖刚
(1. 吉林大学药学院医用生物材料学教研室,吉林 长春130021;2. 吉林省中科生物工程股份有限公司,吉林 长春 130012;3. 吉林大学药学院生物工程实验中心,吉林 长春130021;4. 吉林大学药学院实验药理与毒理学教研室,吉林 长春130021;5. 吉林大学第二医院妇产科生殖中心,吉林 长春130041)
近年来骨组织工程与再生医学技术的迅猛发展,为解决传统植骨术后骨形成缓慢和新骨形成不良等技术难点提供了一种有效解决途径,其中种子细胞的来源、调控种子细胞成骨分化的诱导剂是其关键所在[1]。人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs)取材于分娩废弃物的脐带组织,hUCMSCs在体外具有多向分化潜能,可成为各种组织的种子细胞。hUCMSCs不表达主要组织相容性复合物(major histocompatibility complex,MHC)-Ⅱ类抗原,表达MHC-Ⅰ类抗原,不表达或低表达移植免疫排斥相关的共刺激因子CD80、CD86、CD40和CD40L等,是一类免疫缺陷细胞[2]。hUCMSCs具有很强的免疫抑制能力,包括NK细胞、T细胞和B淋巴细胞及DC等,在多方面被证明是自体和异体细胞移植治疗的理想细胞。与骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)比较,hUCMSCs在增殖和诱导分化能力方面更具潜能[3]。抑瘤素M(oncostatin M,OSM)是一种多功能的细胞因子,具有调节基因活性、细胞存活、增殖和分化的功能[4]。OSM对调节骨发育和重塑至关重要,基因敲除或转基因小鼠研究[5]证明OSM对于小鼠正常骨发育和骨转换是必不可少的。过表达OSM的转基因小鼠能促进骨质疏松组织的发育,可能是通过刺激骨形成并抑制骨吸收所致。成骨分化模型的体外研究[6]表明:OSM能刺激BMSCs的成骨分化、抑制成脂分化。目前OSM对hUCMSCs是否具有成骨分化作用尚未见相关报道。本课题组前期应用基因工程技术已制备出足量、高活性、高纯度的重组人抑瘤素M(recombinant human OSM,rhOSM)[7-8],本研究进一步探讨rhOSM对hUCMSCs增殖及分化的影响,观察OSM能否促进hUCMSCs定向成骨分化,旨在明确OSM是否为一种良好的成骨诱导活性因子。
1 材料与方法
1.1 细胞、主要试剂和仪器hUCMSCs由吉林省中科生物工程股份有限公司惠赠。rhOSM由吉林大学药学院医用生物材料教研室制备并保存。胎牛血清、DMEM/F-12培养基、胰蛋白酶和细胞冻存液(美国Gibco公司),地塞米松、β-甘油磷酸钠、抗坏血酸和氯化十六烷基吡啶(美国Sigma公司),TRIzol和反转录定量PCR试剂盒(日本TaKaRa公司),骨钙素(osteocalcin,OCN)抗体、Runt相关转录因子2(Runt related transcription factor 2,Runx2)抗体和GAPDH抗体(美国Santa Cruz公司),间充质干细胞(mesenchymal stem cells,MSCs)流式检测试剂盒(美国BD公司),CCK-8试剂盒和BCIP/NBT碱性磷酸酯酶(alkaline phosphatase,ALP)显色试剂盒(上海碧云天生物技术有限公司),ALP检测试剂盒(南京建成生物工程研究所),茜素红钙染色试剂盒(上海杰美基因医药科技有限公司),引物由生工生物工程(上海)有限公司合成。CO2恒温孵箱(日本Sanyo公司),核酸蛋白定量检测仪和高速离心机(德国Eppendorf公司),实时荧光定量PCR系统(美国Applied Biosystems公司)。
1.2 细胞培养利用添加终浓度为10%胎牛血清的DMEM/F-12基础培养基对hUCMSCs进行常规培养。将细胞置于37℃、5% CO2孵箱中培养,细胞生长至80%融合时传代。
1.3 流式细胞术鉴定hUCMSCs免疫表型收集第3代处于对数生长期的hUCMSCs ,制成单细胞悬液。分别加入抗人 CD90、CD73、CD105、CD34、CD45、CD11b、CD19C和HLA-DR 单克隆抗体,4℃避光孵育30 min,将细胞重悬后经流式细胞仪检测细胞表型分子阳性率,根据MSC标准鉴定hUCMSCs。
1.4 CCK-8法检测hUCMSCs的增殖活性取第3代hUCMSCs,按每孔1×104个细胞接种于96孔培养板中,细胞分为对照组和不同剂量(终浓度分别为0.1、1.0和10.0 μg·L-1)rhOSM组,每组设置4个复孔。放入孵箱中连续培养96 h,每24 h取出1块培养板加入10 μL CCK-8溶液,37℃避光孵育4 h后在450 nm波长处检测各孔吸光度(A)值,以A(450)值的平均值表示hUCMSCs增殖活性。
1.5 hUCMSCs成骨分化诱导培养取第3代hUCMSCs以每孔2×105个细胞接种于24孔培养板,待细胞贴壁后更换为含不同剂量rhOSM的成骨诱导液继续培养,每2 d换液1次。分为对照组(基础培养基)、经典成骨诱导剂组(基础培养基+100 nmol·L-1地塞米松+10 mmol·L-1β-甘油磷酸钠+50 mg·L-1抗坏血酸)和不同剂量rhOSM组(基础培养基+经典成骨诱导剂+0.1、1.0和10.0 μg·L-1rhOSM)。
1.6 BCIP/NBT法进行ALP染色和ALP活性检测成骨诱导培养14 d,吸去培养板里的培养液,洗涤细胞表面,每孔加入固定液固定2 min,加入染色液室温避光孵育30 min,加入清理液清洗2 min,观察并拍照,肉眼可见蓝色颗粒即代表ALP有活性。分别于成骨诱导第4、7和14天取出培养板,吸弃培养液上清,用PBS缓冲液清洗2次,每孔加入200 μL 0.1% Triton X-100冰上裂解10 min,吸取上清液,用BCA试剂盒测定蛋白质水平,用ALP试剂盒定量检测ALP活性,根据说明书操作步骤,按以下公式计算ALP活性,实验重复4次。ALP活性(U·g-1)=[测定A值-空白A值]/[标准A值-空白A值]×标准品浓度(0.1 g·L-1)/待测样品蛋白浓度( g·mL-1)。
1.7 茜素红染色法检测钙结节的生成及半定量分析细胞矿化活性成骨诱导培养21 d,吸弃培养液,用PBS缓冲液洗涤2次,70%冰乙醇固定1 h,2%茜素红溶液室温下染色10 min,吸弃染液,以双蒸水清洗5次,PBS缓冲液晃动漂洗15 min,干燥后显微镜下观察并拍照,橘红色沉淀即为矿化钙结节。分别于成骨诱导第14和21天,取出培养板,茜素红染色后,每孔加入10%氯化十六烷基吡啶溶液100 μL ,室温放置15 min,取上清于96孔培养板中,562 nm波长处检测其A值,代表细胞矿化活性,实验重复4次。
1.8 实时荧光定量PCR(RT-qPCR)法检测细胞中成骨分化相关基因mRNA表达水平成骨诱导第4、7、14和21天,TRIzol法提取细胞RNA,反转录为cDNA,以cDNA为模板,以GAPDH为内参照进行扩增,检测成骨分化相关基因Runx2和OCN mRNA表达水平,实验重复4次。PCR反应条件:95℃、10 min;95℃、30 s,60℃、30 s,40个循环。PCR引物:Runx2正向引物5′-GGACTGGGTATGGTTTGTAT-3′, Runx2反向引物5′-GCTGAAGAGGCTGTTTGA-3′;OCN正向引物5′-ACCACATCGGCTTTCAG-
G-3′, OCN反向引物5′-CATAGGGCTGGGAGGTCA-3′;GAPDH正向引物5′-GCAAGTTCAACGGCACAG-3′, GAPDH反向引物5′-CGCCAGTAGACTCCACGAC-3′。采用2-ΔΔCt法计算Runx2和OCN mRNA表达水平。
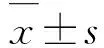
2 结 果
2.1 流式细胞术鉴定hUCMSCs表面标志物第3代hUCMSCs经检测,阳性标志物CD90、CD105和CD73表达率分别为99.9%、99.5%和97.9%,阴性标志物CD34、CD45、CD11b、CD19C和HLA-DR表达率为0.3%,表明所检测的细胞表达MSC特异性抗原标志而不表达造血干细胞、内皮细胞特异性标志,确定检测细胞为MSC。见图1。
A:CD90;B:CD105;C:CD73;D:CD34,CD45,CD11b,CD19C,and HLA-DR.
2.2 各组hUCMSCs增殖活性rhOSM处理hUCMSCs 24 和48 h,与对照组比较,各剂量rhOSM组hUCMSCs增殖活性差异无统计学意义(P>0.05);处理72 h,与对照组比较,0.1和1.0 μg·L-1rhOSM组hUCMSCs增殖活性差异无统计学意义(P>0.05),10.0 μg·L-1rhOSM组hUCMSCs增殖活性明显降低(P<0.05);处理96 h,与对照组比较, 各剂量rhOSM组hUCMSCs增殖活性明显降低(P<0.05或P<0.01),且各剂量rhOSM组组间比较差异也有统计学意义(P<0.01),具有时间-剂量依赖性。见表1。
2.3 各组细胞ALP染色情况和 ALP活性成骨诱导第14天,除对照组出现较微弱的蓝色颗粒之外,其余各组均可见明显的蓝紫色颗粒,且各剂量rhOSM成骨诱导组细胞中蓝紫色颗粒明显多于经典成骨诱导剂组。在检测的3个时间点内,各剂量rhOSM组细胞中ALP活性明显高于对照组(P<0.01)和经典成骨诱导剂组(P<0.05),且随着rhOSM剂量升高,各剂量rhOSM组ALP活性也升高,差异有统计学意义(P<0.05)。诱导第7天各剂量rhOSM组细胞中ALP活性较诱导第4天明显升高(P<0.01),rhOSM上调ALP活性具有时间-剂量依赖性。诱导第14 天, ALP活性较第7 天 有所降低,但差异无统计学意义(P>0.05)。见图2(插页二)和表2。
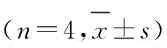
表1 诱导不同时间后各组hUCMSCs增殖活性
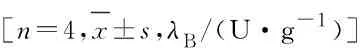
表2 诱导不同时间后各组hUCMSCs的ALP活性
2.4 各组细胞矿化钙结节形成情况和细胞矿化活性成骨诱导第21天,除对照组无矿化结节出现外,其余各组均可见桔红色矿化结节;与经典成骨诱导剂组比较,rhOSM组钙结节数量明显增多、着色面积明显增大且着色程度明显增强。诱导第7、14和21天,与对照组和经典成骨诱导剂组比较,各剂量rhOSM组细胞矿化活性均明显升高(P<0.05);与0.1 μg·L-1rhOSM 组比较,1.0和10.0 μg·L-1rhOSM 组细胞矿化活性明显升高(P<0.05)。rhOSM诱导hUCMSCs钙盐沉积具有时间-剂量依赖性,且rhOSM可与化学诱导剂产生协同诱导效应。见图3(插页二)和表3。
2.5 各组细胞中Runx2和OCN mRNA表达水平成骨诱导第4、7和14天,与对照组比较,经典成骨诱导剂组和各剂量rhOSM组细胞中Runx2 mRNA表达水平均明显升高(P<0.01);与经典成骨诱导剂组比较,各剂量rhOSM组细胞中Runx2 mRNA表达水平明显升高(P<0.05);与0.1 μg·L-1rhOSM组比较,1.0和10.0 μg·L-1rhOSM组细胞中Runx2 mRNA表达水平明显升高(P<0.05);与诱导第7天比较,诱导第14天各剂量rhOSM组细胞中Runx2 mRNA表达水平有所降低,但差异无统计学意义(P>0.05)。
成骨诱导第7、14和21天,与对照组比较,经典成骨诱导剂组和各剂量rhOSM组细胞中OCN mRNA表达水平均明显升高(P<0.01);与经典成骨诱导剂组比较,诱导第7天1.0和10.0 μg·L-1rhOSM组和诱导第14和21天各剂量rhOSM组细胞中OCN mRNA表达水平均明显升高(P<0.05);诱导第7、14和21天,与0.1 μg·L-1rhOSM组比较,1.0和10.0 μg·L-1rhOSM组细胞中OCN mRNA表达水平明显升高(P<0.05)。rhOSM诱导hUCMSCs成骨分化相关基因表达呈时间-剂量依赖性。见图4和图5。
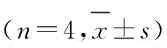
表3 诱导不同时间后各组hUCMSCs的矿化活性
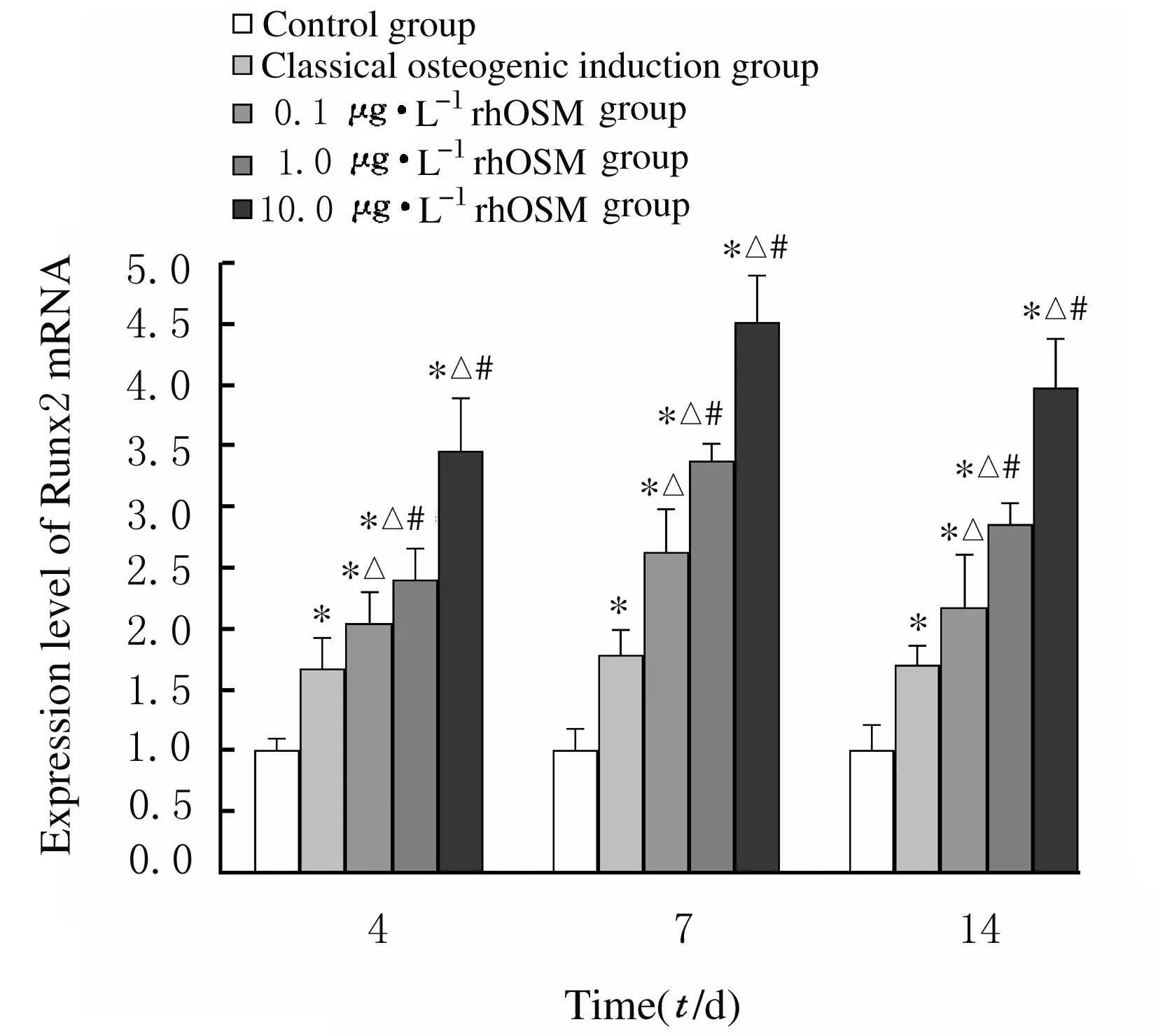
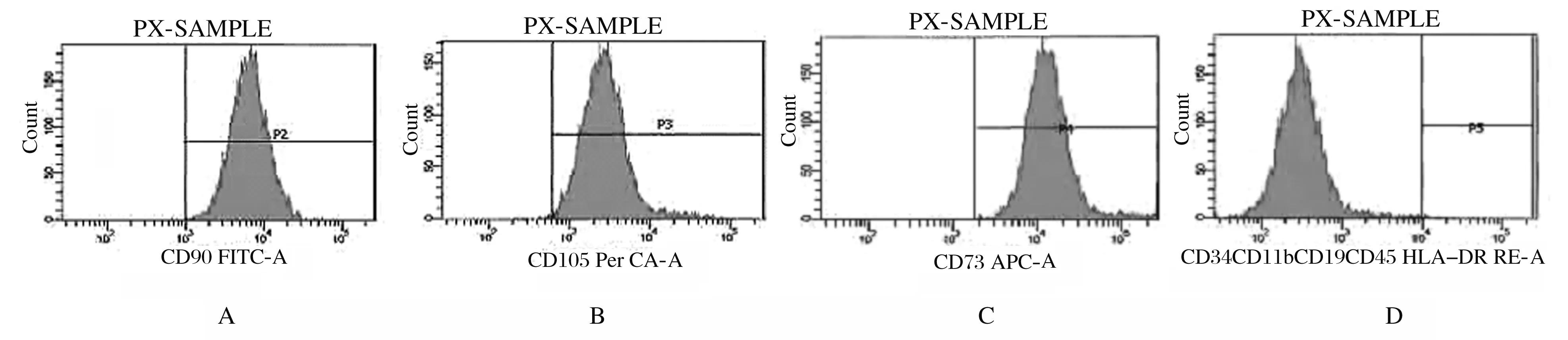
n=4,*P<0.01 vs control group; △P<0.05 vs classical osteogenic induction group; #P<0.05 vs 0.1 μg·L-1 rhOSM group.
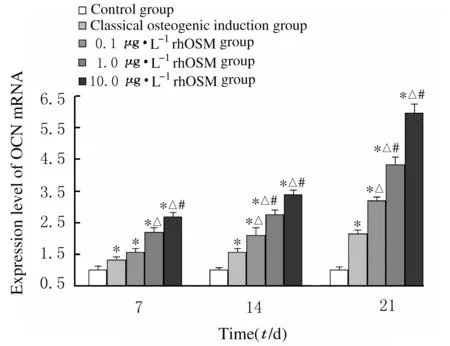
n=4,*P<0.01 vs control group; △P<0.05 vs classical osteogenic induction group; #P<0.05 vs 0.1 μg·L-1 rhOSM group.
3 讨 论
由外伤、肿瘤、感染或骨折治疗不当等引起的骨缺损、骨折不连接在临床上极为常见。骨骼移植是治疗骨缺损和骨折不连接的必需手段。目前,新的研究思路是从成骨支架、成骨种子细胞和调控成骨分化的细胞因子三方面着手提高骨骼移植的效果。目前成骨支架多使用Ⅰ型胶原和羟基磷灰石等;成骨种子细胞问题的解决则得益于MSCs的发现和使用,由于MSCs具有多向分化潜能,因此寻找促进MSCs定向成骨分化的有效的骨诱导活性因子是目前制约骨再生研究发展的瓶颈[9]。研究[10-12]表明:细胞因子具有明显的促进MSCs成骨分化的特性,如骨形态蛋白(bone morphogenetic protein,BMP)、碱性成纤维细胞因子(basic fibroblast growth factor,bFGF)和转化生长因子(transforming growth factor-β,TGF-β)等。OSM属于白细胞介素6(interleukin-6,IL-6)家族,体外成骨模型试验获得的数据[13]提示:该家族成员正向或反向调控成骨分化取决于细胞类型或分化阶段。与OSM同为IL-6家族成员的白血病抑制因子(leukemia inhitory factor,LIF)能抑制小鼠基质细胞的成脂分化,刺激胚胎干细胞成骨分化。小鼠关节炎模型中,腺病毒转染的小鼠OSM(mOSM)能够刺激小鼠骨形成[14],应用人OSM(hOSM)处理脂肪间充质干细胞能够提高ALP活性,并抑制成脂分化[15],表明hOSM和mOSM均能促进成骨分化。
本研究中CCK-8法检测结果表明:rhOSM短期作用对hUCMSCs的增殖并无明显影响,长期处理(>72 h)可抑制其增殖,且呈时间-剂量依赖性,提示rhOSM抑制hUCMSCs增殖的同时可能促进其分化。ALP是鉴定成骨细胞的生化和组织学标志,其活性在一定程度上反映成骨细胞的分化程度和功能状态[16-17]。Runx2是成骨分化及骨形成过程中的特异性转录因子,能够调控成骨分化相关基因,如骨唾液酸糖蛋白(bone sialoprotein,BSP)、骨桥蛋白(osteopontin,OPN)和OCN的表达,从而促进成骨[18]。ALP和Runx2是成骨分化早期标志物。本研究结果显示:与诱导第4和7天比较,诱导第14天各剂量rhOSM组细胞中ALP活性和Runx2 mRNA表达水平均明显升高,呈时间-剂量依赖性,并明显高于经典成骨诱导剂组,表明rhOSM与化学诱导剂具有协同诱导效应;诱导第14天,ALP活性和Runx2 mRNA表达水平较第7天有所降低,表明成骨分化已经进入矿化阶段,与有关报道[19]一致。
矿化结节的形成是成骨分化的最后阶段,包括胶原蛋白的沉积和基质矿化2个步骤,是体外成骨分化的晚期标志[20]。OCN是由成熟的成骨细胞特异合成和分泌的含量最丰富的非胶原蛋白,是反映成骨细胞活性和骨转换状况的特异而敏感的标志物,对钙和羟基磷灰石有较高的亲和力[21]。本研究结果显示:连续诱导21 d,各剂量rhOSM组细胞成骨矿化活性和OCN mRNA表达水平均明显升高,表明rhOSM诱导hUCMSCs钙盐沉积呈时间-剂量依赖性,rhOSM能够增强经典成骨诱导剂对hUCMSCs成骨分化的促进作用。本研究结果与有关牙髓干细胞[22-23]和脂肪来源的MSCs[15]的研究结果相一致。
综上所述,本次研究初步验证了rhOSM不仅能够上调成骨分化特异的转录因子Runx2以及成骨分化标志物OCN的表达,还能增加成骨细胞ALP的活性和钙盐的沉积,表明OSM在体外能够促进hUCMSCs成骨分化,为骨组织工程提供了一种可选的成骨诱导活性因子。但MSCs成骨分化是一个复杂的和调控严格的过程,其过程受一系列内源性和各种环境因子以及信号通路的影响,因此还需进一步体内实验来验证。
