PEDV N蛋白单克隆抗体的制备及间接免疫荧光检测方法的建立
2020-08-05邝燕齐莫梅君何红玲周金柱周如月郭霄峰
邝燕齐,莫梅君,何红玲,周金柱,周如月,郭霄峰
(1 华南农业大学 兽医学院,广东 广州 510642;2 江苏省农业科学院 兽医研究所,江苏 南京 210014)
猪流行性腹泻 (Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种高度接触性猪肠道传染疾病。PEDV主要引起10日龄以内的仔猪发病,典型的症状为水样腹泻、脱水、呕吐等。自1971年英国首次报道PED后,该病已在世界各地流行[1-4]。2011年以来,我国多个地区暴发了PEDV变异毒株引起的PED[5-8],新生仔猪发病率和死亡率高达90%以上,给我国养猪业造成了巨大损失[9-10]。
PEDV是有囊膜的单股正链RNA病毒,属于冠状病毒科α冠状病毒属的成员,主要结构蛋白包括纤突 (Spike,S)蛋白、膜 (Membrane,M)蛋白、包膜(Envelope,E)蛋白和核衣壳 (Nucleocapsid,N)蛋白[11]。每种蛋白都在病毒的繁殖中发挥重要作用。N蛋白高度保守,在病毒的结构蛋白中所占比例最大[12-13],也是病毒复制过程中表达量最大的一种碱性结构蛋白,对诱导细胞免疫至关重要。与S蛋白一样,N蛋白也是早期准确检测PEDV感染的靶蛋白[14-15]。N蛋白还是一种重要的抗原,在病毒感染机体的早期刺激机体产生体液免疫,诱导机体产生大量抗N蛋白抗体,普遍用于针对PEDV的血清学检测。
本研究基于N蛋白的特点,以原核表达的方法制备重组N蛋白,制备抗N蛋白单克隆抗体,并使用该抗体建立PEDV间接免疫荧光试验的抗体检测方法,为PEDV的实验室检测及PEDV在感染细胞中的定位和动态分布研究提供有效手段。
1 材料与方法
1.1 菌种、毒株、细胞系
原核表达载体pET-32a(+),PEDV(CH/GDZH02/1401,简称ZH02),猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)、猪伪狂犬病毒(Porcine pseudorabies virus,PPRV)、猪瘟病毒(Classical swine fever virus,CSFV)、猪繁殖与呼吸综合征病毒 (Porcine reproductive and respiratory syndrome virus,PRRSV)、Vero 细胞、PEDV 抗体均由华南农业大学兽医学院微生物学与免疫学教研室保存。SP2/0骨髓瘤细胞、猪肠道α冠状病毒(Porcine enteric α corone virus,PEAV)、猪轮状病毒 (Porcine rotavirus,PoRV)分别由华南农业大学琚春梅博士、马静云教授和江苏农业科学院兽医研究所何孔旺研究员惠赠。
1.2 主要试剂
50×HAT(次黄嘌呤−氨甲碟呤−胸腺嘧啶核苷)、HT(次黄嘌呤−胸腺嘧啶核苷)、弗氏佐剂和弗氏不完全佐剂均为Sigma公司产品。HRP−羊抗鼠IgG为碧云天公司产品。FITC−羊抗鼠IgG为博奥森公司产品。
1.3 试验动物
SPF BALB/c 6~8周龄雌性小鼠购自南方医科大学实验动物中心。
1.4 PEDV N蛋白重组质粒的构建、表达与鉴定
根据ZH02毒株(GenBank注册号为KR 153326)基因组序列,设计 1 对引物:PEDV-N-F:5′-CGGCATATGATGGCTTCTGTCAGTTTTCA-3′,PEDV-N-R:5′-CCGCTCGAGATTTCCTGTGTCG AAGATCTC-3′。提取病毒RNA,以PEDV-N-F和PEDV-N-R为引物通过RT-PCR扩增 N 基因,与pET-32(a)连接,构建PEDV N 基因重组表达质粒,命名为pET-N。将构建的重组表达载体转化大肠埃希菌Transetta(DE3)进行N蛋白的表达和纯化,随后将纯化好的蛋白进行Western blot鉴定。
1.5 动物免疫
6只8周龄雌性BALB/c小鼠饲养于华南农业大学动物实验中心。300 μg的PEDV N蛋白与等体积(500 μL)弗氏完全佐剂一起乳化制备免疫原,皮下注射小鼠。一次免疫后第15天和第29天,用等体积(500 μL)弗氏不完全佐剂乳化 300 μg 抗原分别进行二次免疫和三次免疫。三次免疫后第10天检测小鼠抗N蛋白抗体效价,当抗体效价达到1∶100 000 后,于融合前 3 d 腹腔注射非乳化抗原 150 μg加强免疫一次。
1.6 抗体滴度的测定
在96孔酶标反应板中,每孔加入100 μL纯化后的 N 蛋白 (ρ为 8 μg/mL),37 ℃ 条件下温育 1 h,然后4 ℃条件下过夜。弃去包被液,用PBST缓冲液洗涤3次。每孔加入100 μL封闭液,37 ℃恒温箱中封闭2 h。弃去封闭液,用PBST缓冲液洗涤3次,加入用PBS缓冲液倍比稀释的血清或细胞上清液,置于37 ℃条件下温育70 min。弃去孵育液,用 PBST 缓冲液洗涤 3 次,加入 100 μL HRP−羊抗鼠IgG(用PBS缓冲液按体积比1∶10 000稀释)的二抗,置于37 ℃条件下温育40 min。弃去孵育液,用PBST缓冲液洗涤3次,加入100 μLTMB底物,37 ℃恒温箱避光显色5~10 min,加入50 μL终止液终止反应,用酶标仪测定D450 nm,计算抗体滴度。
1.7 杂交瘤细胞的筛选
以聚乙二醇(PEG)1450为融合剂将获得的阳性小鼠脾细胞和SP2/0骨髓瘤细胞融合,融合后第10天按照“1.6”的方法检测细胞上清液,筛选抗体呈阳性细胞孔。之后对阳性孔中的杂交瘤细胞进行亚克隆,每亚克隆1次需要对细胞上清液进行ELISA检测,直到获得单个杂交瘤细胞株。亚克隆成功后,将杂交瘤细胞株置于液氮中保存。
1.8 单克隆抗体的制备、检测和鉴定
1.8.1 制备 取生长状态良好、抗体分泌能力强的杂交瘤细胞株通过体内诱生法制备腹水。将弗氏不完全佐剂按每只500 μL的剂量腹腔注射雌性BALB/c小鼠,致敏7 d备用。从细胞培养瓶中吹下杂交瘤细胞,调整细胞数至1×106/mL,用1640培养液洗涤2~3次后腹腔注射经弗氏不完全佐剂致敏的小鼠。10~15 d后,小鼠腹部明显膨大时抽取腹水,经4 000 r/min 离心 20 min,收集上清液,ELISA 测定抗体效价后分装冻存于−80 ℃。
1.8.2 单克隆抗体的特异性检测 为验证获得的单克隆抗体的特异性,以TGEV、PPRV、CSFV、PRRSV为抗原包被酶标板,进行间接ELISA检测。
1.8.3 单克隆抗体的 Western blot鉴定 将表达的N蛋白经SDS-PAGE电泳后转移到PVDF膜上,再将膜放入50 g/L脱脂牛乳溶液中封闭,置于37 ℃条件下孵育2 h;使用PBST缓冲液洗涤4次,将制备的腹水用PBS缓冲液按体积比1∶5 000稀释作为一抗,置于4 ℃条件下过夜孵育;使用PBST缓冲液洗涤4次,HRP−羊抗鼠IgG用PBS缓冲液按体积比1∶5 000稀释后作为二抗,置于37 ℃条件下中孵育1 h;使用PBST缓冲液洗涤4次,加入DAB显色。
1.9 间接免疫荧光试验
1.9.1 试验方法的建立 待96孔板的Vero细胞长成单层后,接种PEDV。20 h后,弃培养液,每孔加入 150 μL 预冷的 80%(φ)丙酮溶液,−20 ℃ 条件下固定30 min。随后每孔用灭菌的PBS缓冲液洗涤3次,再于每孔加入50 μL用PBS缓冲液稀释的一抗N蛋白单克隆抗体(N蛋白单克隆抗体与PBS缓冲液的体积比为1∶200),37 ℃条件下孵育2 h。用灭菌的PBS缓冲液洗涤3次,每孔加入50 μL用PBS缓冲液稀释的二抗FITC−羊抗鼠IgG(FITC−羊抗鼠IgG与PBS缓冲液的体积比为1∶ 100),在 37 ℃ 条件下孵育 1 h。用灭菌的 PBS缓冲液洗涤3次,最后每孔加入100 μL灭菌的PBS缓冲液,置于荧光倒置显微镜下观察。
1.9.2 试验方法的优化 本试验主要对一抗工作浓度、二抗工作浓度和孵育时间进行了优化。一抗工作浓度:分别按体积比 1∶100、1∶200、1∶500、1∶1 000、1∶2 000 稀释;二抗工作浓度:分别按体积比 1∶100、1∶200、1∶500、1∶800 稀释;一抗孵育时间:4 ℃条件下过夜孵育、37 ℃条件下孵育2 h。镜检观察结果。
1.9.3 特异性试验 在长成单层的Vero细胞中分别接种 CSFV、PRRSV、TGEV、PPRV、PEAV、PoRV和PEDV,同时设立不接病毒的正常细胞为对照。接种24 h后,用“1.12”建立的间接免疫荧光方法进行检测。
1.9.4 无一抗对照试验 用PBS缓冲液替代一抗进行间接免疫荧光试验,观察二抗是否有特异性反应,同时设立阳性对照。
1.9.5 重复性试验 取同批次和不同批次的Vero细胞接种病毒,按“1.9.2”建立的间接免疫荧光方法进行试验,检测本方法是否具有重复性。
1.9.6 样品自发光对照试验 将未接种病毒的细胞板和接种病毒的细胞板弃去培养基后,每孔加入100 μL灭菌的PBS缓冲液,然后置于荧光显微镜下观察是否存在自发荧光现象,同时设阳性对照。1.9.7 敏感性试验 将PEDV病毒液用不完全培养基DMEM 按照10倍倍比梯度(1∶10、1∶100、1∶1 000、1∶10 000、1∶100 000、1∶1 000 000)进行稀释,按照“1.9.2”建立的间接免疫荧光试验方法进行试验,以出现明显荧光的最大稀释倍数的病毒稀释度作为检测的最高灵敏度。
2 结果与分析
2.1 PEDV N蛋白重组质粒的构建
以提取的PEDV核酸为模板,通过RT-PCR扩增 N 基因,再插入pET质粒的多克隆位点,构建表达重组质粒pET-N。再以该重组子菌液为模板,用PEDV-N-F、PEDV-N-R为引物进行RT-PCR扩增。结果显示,扩增片段为1 400 bp左右,与预期结果一致 (图 1)。

图1 N基因的PCR扩增Fig.1 PCR amplification of N gene
2.2 PEDV N蛋白的表达、纯化与鉴定
重组质粒pET-N转化进表达宿主菌Transetta(DE3),经IPTG诱导后进行SDS-PAGE分析,重组子pET-N表达产物中出现相对分子质量为58 000的特异目的蛋白条带,与预期大小相符。空载体宿主菌表达产物无特异性条带出现,未经诱导的重组子表达产物中出现微弱的特异性条带(图2)。纯化的N蛋白转膜后,以抗PEDV的抗体染色,发现相对分子质量为58 000的特异性条带(图3)。
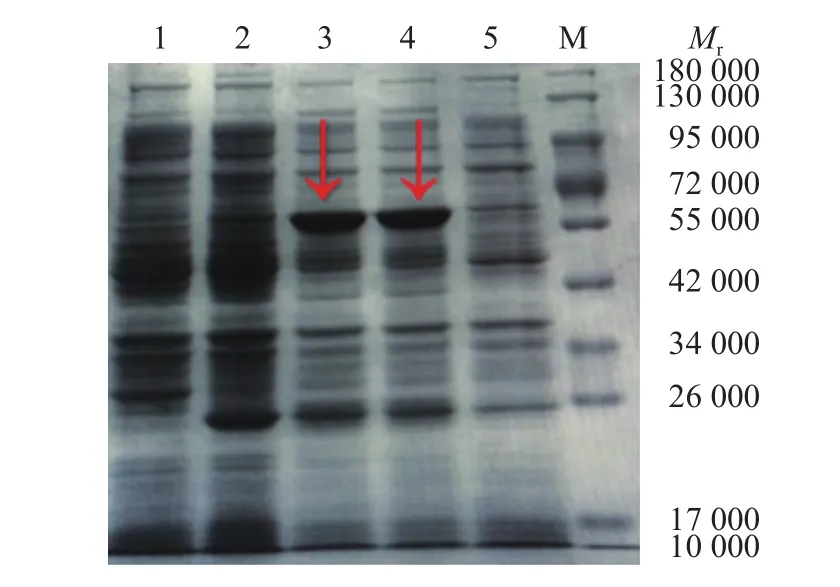
图2 PET-N表达产物的SDS-PAGEFig.2 SDS-PAGE of expressed product PET-N

图3 纯化N蛋白的Western blot检测Fig.3 Western blot detection of purified N protein
pET-N重组子在优化条件下诱导表达后,目的蛋白经重力流Ni柱层析纯化,收集不同浓度咪唑洗脱的蛋白液,用透析膜脱盐处理后进行SDS-PAGE,用考马斯亮蓝染色,脱色液脱色。结果(图4)显示,纯化的蛋白相对分子质量约58 000,且目的蛋白纯度较高,根据结果选用300 mmol/L咪唑洗脱的蛋白,用BCA试剂盒测定蛋白质量浓度为450 μg/mL。
2.3 抗体效价
小鼠经3次免疫后,用间接ELISA测定各组小鼠的抗体效价,其中2~5号小鼠的抗体水平较低,1号、6号小鼠的抗体水平较高,且6号小鼠的ELISA结果较为稳定,结果见图5。后续试验选用6号小鼠进行。
经过2次亚克隆,获得1株分泌特异性单抗的杂交瘤细胞,命名为13。收集杂交瘤细胞上清液,用PBS缓冲液倍比稀释,用间接ELISA检测杂交瘤细胞上清液效价。将杂交瘤细胞上清液稀释3 200倍后仍为阳性,结果见图6。
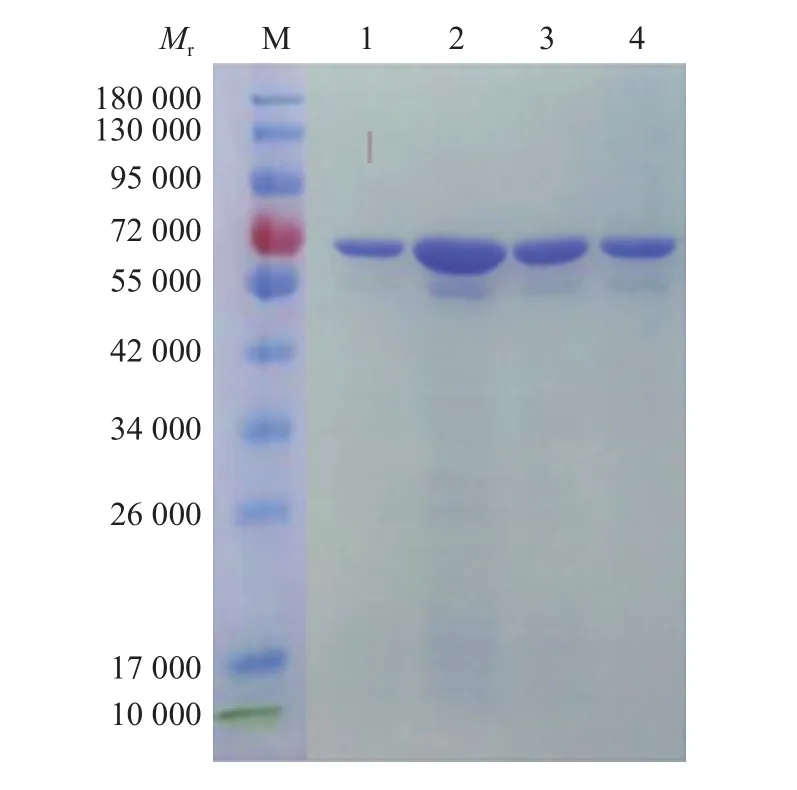
图4 经不同浓度咪唑洗脱的纯化产物的SDS-PAGEFig.4 SDS-PAGE of purified product eluted by different concentrations of imidazole
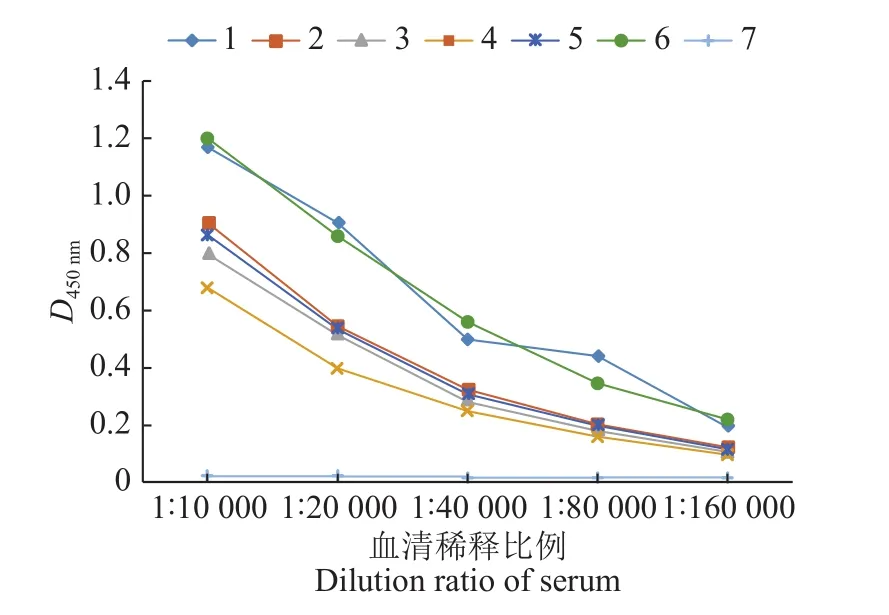
图5 重组PEDV N蛋白免疫小鼠血清中的抗体效价Fig.5 Antibody titer in serum of mice immunized with recombinant PEDV N protein

图6 杂交瘤细胞上清液的抗体效价Fig.6 Antibody titer of hybridoma cell supernatant
将杂交瘤细胞13接种小鼠腹腔制备单克隆抗体。抽取腹水并测定其抗体效价,制备的PEDV N蛋白单克隆抗体用PBS缓冲液经过1 024 000倍稀释后仍为阳性,证明该单抗抗体水平较高,结果见图7。
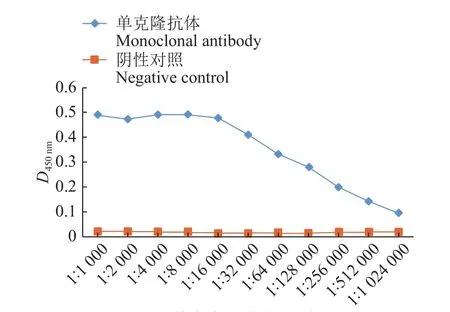
图7 小鼠腹水中单克隆抗体效价Fig.7 Monoclonal antibody titer in mouse ascites
2.4 特异性检测和Western blot 鉴定结果
单克隆抗体的特异性检测结果见表1。以TGEV、PPRV、CSFV、PRRSV和PEDV为抗原包被8 μg/mL的纯化N蛋白,将腹水用PBS缓冲液按体积比1∶10 000稀释作为一抗,采用间接ELISA法进行检测,结果显示,包被不同稀释比例的TGEV、PPRV、CSFV、PRRSV均呈阴性反应,只有PEDV呈阳性,各稀释比例下的D450 nm稳定。
将纯化的N蛋白转到PVDF膜后,用脱脂牛乳溶液在37 ℃条件下封闭3 h,将收集并处理好的小鼠腹水用PBS缓冲液按照体积比1∶5 000稀释作为一抗,4 ℃条件下过夜孵育,HRP−羊抗鼠IgG用PBS 缓冲液按体积比 1∶5 000 稀释作为二抗,37 ℃孵育 1 h。进行 Western blot分析,在相对分子质量为58 000处有明显的特异性条带,结果见图8。
2.5 最适工价浓度
N蛋白单克隆抗体最适工作浓度结果见图9。在已接种PEDV的细胞培养板中,加入用PBS缓冲液倍比稀释的N蛋白单克隆抗体、用PBS缓冲液按体积比1∶100稀释的FITC−羊抗鼠IgG,同时设阴性及空白对照,然后在荧光显微镜下观察。结果显示,阴性血清及空白对照均无肉眼可见的特异性荧光,N蛋白单克隆抗体在稀释比例为1∶1 000时荧光班点最清晰。
在已接种PEDV的细胞培养板中加入用PBS缓冲液倍比稀释的FITC−羊抗鼠IgG和用PBS缓冲液按体积比1∶1 000稀释的N蛋白单抗,同时设样本自发荧光对照及阴性对照,在荧光显微镜下观察。结果显示,样品自发荧光对照及阴性对照均无肉眼可见的特异性荧光,而FITC−羊抗鼠IgG的稀释度在1∶100时荧光斑点最清晰(图10)。

表1 间接ELISA法检测不同稀释比例病毒的抗体特异性Table 1 Detection of antibody specificity of viruses with different dilution ratios by indirect ELISA

图8 单克隆抗体与PEDV N蛋白反应的Western blot鉴定Fig.8 Western blot identification of monoclonal antibodies reacting with PEDV N protein
2.6 N蛋白单克隆抗体孵育时间
N蛋白单克隆抗体4 ℃条件下过夜孵育和37 ℃条件下孵育2 h,均能观察到亮度无明显差别的绿色荧光 (图 11)。

图9 不同稀释度N蛋白单克隆抗体的间接免疫荧光试验结果Fig.9 Indirect immuno-fluorescenece assay results of N protein monoclonal antibodies at different dilution ratios
2.7 间接免疫荧光试验结果
2.7.1 特异性试验 在已接种 TGEV、CSFV、PRRSV、PRV、PEAV、PoRV、PEDV 的细胞培养板中,加入 1∶1 000稀释的 PEDV N 蛋白单抗、1∶100稀释的 FITC–羊抗鼠–IgG,同时设立PEDV阳性对照和正常细胞的阴性对照,然后置于荧光显微镜和激光共聚焦显微镜下观察。结果表明,除接种PEDV的细胞有明显的特异性荧光显色外,接种 TGEV、CSFV、PRRSV、PRV、PEAV、PoRV的细胞均无特异性荧光,说明建立的PEDV间接免疫荧光检测方法具有较强的特异性(图 12)。

图10 不同稀释度FITC-羊抗鼠IgG的间接免疫荧光试验结果Fig.10 Indirect immuno-fluorescenece assay results of FITC–goa–anti–mouse IgG at different dilution ratios
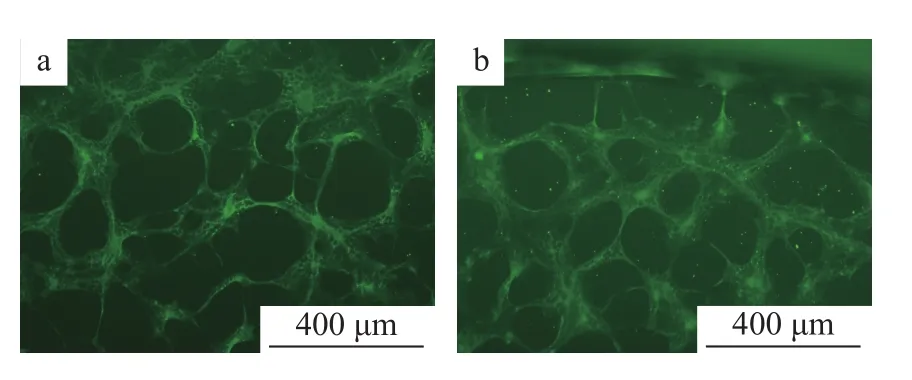
图11 N蛋白单克隆抗体孵育时间的确定Fig.11 Determination of incubation time of N protein monoclonal antibody
2.7.2 重复性试验 取同批次(图 13a、13b)和不同批次(图13c)的Vero细胞接种病毒,采用间接免疫荧光法进行试验,结果显示荧光强度一致,说明重复性好。
2.7.3 敏感性试验 在已接种不同稀释度 PEDV病毒液的细胞培养板中,加入用PBS缓冲液按体积比 1∶1 000稀释的PEDV N蛋白单克隆抗体、用PBS缓冲液按体积比1∶100稀释的FITC−羊抗鼠IgG,同时设正常细胞为空白对照,然后置荧光显微镜下观察,结果表明,将PEDV病毒液稀释到100 000,在荧光显微镜下仍可观察到典型的特异性绿色荧光(图14)。
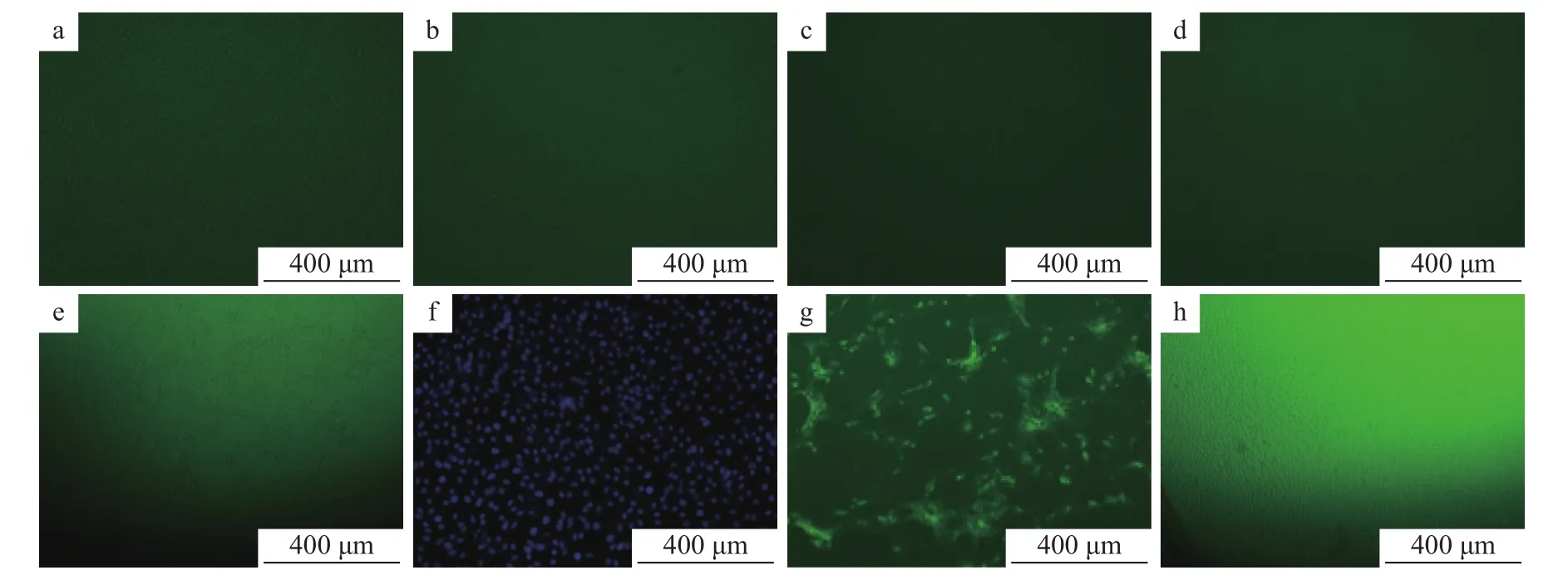
图12 间接免疫荧光特异性试验结果Fig.12 Specific test results of indirect immuno-fluorescenece assay
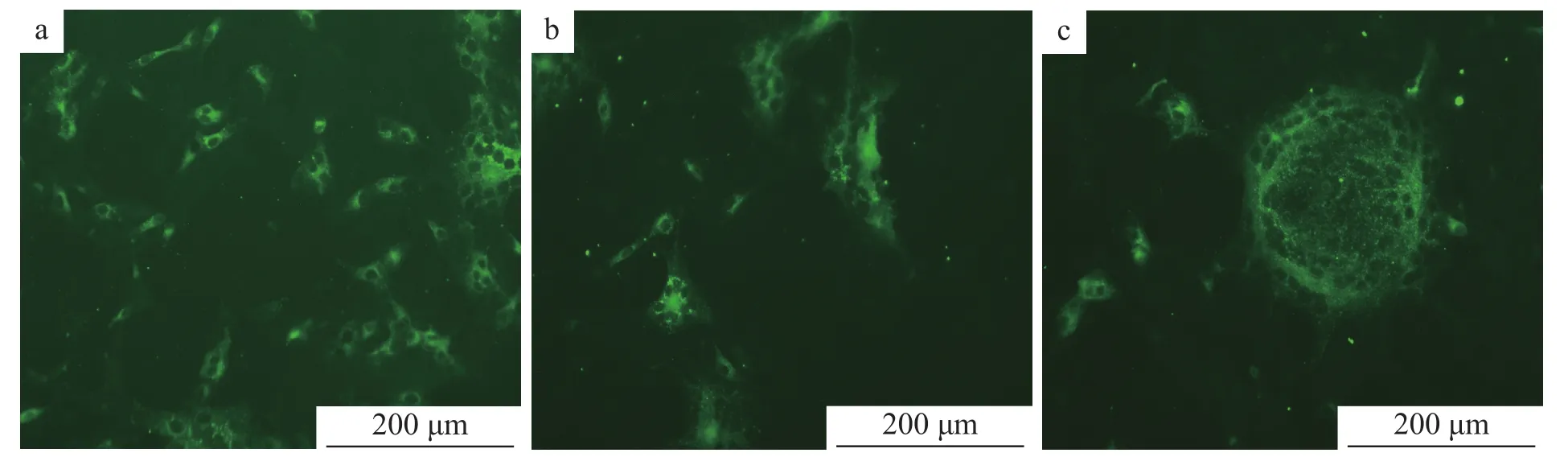
图13 间接免疫荧光试验重复性试验结果Fig.13 Repeatability test results of indirect immuno-fluorescenece assay

图14 间接免疫荧光试验敏感性试验结果Fig.14 Sensitivity test results of indirect immuno-fluorescenece assay
3 讨论与结论
我国养殖业中PEDV感染十分普遍[16],3~10日龄的仔猪最为易感,病死率为80%~100%[17],给我国养猪业造成严重损失[9-10]。在临诊症状和病理变化上,除与猪传染性胃肠炎十分相似外,PED还与PEAV、PoRV、致病性大肠埃希菌引起的病征相似。因此,建立一种PED的实验室诊断方法具有重要实践意义。
本研究利用原核表达系统表达PEDV N蛋白。相比其他表达系统,原核表达系统具有操作简单、价格便宜、表达量大等优点。在单克隆抗体的制备过程中,蛋白的纯度要求高,本研究利用PET-32a(+)载体上自带的HIS标签与Ni柱反应,经考马斯亮蓝染色证明获得了高纯度的目的蛋白,用此蛋白作为免疫原免疫小鼠,小鼠的效价达到1∶80 000以上,证明该目的蛋白具有很好的免疫原性。
PEAV、PoRV、TGEV感染猪只后,临诊症状与PEDV相似,并且TGEV、PoRV接种Vero细胞后产生的细胞病变和PEDV也相似;因此,仅仅依靠临诊症状和细胞病变难以鉴别诊断。本研究建立的免疫荧光试验检测方法经过特异性试验的验证,除了与PEDV有特异性反应可以观察到明显的绿色荧光外,与其他的病原没有交叉反应。
综上所述,本研究利用大肠埃希菌原核表达系统成功构建PET-N重组质粒,表达了PEDV N蛋白,制备了PEDV N单克隆抗体,并利用此抗体建立了检测PEDV的间接免疫荧光试验方法,为PEDV的流行病学调查、临床诊断和疫情控制提供了技术支撑。
