果蝇Catsup基因在卵巢中表达降低对生殖的影响
2020-08-05薛劲松叶佳伟刘腾飞肖桂然
尚 进, 薛劲松, 叶佳伟, 项 玲, 刘腾飞, 肖桂然
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
0 引 言
近年来,我国人口出现生殖能力下降的现象,据报道,中国育龄妇女中不孕不育的比例已占已婚育龄妇女的1/6,而男性的精子合格率平均仅有不到20%。这些有关生殖的异常现象需要引起高度重视,而探究生殖异常的原因和机制对于提高国民生殖能力和人口质量也具有重要的意义。
动物体的生殖能力受很多方面影响,这包括遗传因素和生活环境的影响,关于生殖能力的调控,目前还缺乏有效的手段。本文研究发现,在果蝇中有一个基因Catsup在卵巢中突变后会显著降低雌性果蝇的产蛋量,因此以Catsup为切入点,为探究影响生殖力的遗传因素提供了契机。生物信息学分析显示,Catsup和锌离子转运蛋白 ZIP 家族成员高度同源,其编码的蛋白极可能是一个定位在高尔基体上的转锌蛋白[1]。锌(Zinc)是人体必需的微量元素之一,在人体生长发育、生殖遗传、免疫、内分泌等重要生理过程中起着极其重要的作用[2-3]。有许多研究表明锌与雄性动物的生殖能力有关,有研究发现:锌与精液的质量与密度成正比;缺锌影响精子的代谢与活动力,并影响睾丸的发育;缺锌影响脑垂体功能,促使性腺分泌激素减少,使性腺发育受阻。但对于雌性动物生殖能力与锌的研究较少,了解该问题能为相关疾病的治疗提供新线索。
黑腹果蝇 (Drosophilamelanogaster) 是经典的模式生物之一,其微量元素代谢过程与哺乳动物相比有较高的保守性,哺乳动物许多微量元素代谢相关的蛋白都能在果蝇中找到同源物[4-6]。由于果蝇具有生活周期短、饲养方便、遗传背景清楚、繁殖力强和操作体系成熟等特点,使其作为模式生物用来研究微量元素代谢及生殖具有独特的优势[7-8]。
本研究以果蝇为研究载体,探究基因Catsup表达水平对雌性果蝇生殖能力的影响及其产生影响的原因。
1 材料与方法
1.1 实验材料
GAL4-UAS系统是实现果蝇体内基因特异性敲低的常用手段,该系统由driver(GAL4) 和responder(UAS)2个调控元件组成,分别存在于2种转基因果蝇中,2种果蝇杂交产生的后代同时含有这2种元件,GAL4启动UAS下游基因细胞的组织特异性表达。
本研究所用的GAL4驱动子是C587-GAL4,该果蝇来自Bloomington Drosophila Stock Center,编号67747,它能特异地在果蝇的原卵区(inner germarium sheath,IGS)细胞和帽细胞(cap cell)中表达[9],实验中,利用该驱动子实现卵巢微环境中特异性敲低Catsup基因;研究中所用到的野生型和Catsup-RNAi的果蝇均来源于Vienna Drosophila Research Center(VDRC),编号分别为60000和V100095。
1.2 果蝇饲养条件
果蝇培养基的制备。天平准确称取玉米粉100 g、大豆粉10 g、白糖14.5 g、红糖40 g、酵母25 g、琼脂8 g,蒸馏水1 L搅拌均匀并煮沸。食物冷却至适当温度,加入防腐剂(2%),倒入果蝇培养管,冷却凝固后即可使用。果蝇饲养的温度为25 ℃,湿度65%。
1.3 生殖能力测定
每只果蝇培养管随机放入9~12只处女蝇,3~5 只雄性杂交品系果蝇,在25 ℃下培养,获得子一代成年果蝇。每个基因型收集10组进行平行实验,每组培养管中放入1只果蝇(保证每组果蝇羽化时间相差不大),在温度25 ℃下培养2 d后(保证成蝇性成熟,产蛋稳定),在显微镜下计数产蛋情况并统计产蛋数量。每天将果蝇倒入新的管中连续统计,直到果蝇不再产蛋,将每天统计的产蛋数加和,即得到最终统计数据。
1.4 卵巢形态的观察
将各组果蝇用二氧化碳麻醉,挑选出雌蝇,置于解剖盘内。在解剖盘中加入适量PBS缓冲液,并将之前挑选出的雌蝇放入其中,用剖腹针小心剖开果蝇腹部,往后牵拉出果蝇卵巢,去除果蝇卵巢周边其他组织,得到完整的卵巢。准备载玻片,滴上适量甘油(起到保护作用),将卵巢放到载玻片上,显微镜下观察果蝇卵巢形态、大小变化并拍照。在实验过程中不要破坏果蝇卵巢原来的形态,以免对观察结果造成影响。
1.5 卵巢的结构观察
为了标记卵巢结构,本实验中用到一个果蝇C587-GAL4、UAS-EGFP,这是利用遗传手段将C587-GAL4与UAS-EGFP组合在一起。果蝇有4对同源染色体,利用果蝇减数分裂时的基因重组,将分别带有C587-GAL4和UAS-EGFP的果蝇杂交,通过子代的表型筛选出同时带有C587-GAL4和UAS-EGFP的果蝇。获得的果蝇能够在卵巢IGS细胞和帽细胞中表达绿色荧光。借助于这个果蝇可以观察到卵巢结构。
用C587-GAL4、UAS-EGFP处女蝇分别与野生型和Catsup-RNAi果蝇杂交,获得子一代。子一代果蝇羽化为成虫后,将各组用二氧化碳麻醉,挑选出雌蝇,在PBS缓冲液的环境下剖开果蝇腹部,得到卵巢。将解剖好的卵巢用4%的多聚甲醛固定10 min,随后用PBS缓冲液洗去多聚甲醛,最后处理后的卵巢放在载玻片上,滴上甘油用以缓冲并维持卵巢形态,在激光共聚焦显微镜5倍镜下观察卵巢的绿色荧光情况。
2 结果与分析
2.1 敲低Catsup对果蝇生殖能力的影响
产蛋的数量是恒量雌性果蝇生殖能力的重要指标。在实验过程中发现Catsup敲低后雌性果蝇产蛋量明显降低,统计结果如图1所示,野生型雌果蝇在羽化后大约产蛋330个,而Catsup敲低后果蝇产蛋量显著下降,只有不到100个。这说明Catsup基因所控制的某种机制对雌性果蝇的生殖能力有至关重要的作用。
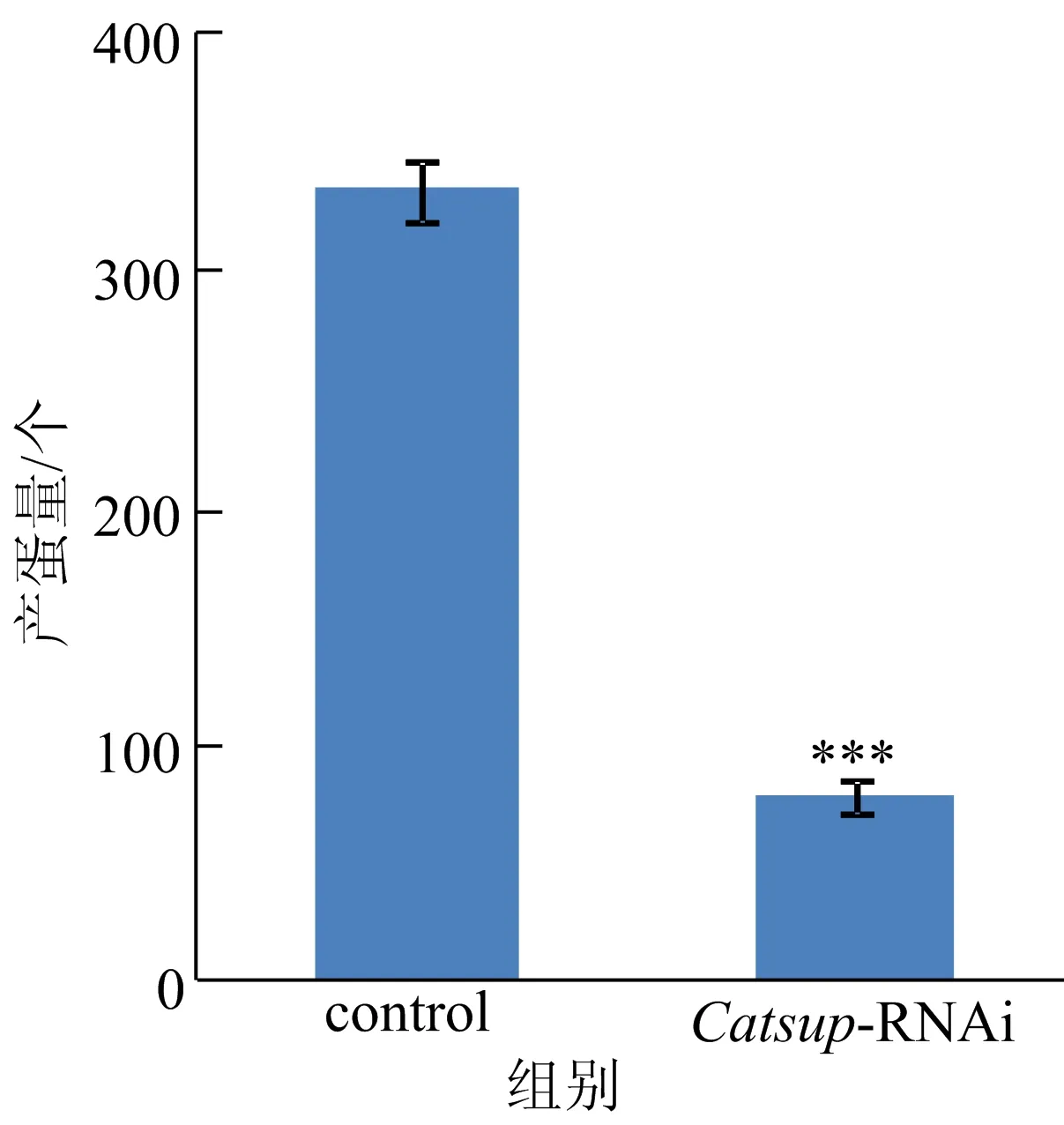
图1 敲低Catsup果蝇与野生型果蝇产蛋情况对比
2.2 敲低Catsup对果蝇卵巢形态的影响
卵巢是雌性果蝇的生殖器官,每只雌果蝇有2个卵巢,每个卵巢由10~20根输卵管构成。果蝇卵巢的尖端部位有2或3个生殖系干细胞,它们通过不对称有丝分裂产生1个新的子干细胞和1个包囊干细胞,包囊干细胞又进行连续4次胞质分裂不完全的有丝分裂,产生16个相互连通的包囊细胞,形成包囊,并被体细胞来源的滤泡细胞所包围,形成卵室。其中1个包囊细胞成为卵母细胞,另外15个包囊细胞则成为营养细胞。由图1可知,Catsup基因敲低的果蝇产蛋数量明显降低,而卵巢是雌果蝇的排卵器官,因此本实验对果蝇的卵巢进行研究。
解剖Catsup-RNAi雌果蝇的卵巢后,发现野生型果蝇的卵巢则比较饱满,而Catsup-RNAi果蝇的卵巢出现严重皱缩的现象,如图2所示,本实验结果显示,Catsup敲低后雌性果蝇的形态严重畸形,可以推测其卵巢的功能也出现损伤。
2.3 Catsup敲低对果蝇卵巢结构的影响
为了进一步探究在果蝇卵巢中敲低Catsup对卵巢的影响,本实验用C587-GAL4、UAS-EGFP来驱动Catsup-RNAi的表达,得到的子代果蝇卵巢部位带有荧光,便于观察卵巢的结构,其结构如图3所示。本研究发现,相比于野生型(control)果蝇,Catsup敲低组卵巢部位的荧光明显变弱,而且突变果蝇卵室变得松散,不如野生型紧凑。荧光变弱的原因可能是niche出现了细胞凋亡或坏死,这也是导致果蝇产蛋数量严重减少的可能原因之一;而卵巢结构松散则可能是Catsup敲低后导致细胞间粘连的蛋白减少。
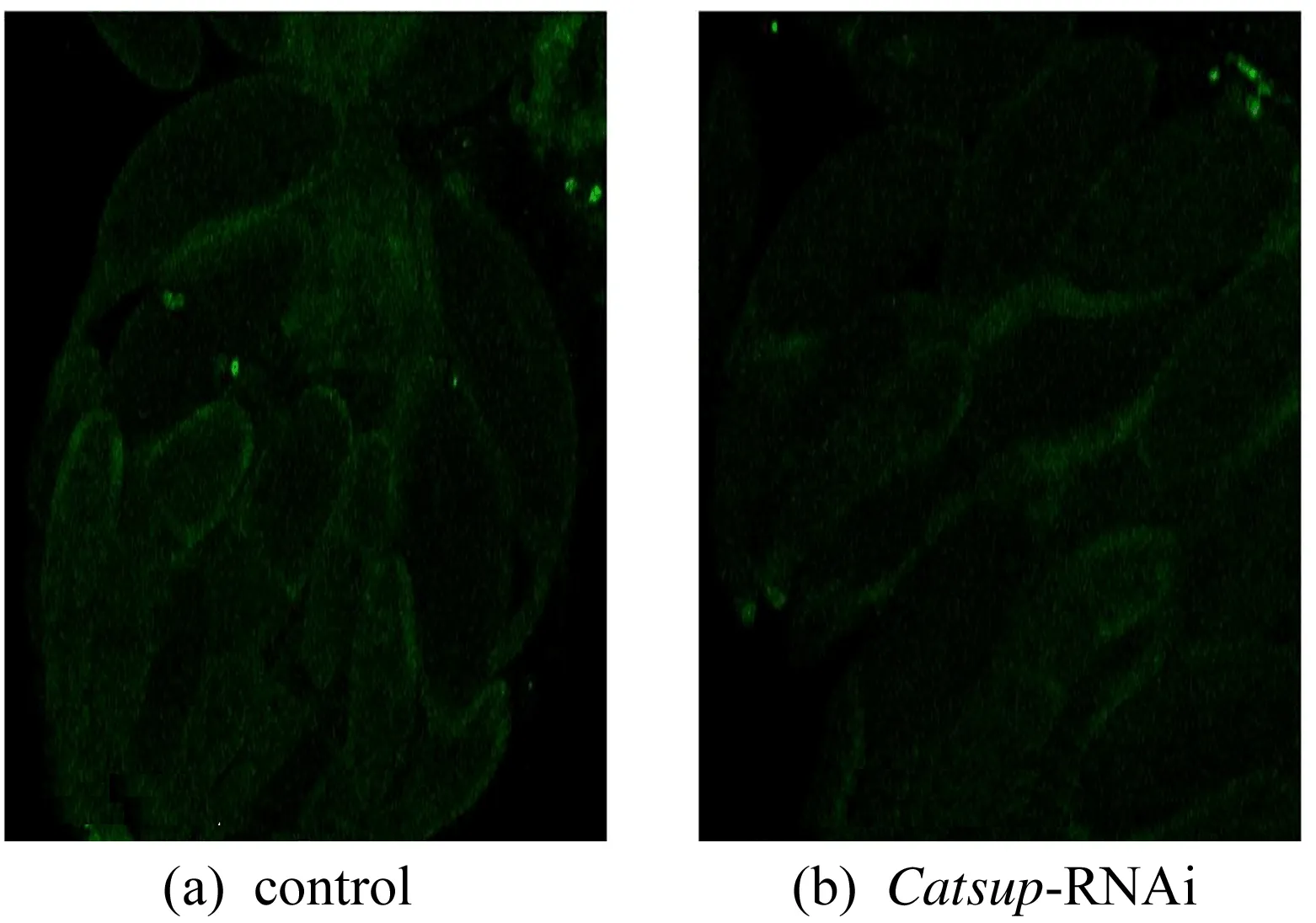
图3 敲低Catsup果蝇卵巢结构观察
3 结 论
本文发现果蝇基因Catsup在卵巢表达量降低后,显著影响果蝇生殖能力,进一步研究发现,果蝇卵巢中Catsup-RNAi后卵巢形态发生很大改变,并且卵巢内部结构、卵室之间的连接已经被破坏。这些结果为进一步研究Catsup影响果蝇生殖能力提供了有力的奠基。
如前文所述,Catsup是果蝇体内的一种锌转运蛋白同源物,因此探究Catsup的分子功能对于解析Catsup引起的生殖障碍的分子机制具有至关重要的作用。众所周知,锌对于发育及代谢具有至关重要的作用[10],影响到体内很多重要基因的转录过程[11]。本研究推测可能Catsup具有锌离子转运功能,表达水平改变会影响到细胞内锌的稳态,进而影响卵巢的发育,从而影响了生殖能力;或者锌水平的紊乱影响到生殖过程所需要的某些重要基因的表达,从而影响了生殖能力。总之,本研究发现Catsup对果蝇的生殖过程产生了重要的影响,该研究为后续探究锌代谢与雌性生殖提供参考价值。
