固定化尿苷-胞苷激酶和聚磷酸激酶偶联催化制备5′-胞苷酸
2020-08-05吴思佳李杰胡晨龙田俊宇张通陈宁范晓光
吴思佳,李杰,胡晨龙,田俊宇,张通,陈宁,范晓光
天津科技大学 生物工程学院,天津 300457
5′-胞苷酸 (简称胞苷酸) 是一种重要的核苷酸产品,可作为食品添加剂、药品以及药物前体应用于不同领域[1]。胞苷酸是制备核苷酸衍生物的重要中间体,可作为原材料生产胞苷三磷酸、阿糖胞苷酸、胞二磷胆碱和聚肌胞苷酸等[2]。胞苷酸在成年人、婴幼儿和哺乳动物的免疫系统中发挥着重要作用[3-5],含有胞苷酸的婴幼儿奶粉功效更接近于母乳,能显著提高婴幼儿免疫力[6-7]。
工业上常用核酸水解法生产胞苷酸,通常是提取酵母细胞中的核糖核酸,经核酸酶水解得到4种核苷单磷酸 (腺苷酸、鸟苷酸、胞苷酸和尿苷酸) 混合物后,再经过离子交换法分离精制得到胞苷酸[8-9]。核酸水解法具有原料来源广泛和反应条件温和的优点,但是生产周期较长、分离精制工序复杂且加工成本较高。化学法生产胞苷酸[10-11],通常是用磷酸或者焦磷酸的活性衍生物与核苷进行磷酸化反应,反应步骤繁琐、所用试剂昂贵且含有毒试剂,因此只适用于小规模生产且产品无法在食品领域中应用。
尿苷-胞苷激酶 (Uridine-cytidine kinase, UCK)是一种嘧啶核糖核苷激酶,广泛存在于微生物、动物体和人体内,是核苷酸代谢补偿途径中一种重要的催化剂[12-15]。UCK可以催化尿苷和胞苷磷酸化成为尿苷酸和胞苷酸[16],但需要NTP作为磷酸供体。已有研究发现大肠杆菌、保加利亚乳杆菌、枯草芽孢杆菌来源的UCK均需要以GTP作为磷酸供体,但由于GTP原料成本过高,难以工业化放大[17-18]。
嗜热栖热菌Thermus thermophilusHB8来源的尿苷-胞苷激酶具有对胞苷的高度专一性,其Km值为72 μmol/L,只能够催化胞苷到胞苷酸的反应[19]。我们对其进行了生物信息学分析发现其蛋白质保守结构域中含有3个ATP结合位点、6个嘧啶碱基特异性位点和3个核糖特异性位点,因此推测其能够以ATP作为磷酸供体完成催化反应。为了降低反应中ATP的消耗量,我们使用类球红细菌Rhodobacter sphaeroides来源的聚磷酸激酶(Polyphosphate kinase, PPK) 以ADP和六偏磷酸钠为底物催化生成ATP[20],从而实现ATP的循环再生。为了增加酶的利用率,我们根据亲和层析的原理,使用D403金属螯合树脂吸附Ni2+形成固定化载体,由于Ni2+能与重组蛋白携带的组氨酸标签进行配位结合[21],因此固定化载体能够选择性地吸附重组蛋白,从而在纯化重组蛋白的同时将其固定于树脂表面。使用上述固定化酶用于胞苷酸的制备,并对反应条件进行了系统优化,为大规模生产胞苷酸提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
大肠杆菌Escherichia coliDH5α、BL21(DE3)以及质粒pET-28a均由本实验室保藏。
1.1.2 培养基
LB (Luria-Bertani) 培养基:蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,pH 7.0–7.2,121 ℃灭菌20 min。
TB (Terrific肉汤) 培养基:蛋白胨10 g/L,酵母提取物5 g/L,甘油4 mL/L,KH2PO42.31 g/L,K2HPO412.54 g/L,pH 7.0–7.2,KH2PO4和K2HPO4与其他成分分开灭菌,121 ℃灭菌20 min。
1.1.3 试剂
限制性内切酶、T4 DNA连接酶、ExTaqDNA聚合酶均购自TaKaRa公司;PCR产物回收及质粒提取试剂盒购自北京博大泰克生物基因有限责任公司;BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司;胞苷标品、CMP标品、ATP购于美国Sigma公司;其他试剂均为国产分析纯。
1.2 UCK蛋白的生物信息学分析
使用ExPASy服务器 (http://web.expasy.org/protparam/) 的ProtParam分析UCK蛋白的理化性质。使用NCBI CD search (http://www.ncbi.nlm.nih.gov/cdd/) 分析UCK蛋白的保守结构域。使用在线程序ProtScale (https://web.expasy.org/protscale/)、TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)和SignalP4.1服务器 (http://www.cbs.dtu.dk/services/SignalP/) 分析UCK蛋白的亲疏水性、跨膜区、信号肽等功能区。
1.3 重组菌株的构建及重组酶的制备
1.3.1 质粒pET-28a-uck的构建
根据UCK蛋白的编码基因序列 (GenBank登录号3168643),对其进行密码子优化,以大肠杆菌常见密码子替换其稀有密码子,使其可在大肠杆菌中高效表达,将优化后的序列送至金唯智公司进行合成,获得携带UCK编码基因的重组质粒pUC57-uck。使用限制性内切酶EcoRⅠ和Hind Ⅲ双酶切pET-28a质粒载体以及pUC57-uck。获得线性化的pET-28a载体和uck基因片段,在T4 DNA连接酶的作用下连接载体与片段,将其转化至E.coliDH5α,再使用质粒提取试剂盒提取质粒,获得pET-28a-uck质粒。
1.3.2 质粒pET-28a-ppk的构建
以Rhodobacter sphaeroides基因组为模板,根据PPK蛋白的编码基因序列 (GenBank登录号3720266,设计带有酶切位点EcoRⅠ和HindⅢ的上下游引物。使用引物及Ex-TaqPCR试剂盒扩增得到聚磷酸激酶编码基因ppk。使用限制性内切酶EcoR Ⅰ和Hind Ⅲ对pET-28a质粒载体以及ppk基因片段进行消化,在T4 DNA连接酶的作用下连接载体与片段,将其转化至E.coliDH5α,再使用质粒提取试剂盒提取质粒,获得pET-28a-ppk质粒。引物序列如表1所示。
1.3.3 重组菌株的构建
取适宜浓度的质粒pET-28a-uck和pET-28appk分别化转至E.coliBL21(DE3) 感受态细胞中,在SOC培养基中活化后涂布于含硫酸卡那霉素(50 μg/mL) 的LB固体培养基上,37 ℃倒置培养12 h。挑取单菌落经菌落PCR筛选出符合要求的阳性克隆菌株,将阳性菌株接入含有硫酸卡那霉素(50 μg /mL) 的LB液体培养基中,经37 ℃振荡培养12 h后,保存至甘油管保菌管中,于-80 ℃冰箱保藏。
1.3.4 重组酶的制备
将重组菌株从甘油保菌管中以1% (V/V) 的接种量接种至5 mL含有硫酸卡那霉素 (50 μg /mL)的LB液体培养基摇管中,于37 ℃、200 r/min活化培养12 h;以1% (V/V) 接种量转接至30 mL含有硫酸卡那霉素 (50 μg /mL)的LB液体培养基的250 mL三角瓶中,37 ℃、200 r/min培养10 h,再按2% (V/V) 接种量转接至100 mL含有硫酸卡那霉素 (50 μg /mL) 的TB液体培养基的500 mL三角瓶中,37 ℃、200 r/min继续培养;培养至OD600达到1.8–2.4时添加终浓度为0.2 mmol/L的异丙基-β-D-硫代半乳糖苷 (IPTG),25 ℃、200 r/min过夜培养诱导表达蛋白。培养结束后,将发酵液于4 ℃、8 000 r/min离心10 min收集菌体。使用PBS缓冲液 (pH 7.4) 或生理盐水重悬清洗菌体细胞2–3次,再用30 mL裂解缓冲液 (50 mmol/L Na2HPO4、300 mmol/L NaCl,用NaOH调pH至8.0) 重悬均匀后,使用高压匀浆细胞破碎仪 (上海永联生物) 破碎细胞,6 ℃、80 MPa破碎5 min,细胞破碎液经13 000 r/min离心20 min后取上清液,即为含有重组酶的粗酶液。
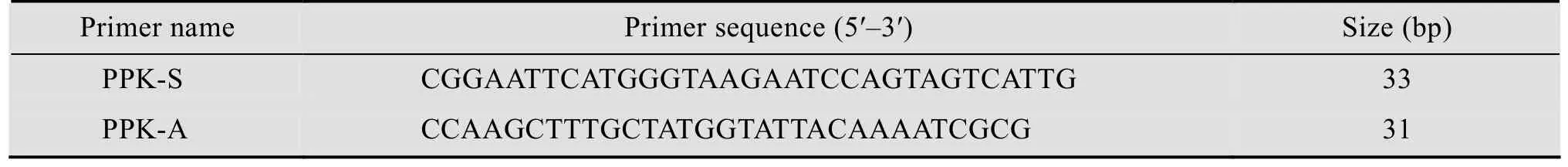
表1 ppk基因扩增引物Table 1 Primers for ppk gene amplification
1.4 固定化载体的制备
1.4.1 树脂活化
取适量D403金属螯合树脂 (江苏苏青),用去离子水冲洗后浸泡20 min,重复5次,清洗干净后填入亲和层析柱。用4% HCl溶液过柱活化树脂直至流出液pH至1–2,静置浸泡6 h,再用去离子水洗至中性。用4% NaOH溶液过柱活化树脂直至流出液pH至13–14,静置浸泡6 h,再用去离子水洗至中性待用。
1.4.2 固定化载体的制备
将100 mmol/L的硫酸镍溶液泵入到层析柱中,流速为1 mL/min,使镍离子吸附在树脂上。流出液可以循环泵入到层析柱中,吸附2 h后用去离子水清洗树脂,即制成镍离子型金属螯合树脂,即固定化载体。
1.4.3 制备固定化酶
取制备好的固定化载体填于2根层析柱中,每根填量20 g,用裂解缓冲液平衡固定化载体。将提前准备好的UCK粗酶液和PPK粗酶液分别泵入到2根层析柱中,流速为1 mL/min。重组蛋白携带的组氨酸标签与镍离子进行配位结合从而特异性吸附在固定化载体上。将流出液循环泵入到层析柱中,循环吸附3次,即制得固定化酶。
1.5 固定化酶催化反应体系
使用50 mmol/L、Tris-HCl缓冲液 (pH 8.0)为溶剂,准确称取不同浓度的胞苷和六偏磷酸钠,40 mmol/L MgSO4·7H2O和0.5 mmol/L ATP充分溶解,加入1% (V/V) 的溴麝香草酚蓝指示剂,用NaOH溶液调节初始pH值后用容量瓶定容至200 mL。
取20 mL配制好的反应液于100 mL三角瓶中,加入固定化UCK的湿树脂6 g、固定化PPK的湿树脂4 g,在200 r/min的恒温水浴摇床中反应6 h,反应过程中根据反应液颜色变化调节pH值保持恒定。
酶活力单位定义:在标准酶活测定条件下,1 min催化底物胞苷生成1 μmol /L胞苷酸所需的酶量定义为一个酶活力单位,即1 U。
1.6 分析检测方法
使用高效液相色谱 (HPLC) 检测反应液中的胞苷和胞苷酸。色谱柱为SepaxHP-C18 (4.6 mm×250 mm,直径5 μm),紫外检测器,检测波长为280 nm,流动相为0.6%磷酸 (用三乙胺调pH 6.6),柱温30 ℃,流速1 mL/min。如图1所示,胞苷的保留时间为20.9 min,胞苷酸的保留时间为17.4 min。按公式1计算胞苷酸的摩尔得率,按公式2计算固定化载体对蛋白的负载量。
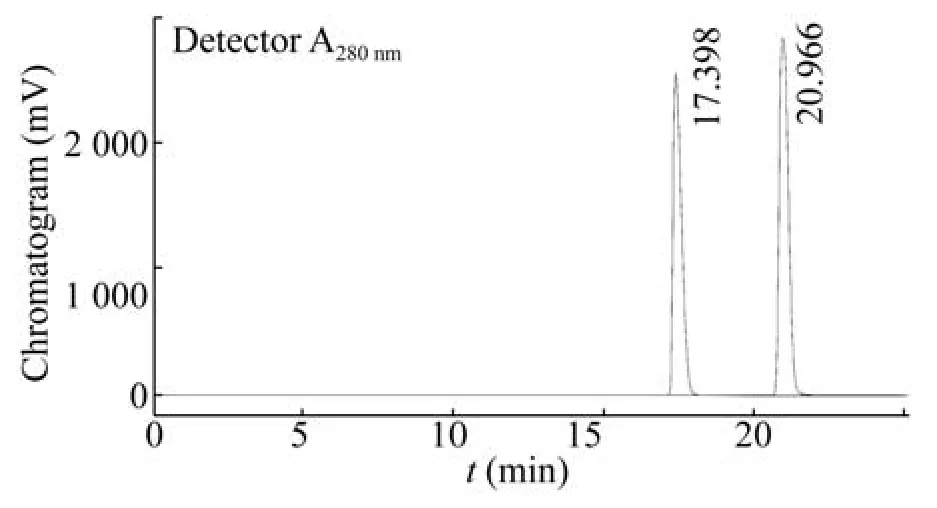
图1 胞苷和胞苷酸标品液相色谱图Fig.1 High performance liquid chromatography of cytidine and CMP standards.

2 结果与分析
2.1 UCK蛋白的生物信息学分析
使用ExPASy Protemics Server提供的在线工具ProtParam对UCK蛋白的理化性质进行分析预测。推测分子式为C1066H1720N302O292S7,相对分子质量26.6 kDa,理论等电点 (pI) 为9.30,负电荷氨基酸残基 (Asp和Glu) 总数为26,正电荷氨基酸残基(Arg和Lys) 总数为30。不稳定指数为47.73 (>40),表明UCK蛋白为不稳定蛋白,亲水性总平均指数为-0.086 (<0),表明UCK蛋白为亲水性蛋白。
利用NCBI CD search分析UCK蛋白质序列保守结构域。UCK蛋白属于NK超家族,PRK05480家族,无多重结构域,含有3个ATP结合位点,6个嘧啶碱基特异性位点和3个核糖特异性位点。SignalP 4.1 server预测UCK蛋白不含信号肽,为非分泌型蛋白。TMHMM server预测该蛋白不含跨膜区,为非跨膜蛋白。ProtScale预测UCK蛋白的亲疏水性,结果表明肽链中的第112位氨基酸疏水性最强,第95位氨基酸亲水性最强,整条肽链中疏水性氨基酸总数少于亲水性氨基酸总数,进一步证明该蛋白为可溶性亲水蛋白。
2.2 UCK蛋白的重组表达及酶学性质初探
为了获得更多的UCK蛋白,我们使用大肠杆菌蛋白表达系统,以pET-28a质粒作为表达载体。根据GenBank中的UCK蛋白编码基因序列,经密码子优化和人工合成后连接到pET-28a质粒上,获得重组质粒pET-28a-uck。对重组质粒进行酶切验证,如图2A所示。以限制性内切酶EcoRⅠ单酶切重组质粒,在6 000 bp左右出现与预期大小一致的条带。以EcoRⅠ和HindⅢ双酶切重组质粒,分别在5 300 bp和700 bp附近出现与空质粒和目的基因大小一致的条带,证明重组质粒构建成功。

图2 UCK蛋白的重组表达验证Fig.2 Recombinant expression validation of protein UCK.(A) Restriction map of the recombinant plasmid.M: DNA marker; 1: EcoRⅠ single enzyme digestion of pET-28a; 2: EcoRⅠ and Hind Ⅲ double enzyme digestion of pET-28a; 3:target gene fragment; 4: EcoRⅠ single enzyme digestion of pET-28a-uck; 5: EcoRⅠ and Hind Ⅲ double enzyme digestion of pET-28a-uck.(B) SDS-PAGE analysis of recombinant proteins.M: protein marker; 1: supernatant samples in the cell lysates of E.coli pET-28a; 2: precipitation samples in the cell lysates of E.coli pET-28a; 3: supernatant samples in the cell lysates of E.coli pET-28a-uck; 4: precipitation in the cell lysates of E.coli pET-28a-uck.
将重组质粒转化至宿主菌E.coliBL21 (DE3)感受态细胞后,接种于含有硫酸卡那霉素的TB培养基中,通过IPTG诱导表达目的蛋白。收集菌体细胞进行高压匀浆破碎,对破碎后的上清液和沉淀分别进行SDS-PAGE分析,结果如图2B所示。上清液在27 kDa附近出现明显的条带,与UCK蛋白的相对分子质量一致,说明该蛋白能够在大肠杆菌中可溶性表达。
为了验证UCK的催化效果,配制催化反应体系,加入总蛋白浓度1.9 mg/mL的UCK粗酶液、30 mmol/L胞苷、30 mmol/L六偏磷酸钠以及30 mmol/L ATP,在pH 8.0、30 ℃的条件下反应6 h,使用HPLC检测发现有胞苷酸的特征峰,说明UCK能够以ATP作为磷酸供体催化胞苷到胞苷酸的反应。
2.3 PPK蛋白的重组表达及酶学性质初探
用于ATP再生的酶主要为激酶,通常这类酶的作用是将ATP或其他核苷酸上的γ-磷酸基团转移至受体分子。该过程的逆反应常被用于将ADP复磷酸化为ATP。激酶是否适用于ATP再生系统的主要影响因素在于成本和稳定性。近年来应用和研究最多的磷酸转移酶是PPK,该酶能够催化γ-磷酸盐从ATP转移到无机多聚磷酸(PolyP) 的可逆反应。由于PolyP低廉的价格,不同微生物来源的PPK在ATP再生反应中有着巨大的潜力[22-23]。
根据GenBank上的PPK蛋白编码基因序列,经基因组扩增后连接到pET-28a质粒上,获得重组质粒pET-28a-ppk。对重组质粒进行酶切验证,如图3A所示。以限制性内切酶EcoRⅠ单酶切重组质粒,在6 300 bp左右出现与预期大小一致的条带。以EcoRⅠ和HindⅢ双酶切重组质粒,分别在5 300 bp和1 000 bp附近出现与空质粒和目的基因大小一致的条带,证明重组质粒构建成功。
将重组质粒转化至宿主菌E.coliBL21 (DE3)感受态细胞后,接种于含有硫酸卡那霉素的TB培养基中,通过IPTG诱导表达目的蛋白。收集菌体细胞进行高压匀浆破碎,对破碎后的上清液和沉淀分别进行SDS-PAGE分析,结果如图3A所示。上清液在44 kDa附近出现明显的条带,与PPK蛋白的相对分子质量一致,说明该蛋白能够在大肠杆菌中可溶性表达。
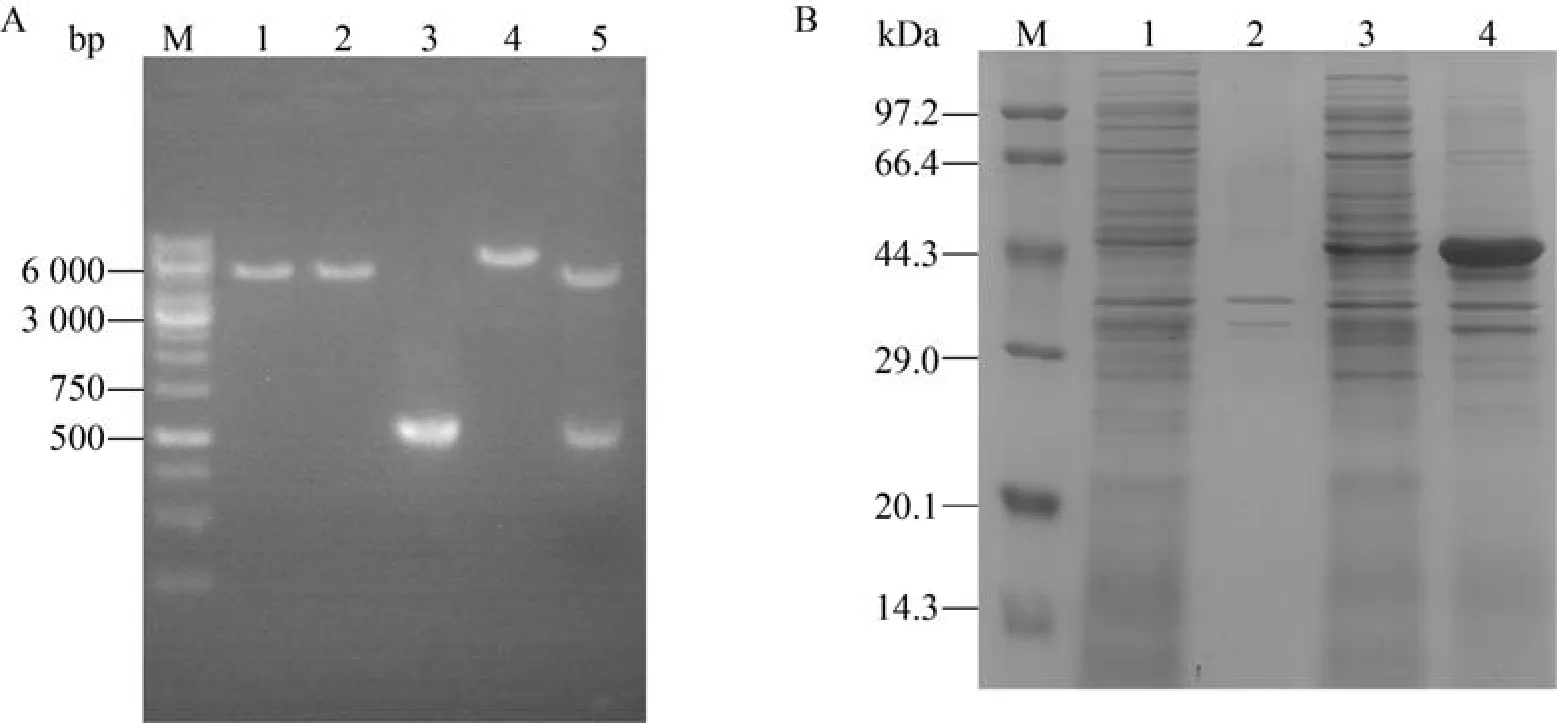
图3 PPK蛋白的重组表达验证Fig.3 Recombinant expression validation of protein PPK.(A) Restriction map of the recombinant plasmid.M: DNA marker; 1: EcoRⅠ single enzyme digestion of pET-28a; 2: EcoRⅠ and Hind Ⅲ double enzyme digestion of pET-28a; 3:target gene fragment; 4: EcoRⅠ single enzyme digestion of pET-28a-ppk; 5: EcoRⅠ and Hind Ⅲ double enzyme digestion of pET-28a-ppk.(B) SDS-PAGE analysis of recombinant proteins.M: protein marker; 1: supernatant samples in the cell lysates of E.coli pET-28a; 2: precipitation samples in the cell lysates of E.coli pET-28a; 3: supernatant samples in the cell lysates of E.coli pET-28a-ppk; 4: precipitation in the cell lysates of E.coli pET-28a-ppk.
为了验证双酶偶联的催化效果,配置催化反应体系,加入总蛋白浓度1.9 mg/mL UCK粗酶液和总蛋白浓度1.3 mg/mL PPK粗酶液,30 mmol/L胞苷、30 mmol/L六偏磷酸钠以及0.5 mmol/L ATP,在pH 8.0、30 ℃的条件下反应6 h,使用HPLC检测发现有胞苷酸的特征峰,说明Rhodobacter sphaeroides来源的PPK能够有效催化ATP的再生反应,显著降低ATP的使用量。
2.4 固定化酶的制备及催化反应条件的优化
2.4.1 固定化酶的制备原理
使用pET-28a质粒表达蛋白时,会在蛋白表面携带6个组氨酸分子组成的标签。由于组氨酸含有的咪唑基团可以提供电子与金属离子进行配位结合,因此含有这些氨基酸残基的蛋白会特异性吸附在含有金属离子的固定化载体上。D403金属螯合树脂是在大孔隙交联结构的聚苯乙烯共聚球体上引入亚胺基二乙酸螯合基团形成的离子交换树脂,可以选择性地交换吸附二价金属离子。如图4所示,使用D403树脂吸附Ni2+形成固定化载体,再用于重组蛋白的特异性吸附,即可实现从粗酶液中原位纯化固定化重组蛋白。将固定化酶用于胞苷酸的催化合成反应,对反应条件进行单因素优化实验。
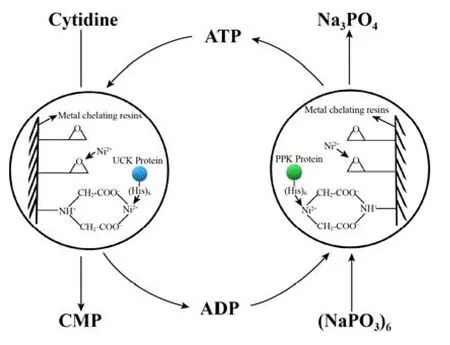
图4 固定化酶催化反应示意图Fig.4 Schematic diagram of catalytic reaction of immobilized enzymes.
根据公式2计算固定化载体对蛋白的负载量,经计算得固定化载体对UCK的负载量为330 μg/g,固定化载体对PPK的负载量为210 μg/g。固定化前后UCK的酶活损失为3%,PPK的酶活损失为5%。
2.4.2 pH值对固定化酶催化反应的影响
按照1.5的方法配制催化反应体系,考察底物胞苷和六偏磷酸钠的加入量分别为30 mmol/L和15 mmol/L,用NaOH调节反应过程中的pH值,考察pH值对固定化酶催化反应的影响。如图5所示,当pH值在 6.0–10.0范围内变化时,产物胞苷酸浓度呈现先升高后降低的趋势,当pH值为8.0时,胞苷酸浓度达到最大,胞苷到胞苷酸的摩尔得率为96%。结果表明,碱性条件下两种固定化酶的催化活力明显高于酸性条件。
2.4.3 温度对固定化酶催化反应的影响
按照1.5的方法配制催化反应体系,底物胞苷和六偏磷酸钠的加入量分别为30 mmol/L和15 mmol/L,调节不同的反应温度,考察温度对固定化酶催化反应的影响。如图6所示,当温度在25–37 ℃范围内变化时,产物胞苷酸浓度呈现先升高后降低的趋势,当温度为30 ℃时,胞苷酸浓度达到最大,胞苷到胞苷酸的摩尔得率为95%。虽然UCK来源于Thermus thermophilusHB8,可以在高温下保持酶的活力,但反应中另一种酶PPK来源于Rhodobacter sphaeroides,当温度超过30 ℃时,该酶的催化活力会有所下降,从而导致固定化酶催化反应效率的降低。

图5 pH值对固定化酶催化反应的影响Fig.5 Effect of pH value on the catalytic reaction of immobilized enzymes.

图6 温度对固定化酶催化反应的影响Fig.6 Effect of temperature on the catalytic reaction of immobilized enzymes.
2.4.4 底物浓度对固定化酶催化反应的影响
按照1.5的方法配制催化反应体系,考察底物胞苷和六偏磷酸钠的加入量对固定化酶催化反应的影响。如表2所示,考察底物胞苷浓度在30–150 mmol/L范围内固定化酶的催化效率。从表中可以看出当底物胞苷浓度在30–60 mmol/L之间时,胞苷酸的摩尔得率维持在96%的水平,当底物胞苷浓度超过60 mmol/L时,固定化酶催化反应的产物摩尔得率逐渐下降。此外,提升六偏磷酸钠的浓度对固定化酶催化反应影响不大。
2.5 利用固定化酶多批次催化制备胞苷酸
使用优化后的反应条件,进行多批次催化反应制备胞苷酸。如表3所示,随着反应次数的增多,固定化酶的催化反应效率逐渐降低。前5批次反应胞苷酸的摩尔得率能够维持在80%以上,平均摩尔得率为91.2%,第6批次反应胞苷酸的摩尔得率降至52%。通过BCA蛋白浓度测定试剂盒检测反应液中游离蛋白的浓度变化发现,在反应过程中,部分重组酶会从固定化载体上脱落,从而导致固定化载体上的载酶量逐渐下降。这一方面是由于反应过程中其他离子会竞争性地替换Ni2+,另一方面则是由于反应过程中树脂之间或树脂与瓶壁之间的摩擦引起的固定化载体破碎。

表2 底物浓度对固定化酶催化反应的影响Table 2 Effect of substrate concentration on the catalytic reaction of immobilized enzymes

表3 利用固定化酶多批次催化反应制备胞苷酸Table 3 Production of CMP by multiple batch reaction using immobilized enzymes
3 结论
胞苷酸是一种重要的核苷酸产品,可作为食品添加剂、药品以及药物前体应用于不同领域。现有的胞苷酸生产方法主要包括核酸水解法和化学合成法,但生产过程繁琐且非环境友好。酶催化法具有反应条件温和、底物特异性强的优势,已逐步取代传统方法用于胞苷酸的制备。已有研究表明,核苷酸代谢补偿途径中存在的UCK可以催化尿苷和胞苷磷酸化成为尿苷酸和胞苷酸,但反应过程需要NTP作为磷酸供体。Qian等[17-18]研究发现,大肠杆菌和保加利亚乳杆菌来源的UCK催化胞苷酸合成时需要使用GTP作为磷酸供体,为了降低GTP的使用量,可以使用乙酸激酶催化乙酰磷酸和GDP生成GTP。使用上述体系反应6 h可以催化30 mmol/L的胞苷和0.5 mmol/L的GTP生成29.1 mmol/L的胞苷酸,摩尔转化率达到97%。但上述偶联反应中用于GTP再生的乙酰磷酸属于极易分解的化合物,难以长时间贮存且使用量大 (与胞苷的摩尔比为1.5∶1),严重影响大规模生产的稳定性。
本研究使用Thermus thermophilusHB8来源的UCK用于胞苷酸的催化合成,证实了该酶可以以ATP作为磷酸供体,与GTP相比更为廉价。使用Rhodobacter sphaeroides来源的PPK催化六偏磷酸钠和ADP生成ATP,证实了该酶可以高效保障偶联反应中ATP的循环再生。六偏磷酸钠是常见的磷酸盐,稳定性强且使用量较少 (与胞苷的摩尔比为0.5∶1)。
为了增加酶的重复利用率,本研究利用亲和层析的原理,使用Ni2+活化的金属螯合树脂为固定化载体特异性吸附重组蛋白,在纯化重组蛋白的同时实现了固定化,与常规的海藻酸钙包埋法相比,操作更为简单且固定化酶的比活力更高。在优化的反应条件下,使用固定化酶以60 mmol/L胞苷和0.5 mmol/L ATP为底物,可实现5批次的高效连续催化反应,胞苷酸平均摩尔得率达到91.2%。为了进一步提高固定化酶的使用率,后期可以选择其他类别的金属螯合树脂或者金属离子,也可以调整重组蛋白上携带的标签数量,提升固定化载体与重组蛋白结合的牢固程度。与现有技术相比,本研究开发的固定化酶制备胞苷酸的方法具有反应成本低、操作性强、反应周期短、环境友好等特点,具有较好的工业应用潜质。
