基因编辑动物模型在人类疾病研究中的应用
2020-08-05马宝霞沈文璐王旭李泽徐坤
马宝霞,沈文璐,王旭,李泽,徐坤
西北农林科技大学 动物科技学院,陕西 杨凌 712100
随着ZFNs、TALENs和CRISPR/Cas等特异性人工核酸酶技术的发展,基因编辑从早期的基因打靶逐渐发展为以特异性核酸酶为基础的完善的基因编辑技术体系。目前广泛应用的主要是基于CRISPR/Cas9系统的基因编辑技术[1],通过这些技术可以实现高效的基因敲除 (Knock-out,KO)、敲入 (Knock-in,KI)、精确的点编辑 (Point editing,PE) 以及单碱基编辑 (Base editing,BE)。早期的基因打靶通过打靶载体与胚胎干细胞 (Embryonic stem cell,ES) 中目标基因位点的自发同源重组实现外源基因的敲入,然后把成功打靶的ES细胞移植回囊胚,通过胚胎移植制备转基因动物。该技术存在着效率低、周期长、费用高以及嵌合体等缺点。随后人们发现,通过大型核酶在目标基因位点引入DNA双链断裂后,能够大大提高打靶载体的重组效率,进而有效提高基因打靶的效率。为了能够定制特异性识别基因组DNA靶序列的核酸内切酶,人们相继开发了基于锌指蛋白 (ZFP)和转录激活因子样效应物 (TALE) 的ZFNs技术和TALENs技术。这两种技术分别通过ZFP和TALE重复单元识别目标基因靶序列,由与之融合的核酸内切酶FokⅠ结构域进行DNA定点切割,进而通过基因组DNA的自发或诱导修复实现基因编辑[2-3]。但是,ZFNs和TALENs核酸酶的构建过程繁琐且活性并不能得到有效保证。CRISPR/Cas9技术由负责靶向的导向RNA (sgRNA或gRNA) 和负责切割的Cas9核酸酶组成,相比于传统的ZFNs和TALENs技术更为简单,只需要针对特定靶序列设计构建相应sgRNA,便能实现高效的DNA切割,进而介导有效的基因编辑。除了CRISPR/Cas9系统,广泛应用于基因编辑的CRISPR/Cas系统还 有CRISPR/Cas12a和CRISPR/Cas12b[4]。CRISPR/Cas技术由于操作简便、成本低和效率高等优点,受到了科研工作者们的广泛青睐,但同时也存在着脱靶效应的问题。Base editor (BE) 技术是在CRISPR/Cas9的基础上发展出来的单碱基编辑技术,能够在不引入DNA双链断裂的情况下实现单个碱基的定点突变,分为能够实现C>T突变的CBE技术和A>G突变的ABE技术。
理论上,早期广义的基因编辑技术包括转基因技术。不过,近年来转基因技术特指将外源基因转入到受体生物中的技术,而狭义基因编辑则相对地特指转基因之外的对生物体基因组目标基因的特定修饰。得益于基因编辑技术的发展,人类疾病基因编辑动物模型的广泛应用极大地推动了人类疾病的相关研究。目前,应用于人类疾病研究的基因编辑动物模型主要有小鼠、大鼠和猪等,相关的制备方法主要有原核注射法和体细胞克隆法。本文将简要介绍基因编辑动物模型 (包括转基因动物模型) 在神经退行性疾病、肥厚心肌病、癌症、免疫缺陷类疾病和代谢性疾病等5种人类疾病研究中的应用情况,以期为以后的相关研究及动物模型制备提供借鉴。
1 神经退行性疾病相关基因编辑动物模型
神经退行性疾病以脑功能的逐渐丧失为特征,主要表现为认知障碍、感觉缺失、记忆和运动能力丧失等,包括阿尔兹海默症 (Alzheimer's disease,AD)、亨廷顿病 (Huntington's disease,HD)、帕金森症 (Parkinson's disease,PD)、肌萎缩侧索硬化症 (Amyotrophic lateral sclerosis,ALS) 等,影响着全世界数以百万计人的生活。目前,这些神经退行性疾病的病理机制尚不清楚,暂无有效的治疗措施。研究工作者们相继对多种动物进行基因组改造,制备了鼠、猪、羊和灵长类等动物模型[5],为神经退行性疾病的深入研究奠定了基础。
1.1 AD基因编辑动物模型
AD是最常见的神经退行性疾病,病因迄今未明。研究表明该病的神经病理标志是β-淀粉样蛋白沉积形成的细胞外老年斑和Tau蛋白过度磷酸化形成的神经细胞内神经原纤维缠结,以及神经元丢失伴胶质细胞增生等。这些病变最终使人逐渐丧失认知功能,导致痴呆[6-8]。
目前,研究工作者们已开发了100多个AD相关基因工程小鼠品系,但只有少数被广泛应用,主要有淀粉样斑块沉积、血管淀粉样沉积和Tau病理学的转基因鼠模型[9]。然而,小鼠模型不能表现出神经原纤维缠结或神经元丢失等病症,不适合用于AD相关研究[10-11]。猪在生理学等方面与人类具有相似之处,早在2009年,Kragh等[12]利用手工克隆技术得到了7只Göttingen小型猪模型,发现Aβ肽在大脑中的积累可能在1–2岁时发生。Jakobsen等[11]也得到了携带人类基因的双转基因Gttingen小型猪(PSEN1M146I和APPsw转基因)。用Aβ42特异性抗体免疫组织化学染色,检测到10月龄和18月龄猪脑组织中Aβ42在神经元内有所积累,推测是AD的发病前兆。这些转基因猪模型表现出了一定的AD症状,有效促进了早期AD研究,但是目前尚未建立一种具有代表性的猪或其他动物完全疾病模型。
1.2 HD基因编辑动物模型
HD是一种常染色体显性遗传的神经退行性疾病,由编码亨廷顿蛋白 (Huntingtin,HTT) 的基因突变引起。亨廷顿基因的第1外显子CAG重复序列异常扩增,使得编码的突变HTT含有超长多聚谷氨酰胺 (Polyglutamine,Poly Q),突变HTT错误折叠,产生细胞毒性,最终导致人的认知、精神和运动功能障碍,同时伴有体重减轻和肌肉萎缩等症状[13-15]。
为了进一步探索如何有效治疗HD,学者们相继开发了各种动物模型,并在此基础上进行了大量研究。2017年,Su等[16]利用CRISPR/Cas9技术,设计了4种gRNA对HD140Q-Ki小鼠的Poly Q进行敲除,有效改善了HD小鼠模型的神经毒性,并指出非等位基因特异性CRISPR/Cas9介导的基因编辑可以有效、永久地消除成人大脑内多谷氨酰胺扩张介导的神经元毒性。2018年,Yan等[17]利用体细胞核移植 (SCNT) 和CRISPR/Cas9技术,将150个CAG重复序列插入猪成纤维细胞的HTT基因中,成功建立了一种内源性表达全长突变体HTT的HD猪模型 (图1),具有明显的神经变性,可作为治疗该病的理想模型。这是世界上首次建立的模拟HD的大型哺乳动物模型,该研究也强调了利用大型哺乳动物研究神经退行性疾病的发病机制及其治疗方法的重要性。
1.3 PD基因编辑动物模型
PD是一种常见的运动性疾病,常发于中老年期,其病理特征是黑质纹状体通路中多巴胺能神经元的变性缺失,从而引起肌肉僵硬、运动迟缓和静止性震颤等症状[18]。
早在2009年就有学者提出慢性MPTPp方案可用于研究PD的慢性病理过程和神经保护策略,是一种渐进的PD小鼠模型[19],但小鼠模型不能完全模仿PD的症状,相对来说,MPTP猴模型更能明显准确地模仿PD的运动状态[20]。2015年,Zhou等[21]应用CRISPR/Cas9系统与SCNT相结合的方法有效获得了PARK2与PINK1双基因靶向敲除猪 (图2)。经过免疫荧光分析,发现Parkin蛋白和PINK 1在该基因编辑猪的神经元中无法表达,而且PD的典型症状并未在7月龄活突变猪身上观察到,这与人类神经退行性疾病随着年龄增长愈渐明显的病程相似,因此是很好的PD研究模型。同年,van Kampen等[22]建立了PD大鼠模型,为PD的治疗研究作出了一定贡献。

图1 利用CRISPR-Cas9技术建立的HD基因编辑 (敲入) 猪模型[17]Fig.1 HD gene edited (KI) pig model established by CRISPR-Cas9 technique[17].

图2 利用CRISPR-Cas9技术建立的PD基因编辑 (敲除) 猪模型[21]Fig.2 PD gene edited (KO) pig model established by CRISPR-Cas9 technique[21].
1.4 ALS基因编辑动物模型
ALS是一种致死性神经退行性疾病,通过选择性侵犯运动皮层、脑干和脊髓运动神经元来控制肌肉活动[23],临床表现为肌张力丧失、瘫痪、肌肉萎缩和痉挛,最终导致瘫痪和死亡[24-26]。大多数患者表现为发散性ALS,5%–10%的患者表现为家族性ALS,家族性ALS可由至少32个已知基因位点中的一个突变引起,包括超氧化物歧化酶1(SOD1)、TRA DNA结合蛋白43 (TDP-43)、肉瘤融合蛋白 (FUS) 和C9ORF72[27-30]。
Flis等[31]使用了人SOD1基因G93A突变体的转基因雄性小鼠研究了游泳训练对ALS小鼠骨骼肌能量代谢及握力下降的调节作用。结果表明游泳训练对ALS小鼠骨骼肌能量代谢有调节作用,同时也能改善骨骼肌功能。Morrice等[32]在文章中指出,TDP43-Q331K转基因小鼠模型在朊病毒蛋白基因启动子驱动下,在10个月龄时能表现出进行性运动功能障碍、肌肉萎缩、运动神经元变性等许多类似ALS的症状,但这种表现在20个月内就停止,并且小鼠不会死亡。该模型无法进一步对ALS的治疗方法进行研究,因此,更有效的动物模型尚有待建立。
2 肥厚型心肌病HCM的基因编辑动物模型
肥厚型心肌病 (Hypertrophic cardiomyopathy,HCM) 是由编码肉瘤相关蛋白的基因突变导致的一种常染色体显性遗传的心肌细胞疾病,主要表现为心肌细胞紊乱、间质纤维化和左心室肥厚等,且60%的HCM患者具有明显的家族性疾病[33]。早期研究发现,MYH7和MYBPC3基因是编码肉瘤相关蛋白的常见基因,相关基因还包括TNNT2、TPM1、ACTC1、MYL2等[33]。
2017年,Marian等[33]利用同源重组和体细胞克隆的方法,将R403Q突变敲入猪的MYH7基因中,获得基因突变的杂合小型猪模型。该模型猪在3个月时表现出HCM的轻微症状,血清肌钙蛋白Ⅰ升高,心肌纤维和心脏收缩能力增强,间质纤维化和肌细胞紊乱,到1岁时,22头R403Q猪中有11头死于心脏性猝死,而所有的野生型猪都存活了下来。因此,该模型的建立对研究新的HCM治疗方法具有重要意义。此外,Montag等[34]利用TALENs技术,将引起HCM的相关突变点R723G引入猪成纤维细胞的MYH7基因中,成功地克隆出了具有R723G突变的MYH7基因的杂合猪,建立了人类心血管疾病基因编辑猪模型 (图3)。新生猪表现出轻微的HCM的特征,包括轻度肌细胞混乱、畸形核和MYH7过度表达。上述基因编辑猪模型为研究人类心脏疾病的致病机制和长期发展提供了重要的材料。
3 癌症基因编辑动物模型
3.1 肺癌基因编辑动物模型
2017年,Wang等[35]利用TALENs和SCNT建立了在Cre酶诱导下表达Cas9的基因编辑猪,成功诱导了猪肺癌相关的5个抑癌基因 (TP 53、PTEN、APC、BRCA 1和BRCA 2) 以及一个原癌基因 (KRAS) 的突变,率先在体内利用基因组编辑技术建立原发性肺癌大动物模型。该基因编辑猪的建立,极大地促进与癌症相关基因的体内功能研究。
3.2 慢性淋巴细胞白血病基因编辑动物模型
慢性淋巴细胞白血病 (CLL) 是一种具有成熟表型的B细胞恶性肿瘤疾病。T细胞白血病-1癌基因 (TCL 1) 是一种AKT共激活因子,是成熟T细胞白血病的病因,在几乎所有CLL患者中都有高表达。转基因小鼠具有独特的免疫表型和类似人类B-CLL过程的白血病,已被广泛应用。
Simonetti等[36]对多种CLL转基因小鼠模型进行研究,确定了Eμ-TCL 1转基因小鼠TCL 1-TG在免疫表型、BCR储备和病程等方面与侵袭型人CLL最为相似。TCL 1过表达具有100%的疾病外显率,因此对阐明CLL的致病机制具有重要意义。白血病细胞TCL 1-TG供体可通过腹腔内或静脉内注射移植到同基因野生型或免疫缺陷小鼠 (如SCID) 中,以加速疾病的发展,并产生一个基因同源的白血病小鼠群体,从而可以系统地研究新的治疗方法,而无需等待其在非移植动物中的自然进程。TCL 1-TG小鼠模型已被广泛研究,与人的U-CLL具有高度相似性[37]。
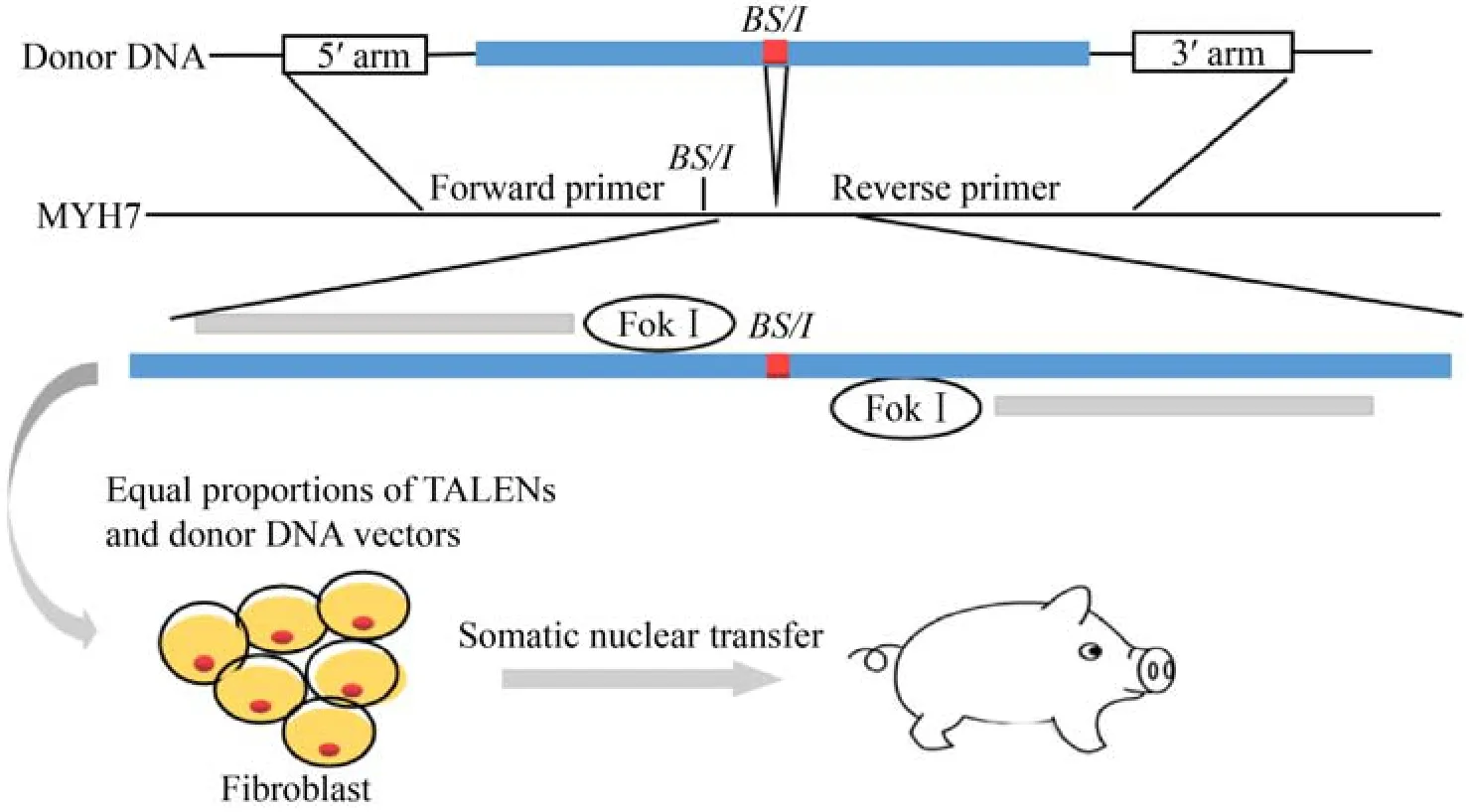
图3 利用TALENs技术建立的HCM基因编辑 (点编辑) 猪模型[34]Fig.3 HCM gene edited (PE) pig model established by the TALENs technique[34].
4 免疫缺陷类疾病基因编辑动物模型
4.1 重症联合免疫缺陷疾病基因编辑动物模型
重症联合免疫缺陷疾病 (Severe combined immunodeficiency,SCID) 是一种体液免疫和细胞免疫均有严重缺陷的疾病,以T细胞免疫缺陷更为突出。动物体内X染色体上的白细胞介素-2受体共同γ链基因 (IL-2RG) 编码的受体蛋白对NK细胞的发育起着至关重要的作用[38],因此IL-2RG缺陷将导致NK细胞活性降低甚至丧失,从而导致SCID的发生。
2013年,Watanabe等[39]向猪的成纤维细胞中导入ZFN表达载体后,靶向敲除了细胞的IL2RG基因,通过SCNT得到的IL2RG-KO猪,经检测,该猪表现出的症状与人类SCID相似。随后,Lee等[40]利用TALEN系统靶向修饰了猪体细胞的RAG2,经SCNT、诱导多能干细胞移植后,RAG2基因修饰猪发育成熟为三胚层畸胎瘤,这说明此RAG2-KO猪具有免疫缺陷的表型,是一种成功的SCID动物模型。Huang等[41]利用TALEN和SCNT技术成功克隆出RAG1/2双敲猪,这种仔猪主要表现为免疫器官发育不良,成熟的B、T淋巴细胞大量减少而且淋巴细胞V (D) J基因片段重排消失,是明显的SCID特征。2016年,Suzuki等[42]用基因靶向成纤维细胞核移植的方法制备出了IL2RG和RAG 2双基因敲除猪,表现为混合表型更严重的IL2RG或RAG 2消融,与IL2RG和RAG 2单基因敲除猪相比,前者可作为异种移植研究的良好平台。
4.2 获得性免疫缺陷综合征基因编辑动物模型
获得性免疫缺陷综合征 (Acqired immre deficiency syndrome,AIDS) 病毒是一种逆转录RNA病毒,被定名为人类免疫缺陷病毒 (HIV),主要攻击并大量破坏人体免疫系统中最重要的CD4+T淋巴细胞,使得机体细胞免疫功能显著降低,最终导致机体感染病原体的机会增加或产生恶性肿瘤而死亡。ZFN、CRISPR/Cas9等基因编辑技术可能从多个HIV储存库中清除或破坏HIV整合基因组或HIV感染细胞,这为将来完全治愈AIDS提供了技术支持[43]。
Karpinski等[44]使用SILPE进化出一种新的重组酶 (Brec1),该重组酶位点能特异性地识别长末端重复序列 (LTRs) 中存在的34 bp序列,有效而精确地去除整合的HIV-1原病毒,并被发现对许多临床HIV-1分离物及用病人来源的细胞培养的小鼠都有效。Holt等[45-46]设计以17%的频率破坏人CD 34+造血干/祖细胞中的CCR5 (HIV-1感染所需的受体),用ZFN处理细胞移植免疫缺陷小鼠,产生了稳定破坏CCR5的多系后代。接受未处理细胞和CCR5病毒攻击的对照组小鼠表现出严重的CD4+T细胞丢失,而用ZFN修饰细胞移植的小鼠则接受快速选择CCR 5[47]。Yuan等[48]还发现在HIV-1感染的NSG小鼠体内植入ZFN修饰的CXCR 4 CD4+T细胞,对利用CXCR 4进行组织培养的HIV-1具有抵抗力。除ZFN外,CRISPR/Cas9也可有效破坏HIV-1感染所需的细胞基因和整合的HIV-1前病毒DNA[43],表达Cas9的重组腺相关病毒9个载体和多重gRNAs对动物整合的HIV-1 DNA的切割有影响,可切除小鼠脾、肝、心、肺、肾和循环淋巴细胞中大量必需的前病毒DNA片段[49]。
5 代谢性疾病基因编辑动物模型
5.1 家族性高胆固醇血症基因编辑动物模型
家族性高胆固醇血症 (Familial hypercholesterolemia,FH) 是一种造成人体脂代谢紊乱的遗传性疾病,突变的低密度脂蛋白受体会引发低密度脂蛋白胆固醇 (LDL-C)、黄瘤和严重的动脉粥样硬化性血管等临床症状[50]。利用TALEN打靶技术、CRISPR/Cas9进行基因组编辑可以建立新的代谢性疾病模型。
2012年,Carlson等[51]通过TALEN打靶技术敲除了猪成纤维细胞基因组的LDLR,经SCNT后得到了含有LDL受体基因单核和双等位基因突变的微型猪,可作为家族性高胆固醇血症的模型,这对模拟人类FH等脂代谢综合疾病具有非常重要的生物医学价值。2017年,Huang等[52]利用CRISPR/Cas9系统对猪胚胎成纤维细胞进行编辑,并经SCNT后得到ApoE–/–和LDLR–/–双基因敲除猪,该研究首次获得脂代谢紊乱的基因修饰猪模型。同年,Jarrett等[53]介绍了以肝脏为导向的体细胞基因组编辑作为代谢紊乱模型的一种方法,用AAV-CRISPR载体破坏小鼠Ldlr基因,使其在肝脏中发展为严重的高胆固醇血症以及系统性代谢表型——动脉粥样硬化,以上模型均为研究代谢性疾病机理和治疗手段创造了重要的平台。
5.2 糖尿病基因编辑动物模型
糖尿病是一种终生代谢性疾病,严重威胁人类健康。大鼠和小鼠动物模型越来越多地被用来阐明类型1和类型2糖尿病机制以及识别和提炼新的治疗方法。
2015年,马元武等[54]用CRISPR/Cas9技术成功制备出了胰岛素受体底物1 (Irs 1) 和瘦素受体(Lepr) 基因敲除大鼠 (图4),并伴随着肥胖、血脂异常、轻度血糖升高等症状。Claussnitzer等[55]也用此技术对风险基因携带者与其前体脂肪细胞同时进行基因编辑,发现了一个关键核苷酸对Fto(与肥胖症关联最强的基因) 的重要作用:当T被C取代时,脂质堆积;当C转变为T时,停止储存脂肪。通过对此核苷酸的编辑,成功逆转了小鼠的肥胖症,为治疗肥胖症以及由肥胖引起的糖尿病提供了素材。2016年,Naylor等[56]同样应用此技术敲除了大鼠INS-1胰腺β-细胞系中的Glp-1r或Gipr(治疗糖尿病的重要药物靶点[57]),结果发现Glp-1r和GIP相结合的双重激动剂在体内外都能与其受体结合,且平衡的双重激动剂能够显著改善葡萄糖耐量。
6 总结与展望
基因编辑技术为生命科学研究提供了最新的技术手段,随着其不断发展和完善,使得各种人类疾病动物模型的制备成为可能,极大地推动了人类疾病相关研究。本文主要针对神经退行性疾病、家族性肥厚心肌病、癌症、免疫缺陷类疾病和代谢性疾病等5种疾病类型概括了相关基因编辑鼠和猪模型的应用情况 (表1)。此外,猴子等非人灵长类动物在神经学、生理学、解剖学、营养学、遗传学等各方面与人类最为接近,近年来也逐渐作为动物模型应用于人类疾病、智力和神经学研究[58-60]。不过,以非人灵长类动物作为实验模型,也存在着几处缺点:一是实验周期长、成本高;二是其身体结构比较复杂,实验难度大;三是具有智力,存在着社会伦理方面的局限性[61-62]。相信随着基因编辑技术的继续完善,基因编辑动物模型将在人类疾病研究中进一步被广泛应用。
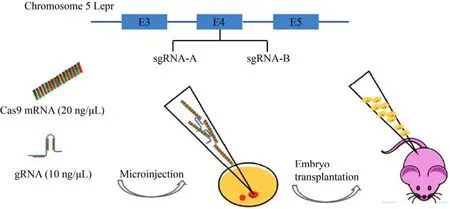
图4 利用CRISPR/Cas9技术建立的糖尿病基因编辑大鼠模型[52]Fig 4 A diabetes gene editted rat model established by CRISPR/Cas9 technique[52].
如本文中所述,通过基因编辑技术制备基因编辑动物模型的方法主要有原核注射法和体细胞克隆法,应用于人类疾病研究的基因编辑动物模型主要有小鼠、大鼠和猪等动物模型。其中,基因编辑鼠模型一般通过原核注射法制备,相对于大动物模型具有制作成本低、周期短、操作方便等优点;但是鼠类在机体各方面与人类差异较大,且寿命短,作为疾病模型的有效性和可信度尚有待商榷。另外,通过原核注射法制备基因编辑动物模型只能在产后进行基因型鉴定,且存在嵌合体的问题,对于大动物模型的制备不够经济有效,尤其是针对基因编辑效率低 (比如依赖于同源重组机制的基因敲入、替换和点编辑)、动物繁殖力低和繁殖周期长等情况。另一方面,基因编辑猪模型主要通过体细胞克隆法制备,猪相对于鼠类在生理学、解剖学、营养学和遗传学等各方面与人类都有相似之处,且相对于非人灵长类动物具有快速繁殖(性成熟5–6个月) 和产仔数 (平均7–8只仔猪) 的明显优势,作为实验动物模型近年来被广泛应用于人类疾病研究,并取得了一定的成果。通过体细胞克隆法制备基因编辑动物的策略,能够在动物产前进行核供体细胞的阳性鉴定,因此动物在产后阳性率高,相对原核注射法大动物生产成本低。不过,体细胞克隆法技术含量要求较高,除了体细胞核移植技术外,核供体细胞的分离、编辑和阳性筛选也是其中的关键。本文通讯作者及其研究团队在前期的研究中先后开发了源于嗜热链球菌Streptococcusthermophilus的StCas9系统、红绿双荧光报告技术[63]和基因编辑阳性细胞的RPG辅助报告筛选(SSA-based Purorand mRFP-eGFP surrogate reporters) 技术[64-65];其中,基因编辑阳性细胞的筛选有效解决了体细胞克隆法中核体细胞的筛选问题。之后,团队新近开发的CRISPR/Rad52-Cas9系统[66]和sgRNA-shRNA/Cas9系统[67-68]分别从Rad52-Cas9融合表达和sgRNA-shRNA协同作用两个方面有效提高了同源重组介导的基因编辑效率。这些研究成果为以后通过基因编辑技术制备动物模型的相关研究提供了有力的技术支持。不过,目前在基因编辑动物制备过程中尚不能实现高效的双等位基因编辑,相关技术有待进一步研究和开发。
