霉酚酸对小反刍兽疫病毒复制的影响
2020-08-04张邵博摆倩文常秋燕丁功涛皮尔穆罕默德阿卜杜勒
张邵博,摆倩文,常秋燕,丁功涛*,皮尔·穆罕默德·阿卜杜勒
(1.西北民族大学生物医学研究中心,甘肃 兰州 730030;2.西北民族大学生命科学与工程学院,甘肃 兰州 730030;3.马来西亚国立大学工程与建筑环境学院,马来西亚 雪兰莪州 43600)
【研究意义】小反刍兽疫病毒(peste des petits ruminants virus,PPRV)属于副黏病毒科、麻疹病毒属,是小反刍兽疫(peste des petits ruminants,PPR)的致病原[1-2]。PPR是能引发包括野生动物在内的小反刍动物的一种急性、烈性、致死性、高度接触性传染病,在易感群体中,可高达90 %以上的致死率。主要表现为肺炎、糜烂致死性口炎、呼吸道炎、肠炎等症状[2-5]。【前人研究进展】2007年PPR在我国西藏阿里革吉县首次出现[6]。2013年邻国发生了PPR的大流行,并且蔓延到我国的许多省份[7-8]。2014年甘肃古浪县PPR暴发疫情[9]。PPR作为Ⅰ类世界性动物疫病,影响范围广,危害大,给养殖业带来巨大的经济损失,影响我国的肉制品出口贸易。我国作为农业畜牧业出口大国,动物疫病防疫面临着巨大的挑战。利用现有的药物防控PPRV是一种低成本高效益的解决方案。霉酚酸酯 (mycophenolatemofetil,MMF)是国内外广泛应用于预防、治疗移植器官急性排异反应的免疫抑制剂[10]。霉酚酸酯(MMF)是霉酚酸(mycophenolic acid,MPA)的2-吗啉代乙基酯类衍生物,MMF进入机体后迅速代谢为MPA而发挥免疫抑制作用[11]。MPA除了具有免疫抑制能力外,在体外还可有效的抑制多种DNA和RNA病毒,包括登革热病毒[12]、西尼罗病毒[13]、黄热病病毒[14]、基孔尼亚病毒[15]、乙肝病毒[16]和丙肝病毒[17]。MPA是次黄磷核苷酸脱氢酶(inosine monophosphate dehydrogenase,IMPDH)的非竞争性抑制剂,尤其是IMPDH2亚型[18]。MPA通过抑制IMPDH的活性,阻断细胞内鸟苷酸的合成,使得鸟苷池中GMP含量不足,从而抑制病毒复制。【本研究切入点】本研究利用PPRV敏感细胞株Vero细胞来评价免疫抑制剂MPA在体外对PPRV复制的影响,并探讨其可能的机制。【拟解决的关键问题】以期为PPRV的研究与防控提供参考依据。
1 材料与方法
1.1 供试材料
毒株、细胞株:PPRV疫苗株-PPRV/Nigeria 75/1(新疆天康生物技术股份有限公司);Vero细胞(CCTCC)。试剂及器材:M199培养基(北京赛澳美细胞技术有限公司);新生牛血清(兰州民海生物工程有限公司);DMSO(Sigma-Aldrich);TRIzolTMReagent(Invitrogen),反转录试剂盒(Promega);q-PCR试剂盒(Genecopoeia);CCK-8(北京索莱宝科技有限公司);霉酚酸(Sigma-Aldrich);鸟苷酸Guanosine(Sigma-Aldrich);酶标仪(Thermo);q-PCR仪(Bio-Rad)。
1.2 试验方法
1.2.1 MPA的细胞毒性实验 将Vero细胞接种于含M199培养基(含3 %新生牛血清)的96孔板,接种密度3×104cells/mL,每孔100 μl,置5 % CO2、37 ℃的培养箱中培养;24 h后换含有不同浓度MPA的培养基(含1 %新生牛血清),MPA作用终浓度分别为0、0.1、0.5、1和5 μmol/L,每种浓度5孔平行,以不含MPA孔为对照,继续培养120 h;每孔加入10 μl CCK-8溶液,继续培养2 h后,将96孔板置于酶标仪中,450 nm处测定光密度值,带入公式viability=[(As-Ab)/(Ac-Ab)]×100 %计算细胞活率,其中As为实验孔吸光度(含细胞、培养基、CCK-8溶液和MPA)、Ac为对照孔吸光度(含细胞、培养基、CCK-8溶液、不含MPA)、Ab为空白孔吸光度(含培养基、CCK-8溶液、不含细胞和MPA)。该实验独立重复6次。
1.2.2 MPA对PPRV增殖的影响 MPA粉末在DMSO中溶解,浓度为1.5×10-2mol/L。将Vero细胞按照5 ×105cells/孔接种于6孔板中,M199培养基(含3 %新生牛血清)、5 %CO2、37 ℃培养箱中培养24 h;接种PPRV(MOI=1)感染细胞,培养1.5 h后,将培养基换成含1 %新生牛血清的M199培养基继续培养,对照组不接种PPRV;24 h后弃上清培养基,每孔加入3 mL含不同浓度MPA的M199培养基(含1 %新生牛血清),MPA作用终浓度分别为0、0.1、0.5、1和5 μmol/L,继续培养5 d,每24 h观察细胞生长情况;培养5 d后,一部分细胞培养板弃培养基,用1 mL的1×PBS清洗3遍,每孔加入500 μl TRIzol,冰上裂解10 min,收集细胞,置-80 ℃保存提取RNA备用;另一部分细胞培养板弃培养基,用1 mL的1×PBS清洗3遍,每孔加入1 mL 70 %乙醇固定2 min,去乙醇,加入1 mL的1×PBS,显微镜下观察接毒后经各浓度MPA处理的Vero细胞生长状况。该实验独立重复6次。
1.2.3 霉酚酸抑制PPRV增殖的动力学效应 将Vero细胞25×104cells/孔接种于12孔板,M199培养基(含3 %新生牛血清)、5 % CO2、37 ℃培养箱中培养24 h;接种PPRV(MOI=1)感染细胞,培养1.5 h后,将培养基换成含1 %新生牛血清的M199培养基继续培养,对照组不接种PPRV;24 h后弃上清培养基,每孔加入2 mL最佳浓度的MPA培养基混液,继续培养120 h,不经MPA处理组作为对照组,每24 h观察细胞生长情况,分别收集0、24、48、72 、96和120 h的细胞。每孔加入500 μl TRIzol,冰上裂解10 min,-80 ℃保存提取RNA备用。该实验独立重复6次。
1.2.4 鸟苷酸的细胞毒性实验 将鸟苷酸粉末在DMSO中溶解,浓度为1×105μg/mL。实验方法同2.1。鸟苷酸终浓度为0,1,10,100 μg/mL,以不添加鸟苷酸组为对照组。
鸟苷酸对MPA的拮抗作用。将Vero细胞25×104cells/孔接种于12孔板中,M199培养基(含3 %新生牛血清)、5 %CO2、37 ℃培养箱中培养24 h;接种PPRV(MOI=1)感染细胞,培养1.5 h后,将培养基换成含1 %新生牛血清的M199培养基继续培养,对照组不接种PPRV;24 h后弃上清培养基,每孔加入2 mL含不同浓度的鸟苷酸和最佳浓度的MPA混合液,鸟苷酸的终浓度分别为0、1、10和100 μg/mL,继续培养120 h,每24 h观察细胞生长情况;培养5d后,弃培养基,用1 mL的1×PBS清洗细胞3遍,每孔加入500 μl TRIzol,冰上裂解10 min,收集细胞,置-80 ℃保存提取RNA备用。该实验独立重复6次。
1.2.5 RNA的提取、反转录及q-PCR验证 提取样品总RNA,定量1 μg RNA为模板,两步法反转录成cDNA并进行q-PCR,反应中所用的引物序列为:Vero-GAPDH-Forward:5’-TCTGGGTAAAGTGGATAT TGT-3’,Vero-GAPDH-Reverse:5’-TTCCAGTATGATTCCACC-3’;PPRV-H-Forward:5’-CTGAATACCAACATTGAG-3’, PPRV-H-Reverse:5’-GAGGAACTTAATCTTATCG-3’。q-PCR反应条件:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸30 s,共40个循环,以猴源GAPDH为参照基因,采用2-ΔΔCT(ΔCTsample-ΔCTcontrol)公式对基因表达进行计算。
1.3 统计学分析
使用GraphPad Prism version8.01分析软件采用未配对-非参数分析方法(Mann-Whitney test)对所得结果进行数据分析,结果用Mean±SD表示。*P﹤0.05; **P﹤0.01; ***P﹤0.001;ns:差异不显著。
2 结果与分析
2.1 MPA的细胞毒性实验
不同浓度MPA处理细胞120 h后,如图1所示,低浓度0~0.5 μmol/L的MPA对Vero细胞活性的影响无显著差异,随着MPA浓度的增加,5 μmol/L MPA对细胞活性的影响差异极显著(P﹤0.001)。
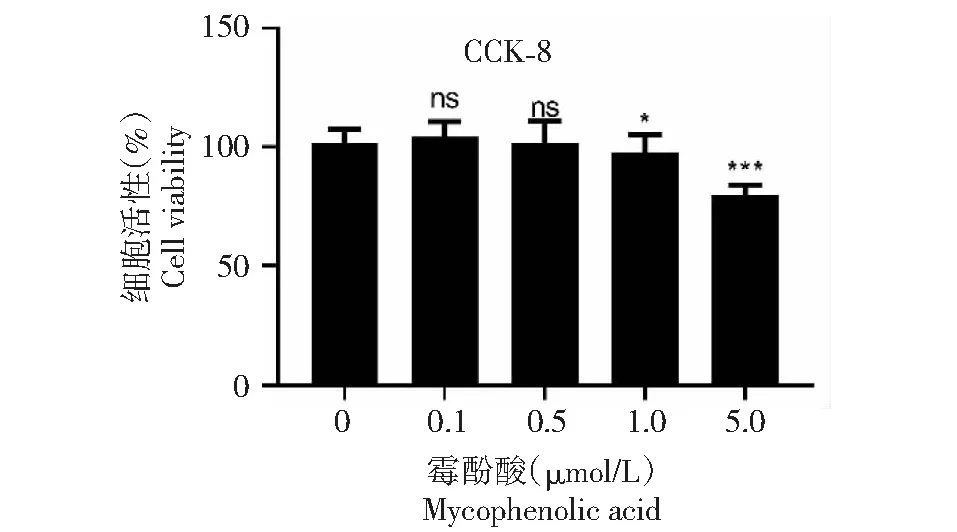
图1 霉酚酸对Vero细胞活性测定
2.2 不同浓度MPA对PPRV增殖的抑制
如图2所示,不同浓度MPA处理的Vero细胞,在光学显微镜下显示,MPA对PPRV的增殖呈药物依赖浓度梯度抑制作用,1和5 μmol/L的MPA浓度细胞病灶明显少于其他组;如图3所示,q-PCR测定病毒的增殖情况,所得结果与图2所示细胞水平结果相一致,0.1、0.5、1 μmol/L浓度组均显著抑制PPRV的增殖,5 μmol/L抗病毒效果最佳。结合实验结果3.1,最终选择抑制PPRV最佳的MPA工作浓度为1 μmol/L,这个浓度对细胞的活性影响相对较小,同时抗病毒的作用显著。
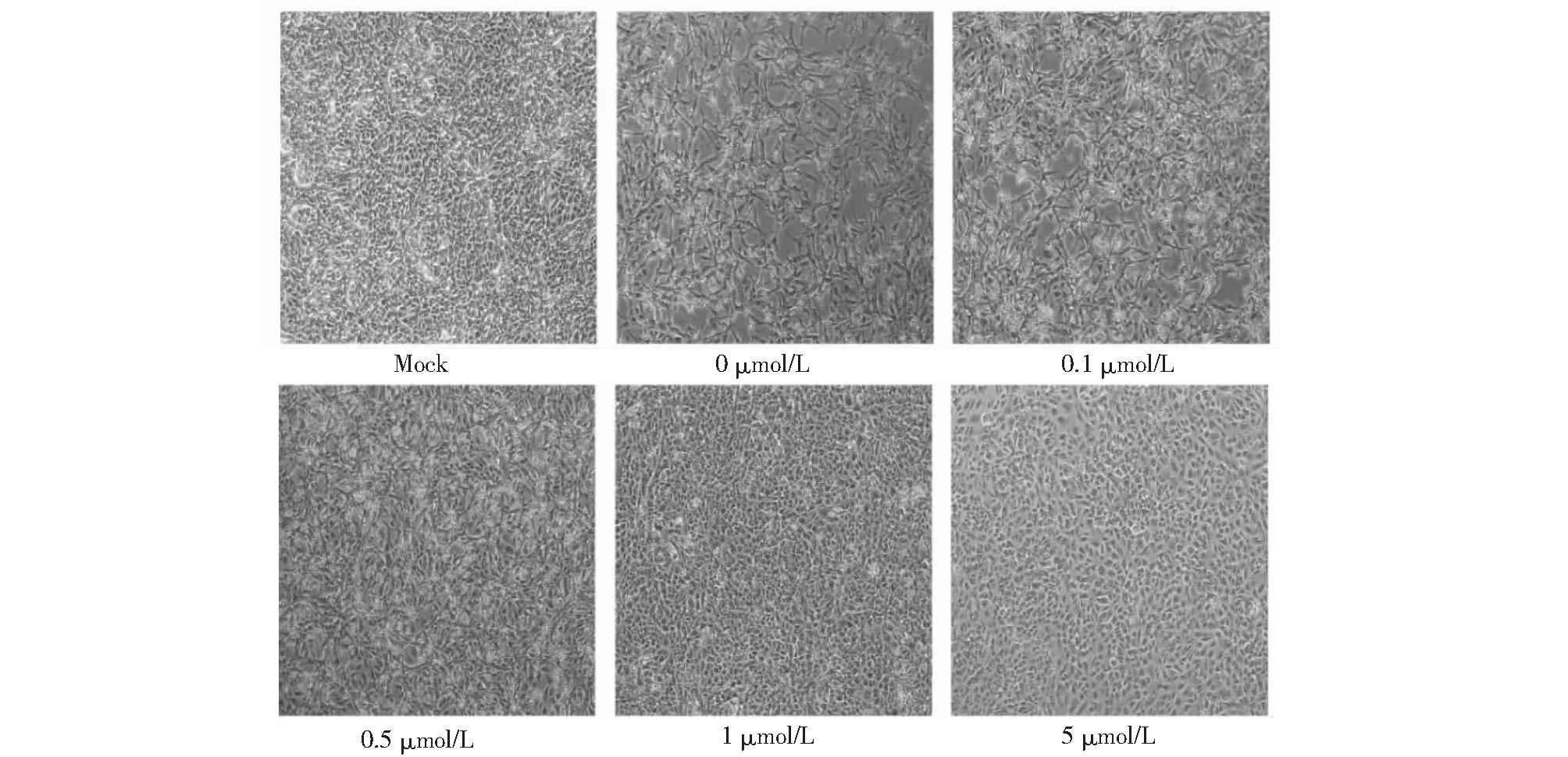
Mock:不接毒对照组;0 μmol/L:0 μmol/L的MPA处理组;0.1 μmol/L:0.1 μmol/L的MPA处理组;0.5 μmol/L:0.5μmol/L的MPA处理组;1 μmol/L:1 μmol/L的MPA处理组;5 μmol/L:5 μmol/L的MPA处理组
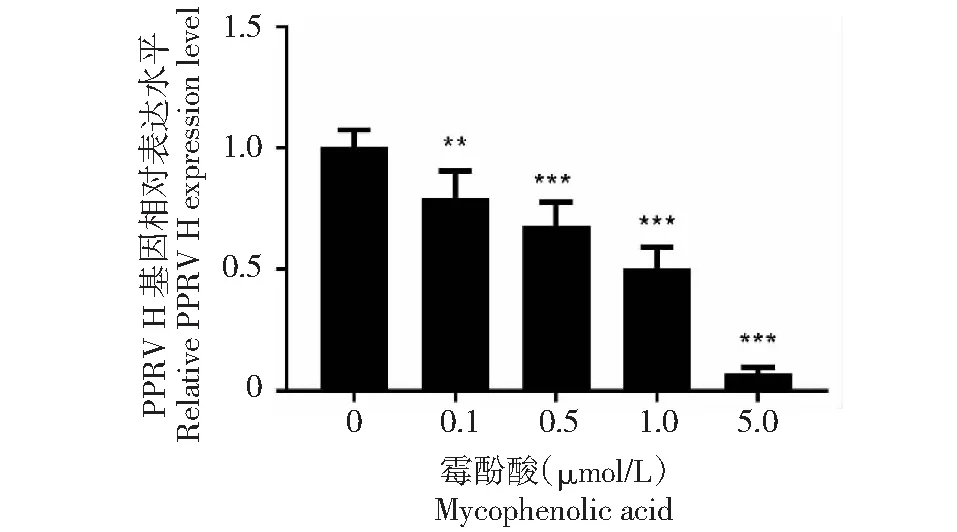
图3 MPA梯度抑制PPRV的复制
2.3 MPA抑制PPRV增殖的动力学效应
如图4所示,在最佳终浓度1 μmol/LMPA处理前期0~72 h,病毒的复制得到有效抑制,72 h时对病毒增殖的抑制是对照组(568.1±16.97)倍(P﹤0.001);96 h时,达到(721.9±24.21)倍(P﹤0.001)。虽然在96 h,对病毒的抑制效果极显著,但是病毒的增殖量变大。

图4 不同时间点MPA对PPRV增殖的抑制作用
2.4 鸟苷酸的细胞毒性实验结果
如图5所示,鸟苷酸浓度1 μg/mL时细胞活性无显著差异,鸟苷酸浓度10 μg/mL是细胞活性有显著差异,鸟苷酸的浓度100 μg/mL时,对细胞活性的影响是极显著的,所以在研究鸟苷酸对MPA有无拮抗作用实验中,将此浓度去掉。
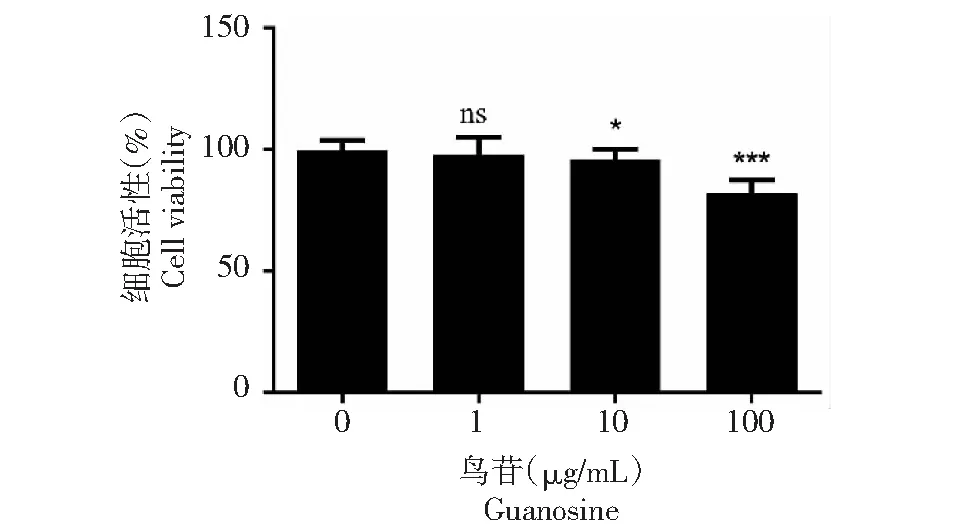
图5 鸟苷酸对Vero细胞活性测定
2.5 不同浓度鸟苷酸对MPA抗PPRV的拮抗作用
如图6所示,接毒细胞经MPA和鸟苷酸的共同处理后,PPRV的增殖均受到抑制,MPA浓度1 μmol/L时,随着鸟苷酸浓度的增加,PPRV的增殖量随之增加,当鸟苷酸浓度为10 μg/mL时差异显著。单独添加鸟苷酸的实验组中,病毒的增殖量有显著增高。
图6 鸟苷酸拮抗霉酚酸抗PPRV的作用
3 讨 论
PPRV能够引起小反刍动物的高致病性传染病,国内外学者对PPRV从其分子生物学、细胞生物学特性、疫病预防以及病毒流行特征进行了大量研究[19-21]。本实验从抗病毒药物着手,研究MPA对PPRV的抗病毒作用,以期能找到防控PPR更好的方法。
本研究中,将感染了PPRV的Vero细胞用不同终浓度的MPA[22]分别处理120 h,通过在光学显微镜下观察PPRV病灶的生成和提取总RNA,采用q-PCR高灵敏度检测方法测定PPRV-H基因的水平,这2种方式确定MPA对PPRV复制的抑制作用。通过显微镜观察,发现随着MPA的浓度升高,Vero细胞生长状态越来越好,PPRV感染产生的阳性病灶越来越少,这与q-PCR测定的结果相符合。说明,MPA对PPRV呈剂量依赖性抑制。通过细胞毒性实验发现,MPA浓度越高,对细胞的毒性越大。设定MPA的最佳浓度在1 μmol/L,测定药物处理后不同时间点MPA的抗病毒动力学,结果表明24、48和72 h,MPA对PPRV具有显著地抑制作用;当药物处理达到96 h后,可能由于药物的半衰期,病毒的复制明显增强,但药物的抗病毒作用依然显著;随着培养时间的增加,在120 h时,由于培养基中营养物质的缺乏以及病毒的持续增殖造成细胞发生融合,产生病变,使得细胞的生长状态发生变化,检测发现细胞内病毒的复制量逐渐下降,但MPA处理过的病毒增殖量依然比对照组少,这说明MPA可持续抑制PPRV的复制。
本研究通过额外添加鸟苷酸研究了MPA的抗病毒机制,当鸟苷酸与MPA同时作用于感染PPRV的Vero细胞时,鸟苷酸减弱了MPA的抗病毒作用,这一研究结果与MPA抑制IMPDH活性阻碍GTP合成的机制相一致[23]。IMPDH 是嘌呤核苷酸合成的限速酶,在鸟苷酸(GMP)的生物合成中起到了重要作用,MPA是IMPDH非竞争性、可逆性抑制剂,抑制了IMPDH活性,进而影响了GMP、鸟苷二磷酸(GDP)、脱氧鸟苷二磷酸(dGDP)、鸟苷三磷酸(GTP)及脱氧鸟苷三磷酸(dGTP)的合成,而dGTP和GTP对DNA 及RNA 的合成至关重要[24],进一步证明MPA抑制了细胞内GMP的合成,进而抑制了DNA 及RNA 的合成,抑制了病毒的复制。本研究发现,额外添加鸟苷酸后MPA对PPRV复制的抑制作用被拮抗,其机制在于外加的鸟苷酸通过核苷酸合成的补救通路部分抵消MPA 对鸟苷酸的抑制,进而拮抗了MPA对PPRV 复制的抑制。这进一步证实MPA 在体外对PPRV 复制的抑制作用是通过抑制细胞内鸟苷酸的合成来实现的。
目前针对PPRV,主要是疫苗预防,常规疫苗免疫效果不好,基因工程疫苗价格昂贵,因此亟需对抗病毒药物进行研究,所以对于MPA的抗PPRV作用,还需在临床应用上进一步开展动物实验来确定其作用。
综上所述,研究结果证明MPA能够在体外有效地抑制PPRV的增殖。从机制上讲,细胞嘌呤核苷酸的消耗对于抗PPRV效应是必不可少的。作为普通药物,MPA安全性高,并且已经在临床上用于治疗患者几十年。因此认为,重新利用抗病毒药物以治疗家畜和野生动物中PPRV感染,是一个低成本高效益方案。
