羊口疮病毒重庆分离株008基因的原核表达及生物信息学分析
2020-08-04余远迪许国洋张素辉付利芝
余远迪,许国洋,张素辉,郑 华,付利芝,杨 柳*
(1.重庆市畜牧科学院,重庆 荣昌 402460;2.重庆市兽用生物制品工程技术研究中心,重庆 荣昌 402460)
【研究意义】羊口疮病毒属于痘病毒科副痘病毒属,为线性双链DNA病毒,基因组大小为134~139 kb,该病毒基因组中间为大的中心编码区,参与病毒的组装和释放;两端为反向末端重复序列[1-2]。临床上,病毒感染羊后以增生性炎症为典型特征,表现为在羊的口唇、舌、鼻、乳房等部位开始出现红斑,然后红斑形成丘疹、囊泡,带黄色乳脂状的脓疱外表和结痂最后变得干燥,并且病毒能反复感染宿主[3]。近年来,随着我国养羊业的不断发展,羊口疮在我国发生的病例相继被报道[4],当人接触患病的羊或野生动物时容易感染本病,对养羊业发展和相关人群的健康构成一定威胁。【前人研究进展】羊口疮病毒的毒力基因、与宿主嗜性相关的编码基因及免疫调节基因定位于基因组两侧的末端区域[5],该病毒末端部分基因的功能相继被解析:抑制NF-κB转运的ORFV002和ORFV121[6-8],趋化因子阻遏蛋白ORFV112[9],GM-CSF/IL-2抑制因子ORF117[10],血管内皮生长因子蛋白ORFV132[11],免疫调节因子白介素-10 ORFV127[12],抗细胞凋亡因子ORFV125[13],脱氧尿苷三磷酸酶,以及F-box-like锚定蛋白[14]等。已被证实锚定蛋白重复序列和F-box结构域蛋白广泛存在于痘病毒中,大小在400~650个氨基酸之间[15],并且病毒在感染宿主的早期表达F-box-like锚定蛋白[16-17]。【本研究切入点】重庆是西南地区养殖羊的主要地区,在临床流行病学调查中,发现羊口疮持续在重庆地区流行,该病已经影响重庆地区养羊业的发展。【拟解决的关键问题】进一步阐明008基因的特性,为探索008基因的功能和致病机制奠定基础,本研究对该基因进行克隆,并利用大肠杆菌表达系统进行原核表达和生物信息学分析。
1 材料与方法
1.1 材料
羊口疮病毒毒株由重庆市畜牧科学院兽医兽药研究所分离保存;大肠杆菌DH5α、BL21(DE3)、原核表达载体pET-28a(+)、羊口疮病毒感染羊阳性血清由重庆市畜牧科学院兽医兽药研究所保存;925-68047 IRDye®680RD 驴抗山羊 IgG二抗购自Li-cor化学免疫试剂公司;LB液体培养基和LB固体培养基购自;氨苄青霉素、卡那霉素、IPTG、PrimeSTAR GXL DNAPolymerase、pMD 19-T Vector、T4连接酶、NdeI、HindIII、DL 2000 DNA Marker购自宝生物公司;DNA胶回收试剂盒、质粒小量提取试剂盒购自OMEGA公司。
1.2 方法
1.2.1 引物的设计 根据已发表羊口疮病毒008基因序列,合成一对引物:OFRV-008-F,5’-CATATGATGCTCTCGCGGGAGTCCGTCGTGATGGATC CGCCGGAAATTAC-3’;OFRV-008-R,5’-AAGCTTTCAGGGGCGGGTCAGCATGGC-3’(斜线部分为NdeI、HindIII酶切位点)。
1.2.2 008基因的扩增 以分离的羊口疮病毒DNA为模板扩增,反应条件为:98 ℃ 3 min;98 ℃ 10 s,60 ℃ 15 s,68 ℃ 90 s;72 ℃ 7 min;16 ℃ 保存,扩增产物用1 %的琼脂糖凝胶电泳检测,PCR产物用OMEGA胶回收纯化试剂盒进行纯化回收。
1.2.3 008基因的克隆和重组表达载体的构建 将纯化的PCR产物和pET-28a(+)载体用T4连接酶连接,转化至E.coliDH5α感受态细胞中,挑取单菌落进行PCR鉴定。阳性菌落接种于含Kan(50 μg/mL)的LB液体培养基中过夜,用Omega小量质粒提取试剂盒提取质粒,NdeI、HindIII双酶切鉴定。测序正确后将质粒转化至BL21(DE3)感受态细胞中,挑取单个菌落并进行测序鉴定。
1.2.4 重组质粒的诱导表达及SDS-PAGE分析 将含有pET-28a(+)-008和pET-28a(+)空载体的E.coliBL21(DE3)工程菌分别转接于含Kan (50 μg/mL)LB液体培养基中,200 r/min振摇培养过夜,次日按3∶100转接于含Kan(50 μg/mL)的LB液体培养基中,37 ℃振摇培养至OD600 nm≈1.5,加入终浓度为0.1 mmol/L IPTG,分别于诱导后8、16、24 h取菌液10 mL。菌液在4 ℃以10 000 r/min离心10 min后弃上清,沉淀用5 mL 灭菌水重悬后用超声粉碎仪在冰上粉碎20 min(工作5 s,间隔5 s,功率300 W),在4 ℃以10 000 r/min离心10 min。分离上清和沉淀,沉淀用5 mL灭菌水重悬。分别取上清液(含表达可溶部分)30 μl和重悬液(含表达非可溶部分,即包涵体)90 μl与上样缓冲液混合,煮沸变性5 min,瞬时离心后加入上样缓冲液进行SDS-PAGE分析。
1.2.5 008蛋白的Western blotting分析 将重组表达的蛋白进行SDS-PAGE,用湿转转印仪进行转移至NC膜上,转膜仪置于冰上200 mA恒流转膜50 min;用PBST洗涤NC膜,加入含5 %脱脂奶粉的封闭液37 ℃封闭2 h,弃去封闭液,PBST洗涤NC膜5遍,每遍3 min,加入羊口疮阳性血清(1∶100)为一抗;驴抗山羊IgG为二抗(1∶10000)。使用Odyssey双色红外激光成像系统扫描NC膜观察。
1.2.6 羊口疮008蛋白生物信息学分析 使用ProtScale程序在线分析ORFV 008蛋白的疏水性;使用TMHMM server v.2.0对008蛋白进行跨膜区分析;使用SignalP 5.0 server对ORFV 008蛋白进行信号肽预测;使用Protean对008蛋白进行B细胞抗原表位预测分析。
2 结果与分析
2.1 008基因的扩增与克隆
以羊口疮病毒基因组DNA为模板,通过PCR扩增出与预期大小(1500 bp)一致的片段(图1)。目的基因经过纯化后与pMD19-T载体连接,得到重组质粒pMD19-T-008,经酶切得到1500 bp左右的片段,测序结果与GenBank中的基因序列比较同源性达98.34 %,结果表明目的基因成功克隆。

M.DNA分子量标准;1.008基因扩增片段
2.2 pET-28a(+)-008质粒的鉴定
将pET-28a(+)质粒与pMD19-T-008质粒用NdeI、HindIII双酶切后连接转化置大肠杆菌BL21(DE3)中,构建得到重组表达质粒pET-28a(+)-008,挑取阳性单克隆进行PCR以及双酶切鉴定,得到1 500 bp左右片段(图2),测序比对结果正确,结果表明重组原核表达质粒pET-28a(+)-008构建成功。

M.DNA分子量标准;1.pET-28a(+)-008质粒
2.3 重组菌的诱导表达及SDS-PAGE分析
取重组诱导菌不同诱导时间的菌体分别进行SDS-PAGE分析,试验确定IPTG诱导16 h表达量最大,表达产物约为56 kd,与预期蛋白条带相符,而未诱导菌和诱导后的空载体均未出现次蛋白条带(图3、图4)。对超声裂解细菌的上清和沉淀进行SDS-PAGE分析,表明重组蛋白以包涵体的形式存在。
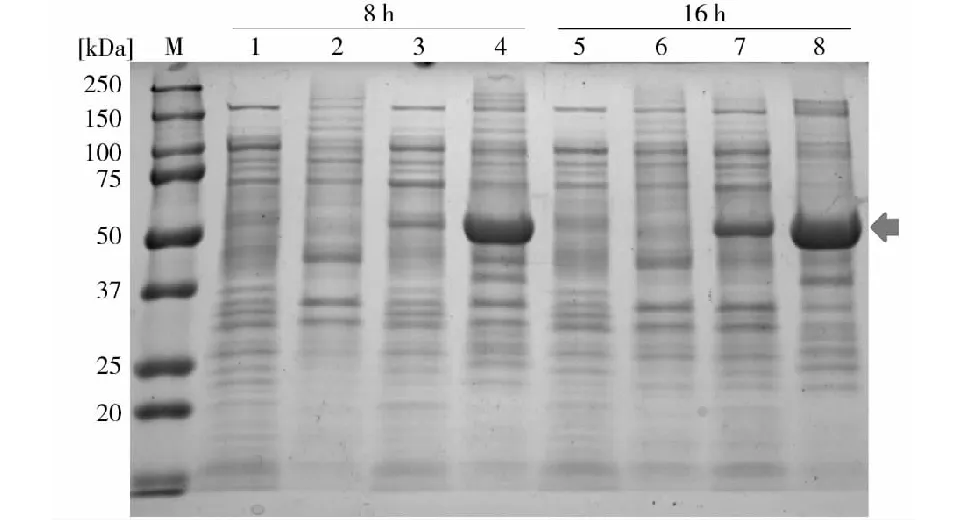
M.蛋白分子量标准;1,5,pET-28a(+)空载体分别诱导8、16 h表达上清产物;2,6.pET-28a(+)空载体分别诱导表达8、16 h沉淀产物;3,7.pET-28a(+)-008蛋白分别诱导表达8、16 h上清产物;4.pET-28a(+)-008蛋白分别诱导表达8、16 h沉淀产物
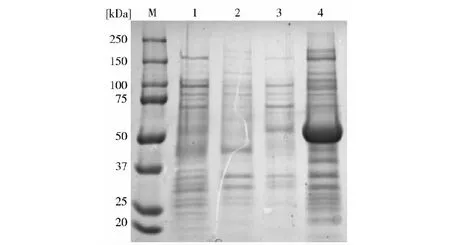
M.蛋白分子量标准;1,pET-28a(+)空载体诱导表达上清产物;2,pET-28a(+)空载体诱导表达沉淀产物;3.pET-28a(+)-008蛋白诱导表达上清产物;4.pET-28a(+)-008蛋白诱导表达沉淀产物
2.4 008蛋白的Western blot鉴定
用羊口疮阳性血清(作为一抗,IRDye驴抗山羊IgG作为二抗)对未纯化的包涵体蛋白进行Western blot分析,结果表明原核表达的008重组蛋白能跟羊口疮阳性血清特异性结合(图5),结果表明008重组蛋白具有良好的抗原性。
2.5 008蛋白生物信息学分析
使用ProtScale程序基于K-D法在线分析ORFV 008蛋白的疏水性,结果可知008蛋白大约在C端位置含有一个典型的疏水性区域(图6),亲水性平均系数(GRAVY)为0.209;使用TMHMM server v.2.0对008蛋白进行跨膜区分析,预测结果显示,008蛋白1~516位氨基酸位于细胞膜表面,氨基酸残基系数为1.37,不具有明显的跨膜结构;使用SignalP 5.0 server对ORFV 008蛋白进行信号肽预测,结果显示008蛋白不具有信号肽序列(图7);使用Protean对008蛋白进行B细胞抗原表位预测分析,采用Kyte-Wolf的亲水性方案、Karplus-Schulz的柔韧性方案、Emini的表面可及性方案和Jameson-Wolfde 抗原指数方案综合预测(图8),各方案所得到的抗原表位见表1。
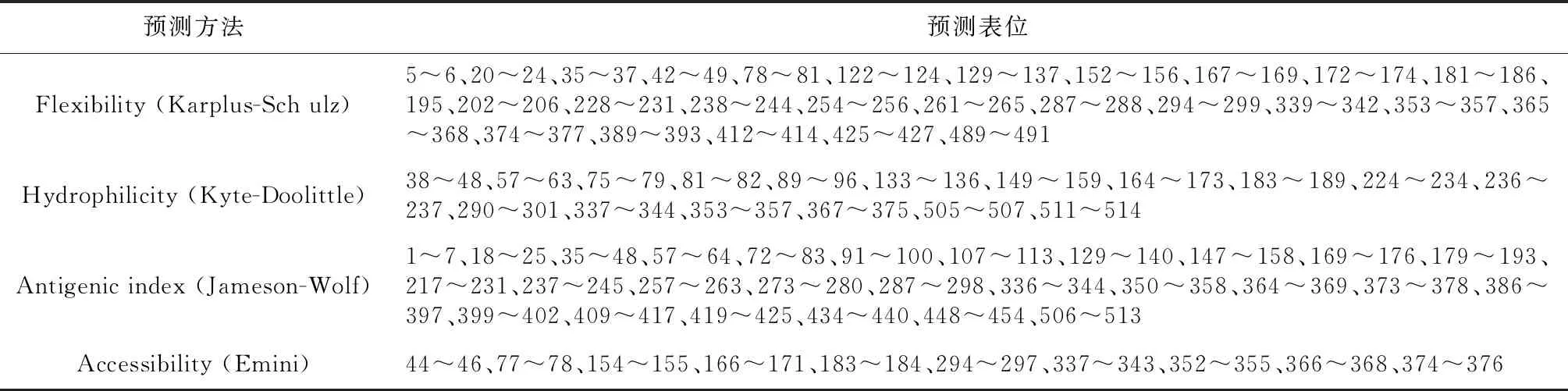
表1 单参数方案预测的抗原表位
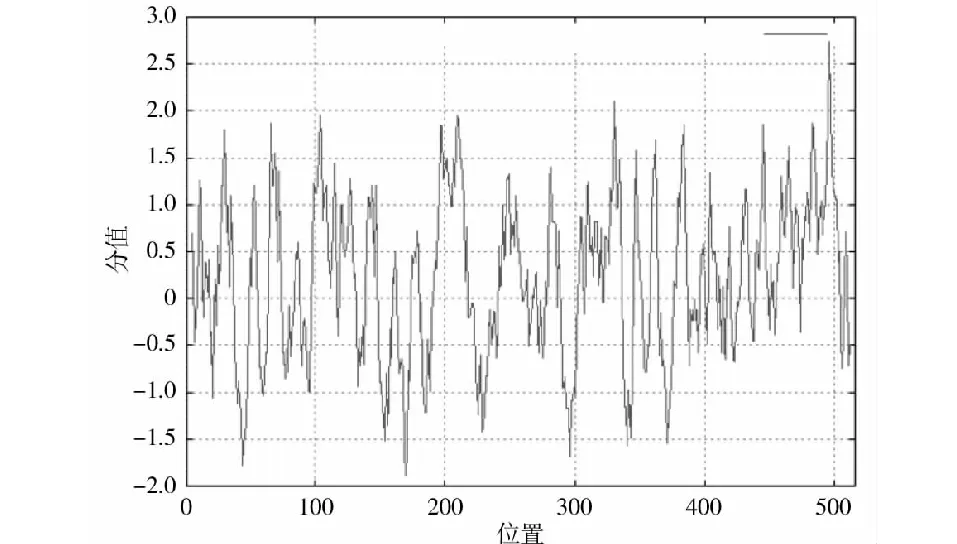
图6 ProtScale程序分析008蛋白的疏水性
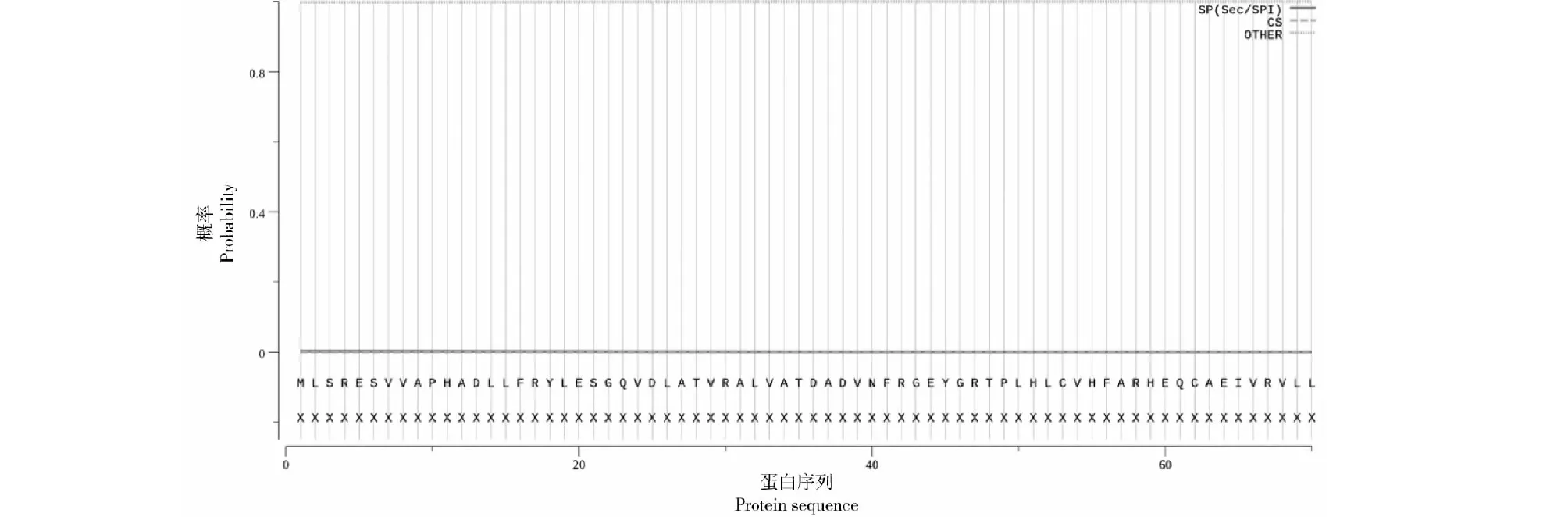
图7 SignalP对008蛋白的信号肽预测
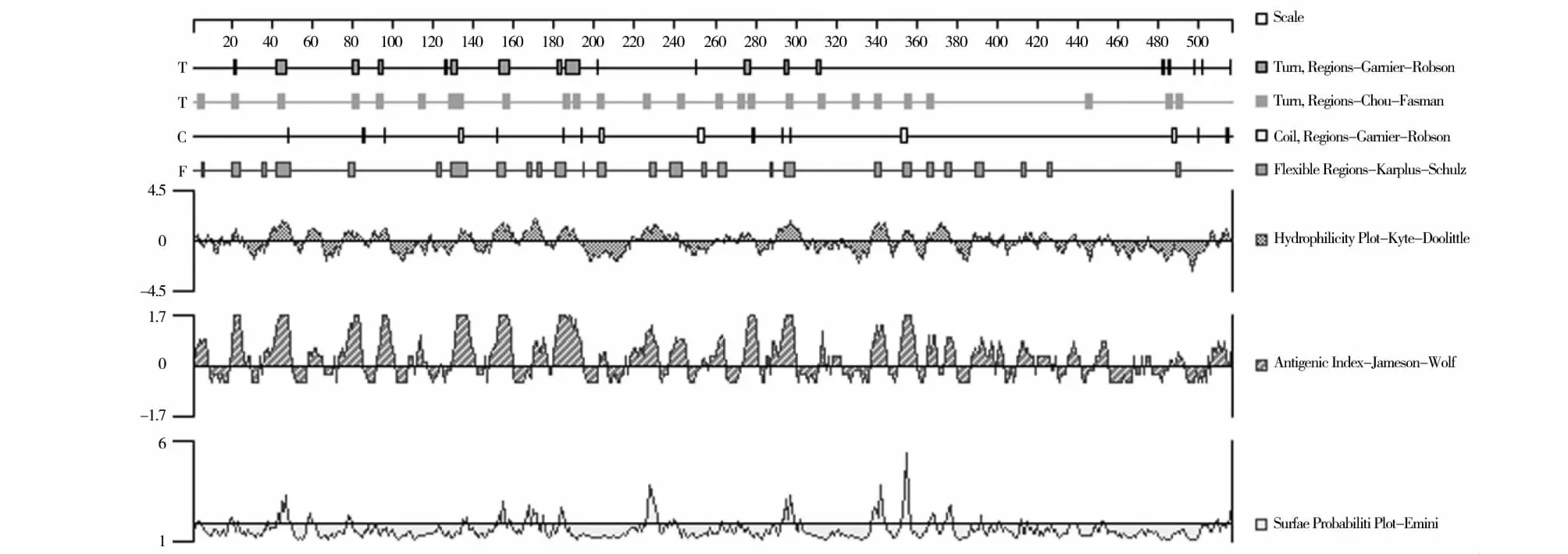
图8 008蛋白综合预测结果
3 讨 论
目前,国内关于羊口疮病毒的致病机制还了解较少,该病毒的一些基因特性尚未解析。已被证实锚定蛋白重复序列和F-box结构域蛋白广泛存在于痘病毒中,早期的研究表明,F-box-like锚定蛋白利于羊口疮病毒的复制[18],F-box蛋白可通过泛素-蛋白酶体系统介导多种蛋白质的降解,能将底物募集到细胞SCF(SKP-1、c ullin、F-box)泛素连接酶复合物上[19-20];牛痘病毒编码的ANK/PRANC蛋白CP77是一个宿主范围蛋白,与NF-κB转录因子p65相互作用,抑制炎性细胞因子的转录[21];鼠痘病毒编码的含有4个F-box-like锚定蛋白和BTB/Kelch蛋白质,分别通过调节泛素连接酶活性阻止IκBα的降解,抑制NF-κB的核转运[22];此外,羊口疮病毒锚蛋白上调缺氧诱导因子(HIF)靶基因的表达从而影响细胞的缺氧信号转导通路[23],羊口疮病毒的F-box-like/ANK锚定蛋白通过不同的方式参与病毒致病的途径,而008蛋白属于该家族成员,相关的研究甚少,其在病毒与宿主的互作中发挥的作用需要进一步挖掘。
通过SDS-PAGE分析,构建的重组表达质粒在IPTG的诱导下成功表达了008蛋白,对表达蛋白的抗原性分析结果表明,重组蛋白具有良好的抗原性。分析ORFV 008蛋白的疏水性,可知008蛋白大约在C端位置含有一个典型的疏水性区域,疏水性氨基酸存在于蛋白质内部,通过其疏水的相互作用,在保持蛋白质三级结构的形成和稳定中起着重要作用;使用TMHMM server v.2.0对008蛋白进行跨膜区分析,预测结果显示,008蛋白1~516位氨基酸位于细胞膜表面,氨基酸的残基系数为1.37,不具有明显的跨膜结构,提示它可能在膜受体没有起作用;在信号肽预测中,008蛋白前60个氨基酸中跨膜螺旋中的氨基酸残疾数值为0.0002,该蛋白无信号肽剪切位点;经过对亲水性指数、抗原指数和表面可能性指数的筛选,排除α螺旋、β折叠内不易形成表位的序列,位于β-转角、无规则卷曲处的表位42~47、78~81、129~137、152~156、181~186、228~231、238~244、294~299、339~342、353~357、365~368预测区域较有可能为B细胞抗原表位,但也不排除其他区域或者它们的附近也存在B细胞抗原表位,其他区域是否存在还需进一步的确认。
4 结 论
本研究克隆羊口疮病毒008基因,并将其插入pET-28a(+)载体中成功构建原核表达质粒,成功表达008蛋白;并对其生物信息学进行了分析,为进一步探索羊口疮病毒008蛋白在感染宿主过程中的机制和作用奠定基础,丰富羊口疮病的致病机制提供科学数据,也为羊口疮病毒基因的研究开发提供新的靶标。
