基于云南主栽马铃薯品种抗氧化防御系统对干旱胁迫的响应研究
2020-08-04任家慧胡锦飙肖关丽
任家慧,杨 淼,王 玥,黄 钰,李 润,胡锦飙,肖关丽
(云南农业大学农学与生物技术学院,云南 昆明 650201)
【研究意义】马铃薯具有耐贫瘠、产量高、适应性广、经济效益高等特点,是中国第四大粮食作物[1-2]。干旱是影响植物生长的重要环境因素之一,严重时会导致植株死亡,造成不可逆伤害[3-4]。植物对干旱胁迫的响应策略一直是抗旱生理的研究热点。正常条件下,植物体内的O2对植物没有危害,而当植物处于干旱条件下,O2可形成1O2,或逐步被还原成超氧阴离子、过氧化氢和羟自由基[5-6]。超氧阴离子易通过自身歧化反应或通过SOD催化生成H2O2,逆境胁迫下植物体内大量积累H2O2,当活性氧浓度超出防御机制所及范围时,细胞将处于氧化胁迫状态,对植物有机体极为有害[7]。马铃薯种植始终会遭受不同程度干旱的影响,影响马铃薯产量和块茎质量[8-9]。因此,研究马铃薯在干旱胁迫下抗氧化防御机制的响应对马铃薯抗旱栽培及育种具有重要意义。【前人研究进展】植物在响应干旱胁迫时,体内活性氧平衡被打破,会通过酶促和非酶促抗氧化防御系统来消除活性氧的伤害,干旱胁迫下植物体内H2O2含量随胁迫时间延长或胁迫程度的增加而升高[10-11],还原性抗坏血酸(AsA),还原性谷胱甘肽(GSH)含量随干旱胁迫程度增加,呈先升后降的变化趋势,抗坏血酸过氧化物酶(APX)、脱氢抗坏血酸还原酶(DHAR)、谷胱甘肽还原酶(GR)活性显著高于对照,随胁迫时间的延长或胁迫程度的加剧先升后降,而单脱氢抗坏血酸还原酶(MDHAR)的变化在不同物种间有差异[12-14]。有关马铃薯对干旱胁迫的响应有不少研究报道,干旱胁迫会影响马铃薯的农艺性状、叶绿素含量、细胞渗透调节物质、光合效率、叶绿素含量及超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等酶活性变化,但针对马铃薯抗氧化防御系统尤其抗坏血酸-谷胱甘肽(AsA-GSH)循环对干旱胁迫响应的系统研究报道较少[15-17]。【本研究切入点】植物抗氧化防御系统对干旱胁迫的响应已经成为植物抗旱生理评价的重要内容,也是抗旱作物筛选的重要依据。云南冬春干旱频发,云南主栽马铃薯品种抗氧化防御系统对干旱胁迫响应有必要进行系统研究。【拟解决关键问题】本研究采用PEG-6000模拟不同程度干旱胁迫,研究其对马铃薯抗氧化防御系统中酶性及非酶性物质的影响,为探明干旱胁迫对马铃薯抗氧化防御系统生理机制提供参考,为马铃薯抗旱栽培及育种提供理论依据。
1 材料与方法
1.1 试验材料
供试品种合作88号、青薯9号、丽薯6号、宣薯2号,种薯购自于云南省寻甸六哨农业综合服务中心。
1.2 试验设计
本试验于云南农业大学后山大棚进行盆栽试验。选择大小一致的马铃薯种薯播种,每个品种播种30盆,每盆2株。出苗后20 d进行PEG模拟干旱胁迫处理,设PEG6000浓度为0 %(CK)、15 %、20 %、25 %、30 % 5个处理梯度。胁迫3 d后,取各品种马铃薯倒4叶、倒5叶进行各项指标测定,3次重复。
1.3 相关物质及酶活性测定方法
对供试验样品中类胡萝卜素(Car)、还原性抗坏血酸(AsA)、还原性谷胱甘肽(GSH)、可溶性蛋白(SP)、过氧化氢(H2O2)、抗坏血酸过氧化物酶(APX)、单脱氢抗坏血酸还原酶(MDHAR)、脱氢抗坏血酸还原酶(DHAR)、谷胱甘肽过氧化物酶(GPX)、谷胱甘肽还原酶(GR)进行测定,所有指标均采用苏州格锐思生物科技有限公司试剂盒进行测定。
1.4 数据分析
利用Excel 2010进行数据整理,SPSS 19.0进行数据分析。
2 结果与分析
2.1 干旱胁迫对马铃薯叶片过氧化氢及可溶性蛋白含量的影响
2.1.1 干旱胁迫下马铃薯叶片过氧化氢含量 从图1可以看出,在PEG浓度为15 %~30 %的模拟干旱胁迫下,马铃薯叶片中H2O2含量随着干旱程度的增加而增加,其中在PEG浓度 15 %轻度干旱胁迫下,合作88号、青薯9号、丽薯6号和宣薯2号叶片中H2O2含量均较对照明显增加,其含量分别为(3.66±0.03)、(1.88±0.08)、(1.29±0.07)和(1.80±0.01)μmol/g,4个品种间差异显著(F=6.59,P<0.05)。在PEG浓度 30 %的高度干旱胁迫下,叶片中H2O2含量达到最大,其中合作88号、青薯9号、丽薯6号和宣薯2号叶片中H2O2含量分别为(1.80±0.01) 、(2.84±0.01) 、(4.12±0.02) 和(5.23±0.01) μmol/g,4个品种间差异显著(F=8.63,P<0.05),与PEG浓度0 %(CK)相比,4个品种叶片中H2O2含量分别增加了719.57 %、333.90 %、425.44 %和79.60 %。综合来看,PEG浓度15 %~30 %的干旱胁迫下马铃薯叶片H2O2含量,均表现为合作88号>青薯9号>宣薯2号>丽薯6号。在供试的4个品种中,合作88号过氧化氢(H2O2)积累量最大,氧化胁迫程度最高。
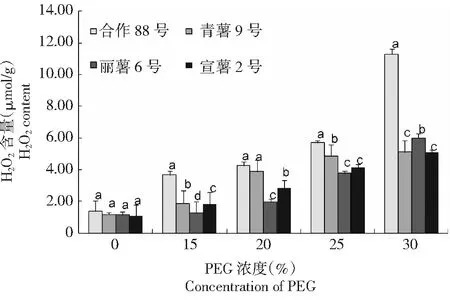
同一浓度数据上不同小写字母表示差异达0.05显著水平。下同
2.1.2 干旱胁迫下马铃薯叶片可溶性蛋白含量 图2结果表明,在PEG浓度15 %~30 %的模拟干旱胁迫下,马铃薯叶片可溶性蛋白的含量呈先增加后降低的趋势变化,其中PEG浓度15 %~25 %的干旱胁迫下,马铃薯叶片可溶性蛋白的含量随着PEG浓度的上升而增加,在PEG浓度30 %时较PEG浓度 25 %时可溶性蛋白含量下降,供试合作88号、青薯9号、丽薯6号和宣薯2号叶片中可溶性蛋白含量分别为(0.07±0.01) 、(0.13±0.01) 、(0.06±0.01) 和(0.13±0.02) μmol/g,较PEG浓度25 %的干旱胁迫下上述4个品种马铃薯叶片可溶性蛋白的含量分别降低了63.16 %、27.78 %、83.78 %和27.78 %。由此表明,在较低PEG浓度的干旱胁迫下,马铃薯叶片中可溶性蛋白含量随着干旱胁迫程度的增加而增加,但在较高PEG浓度的干旱胁迫下,马铃薯叶片中可溶性蛋白含量会急剧降低,对干旱胁迫的防御调控作用下降甚至丧失。
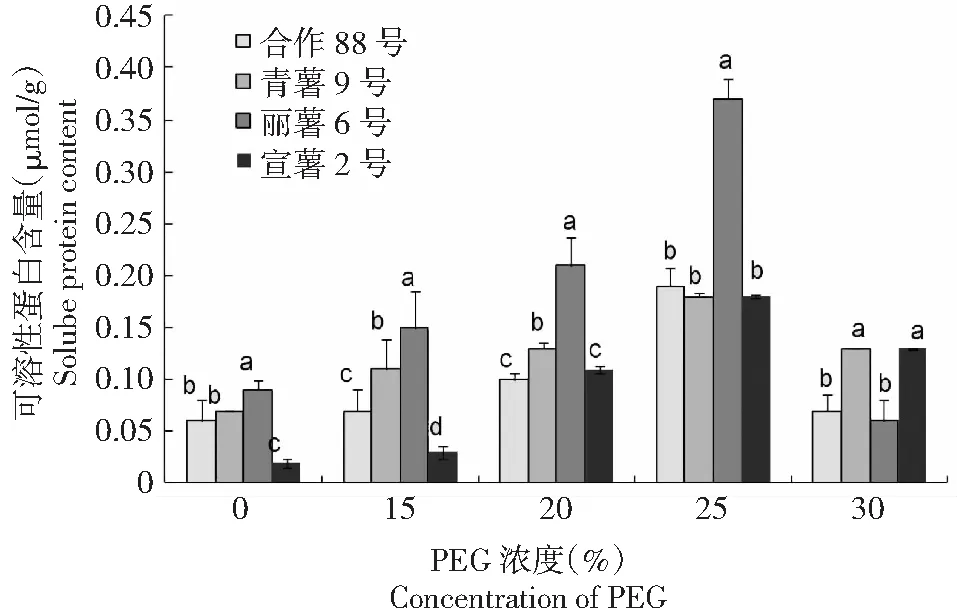
图2 干旱胁迫条件下马铃薯叶片内可溶性蛋白含量
2.2 干旱胁迫对马铃薯叶片中抗氧化酶活性的影响
由图3可以看出,在PEG浓度15 %、20 %、25 %和30 %处理下,4个马铃薯品种叶片中抗坏血酸过氧化物酶(APX)、脱氢抗坏血酸还原酶(DHAR)和谷胱甘肽还原酶(GR)活性随着PEG 浓度的增加呈先增加后下降的变化趋势,即在15 %~20 %浓度范围内,3种酶活随PEG浓度的增加而增加,但当PEG 浓度超过20 %后,这3种酶活即下降,当PEG 浓度达30 %时,抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)酶活降为最低,4个品种分别为 (55.16±11.17) 、(32.05±3.33) 、(71.77±3.56) 和(53.95±0.31) μmol/g,(171.46±3.08) 、(172.57±2.85) 、(131.86±3.10) 和(276.65±2.47) μmol/g。脱氢抗坏血酸还原酶(DHAR)于PEG 浓度达30 %时降为最低,4个品种分别为(484.74±13.69) 、(443.88±16.12) 、(438.73±6.67)和(545.25±2.75) μmol/g。单脱氢抗坏血酸还原酶(MDHAR)和谷胱甘肽过氧化物酶(GPX)的酶活随着PEG 浓度的增加呈先下降后增加的变化趋势,即在15 %~20 %浓度范围内,2种酶的酶活随PEG浓度的增加而降低,但当PEG 浓度超过20 %后,这2种酶的酶活即增加,当PEG浓度达25 %时,单脱氢抗坏血酸还原酶(MDHAR)酶活达最高,4个品种叶片的酶活分别为(477.86±8.93) 、(465.91±3.53) 、(348.11±8.47) 和(356.27±5.15) μmol/g。当PEG浓度达20 %时,谷胱甘肽过氧化物酶(GPX)酶活达最高,4个品种叶片的酶活分别为(16 730.02±140.00) 、(15 629.97±121.60) 、(16 494.97±135.10) 和(10 852.28±52.90) μmol/g。
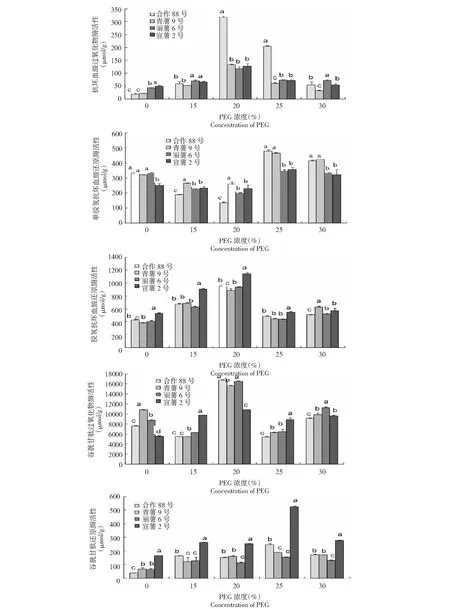
图3 干旱胁迫下马铃薯幼苗期叶片抗氧化酶活性变化
从不同浓度PEG干旱胁迫下各供试马铃薯品种叶片中各酶活峰值期来看,在胁迫后酶活峰值时合作88号叶片中抗坏血酸过氧化物酶(APX)活性明显高于其他品种(F=9.68,P<0.05),宣薯2号叶片中脱氢抗坏血酸还原酶(DHAR)和谷胱甘肽还原酶(GR)含量显著高于合作88号(F=6.87,P<0.05)、丽薯6号(F=7.35,P<0.05)和青薯9号(F=8.32,P<0.05)。在胁迫后单脱氢抗坏血酸还原酶(MDHAR)、谷胱甘肽过氧化物酶(GPX)峰值时,合作88号、青薯9号和丽薯6号品种叶片中单脱氢抗坏血酸还原酶(MDHAR)、谷胱甘肽过氧化物酶(GPX)间无明显差异(单脱氢抗坏血酸还原酶:F=7.43,P<0.05);谷胱甘肽过氧化物酶F=8.29,P<0.05)。
2.3 干旱胁迫下马铃薯叶片中非酶性抗氧化物质含量的变化
由表1表明,随干旱胁迫程度的增强,马铃薯叶片中非酶性抗氧化物质含量的变化趋势不尽相同,其中抗坏血酸(AsA)和谷胱甘肽(GSH)呈现先升高后下降的变化趋势,而类胡萝卜素Car含量呈持续升高的变化趋势。对于干旱胁迫下叶片中抗坏血酸的含量,在浓度25 % PEG的胁迫下,含量达峰值,合作88号、青薯9号、丽薯6号和宣薯2号叶片酶活分别为(0.21±0.01) 、(0.22±0.01) 、(0.97±0.01) 和(0.93±0.03) μmol/g,其中合作88号和青薯9号间无显著差异(F=0.15,P>0.05),丽薯6号和宣薯2号间无显著差异(F=0.31,P>0.05),但丽薯6号和宣薯2号叶片中抗坏血酸含量显著高于合作88号(F=6.32,P<0.05)和青薯9号(F=7.43,P<0.05)。对于谷胱甘肽GSH含量,在PEG浓度25 %的胁迫下,谷胱甘肽GSH酶含量达峰值,4个品种叶片该酶含量分别为(1.78±0.01) 、(2.46±0.02) 、(1.78±0.01) 和(1.96±0.03) μmol/g;其中青薯9号叶片中谷胱甘肽GSH含量高于其他几个品种,但差异不显著(F=0.49,P>0.05)。对于类胡萝卜素Car含量,在PEG浓度30 %的胁迫下,类胡萝卜素Car含量达峰值,4个品种叶片类胡萝卜素Car分别为(481.67±0.32) 、(485.21±2.18) 、(491.64±0.12) 和(490.41±0.20) μmol/g;其中青薯9号叶片中类胡萝卜素Car含量高于其他几个品种,但差异不显著(F=0.21,P>0.05)。
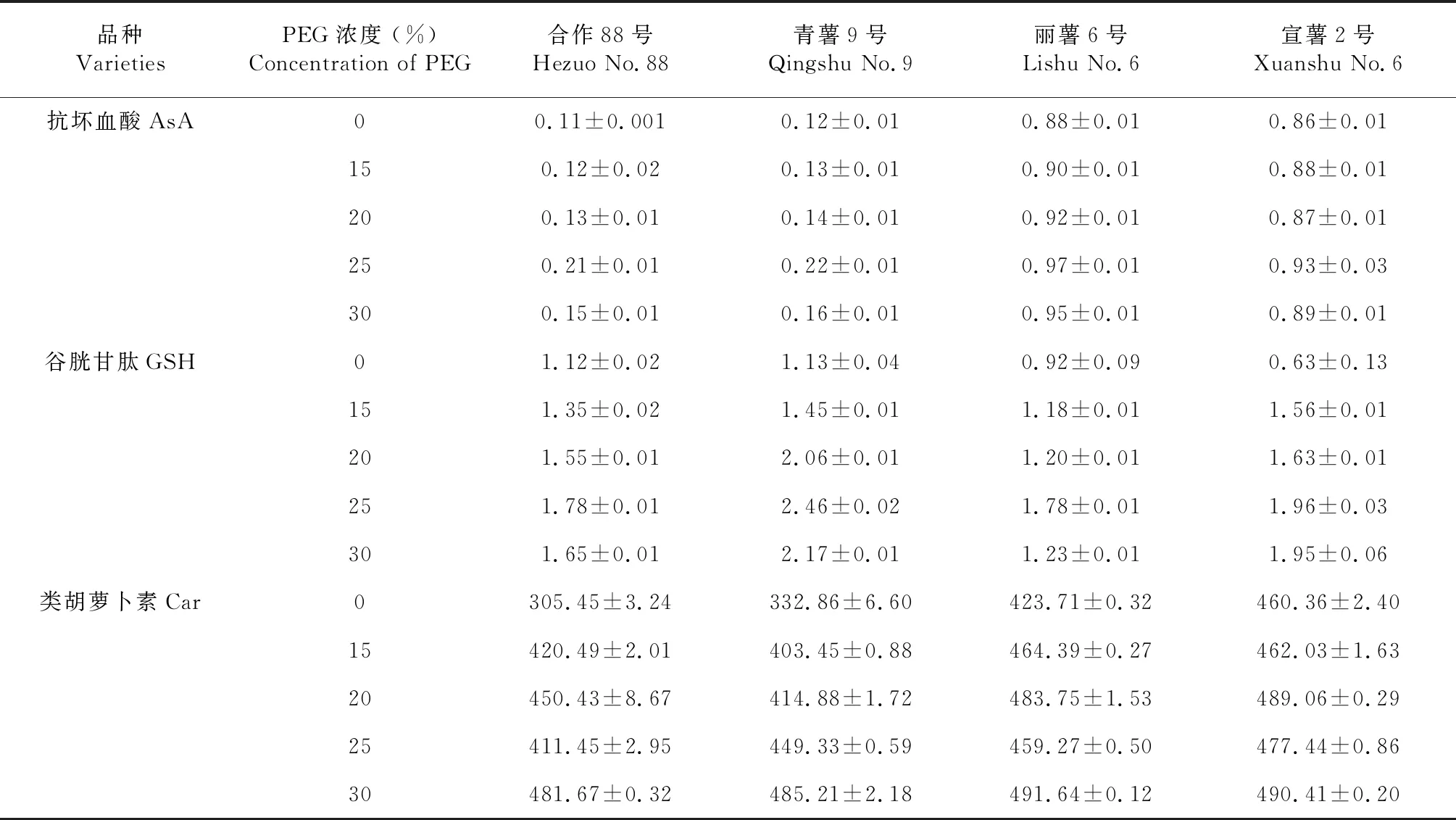
表1 干旱胁迫下马铃薯幼苗期叶片非酶性抗氧化物含量
3 讨 论
3.1 干旱胁迫造成马铃薯叶片中过氧化氢含量上升
干旱是马铃薯生产中的主要限制因子,干旱胁迫下,植物体内活性氧动态平衡被破坏,大量活性氧和自由基积累。过氧化氢(H2O2)具有较强的氧化性,可直接氧化一些酶类的疏基,使酶失去活性;还可与超氧阴离子反应生成破坏性更强的单线态氧,对植物的生理活动产生严重影响[5-7]。本研究发现,随PEG浓度的增加,马铃薯叶片内过氧化氢含量呈逐渐上升趋势,表明干旱胁迫下马铃薯受到氧化胁迫,且干旱程度越大,氧化胁迫程度越明显,这与刑更生研究山黧豆幼苗中H2O2等含量的变化结果一致[18]。本研究还表明,不同马铃薯品种在干旱胁迫下受到的氧化胁迫程度有异,其中在干旱胁迫下合作88号马铃薯叶片内过氧化氢积累量高于青薯9号、丽薯6号和宣薯2号,表明合作88号马铃薯品种对干旱胁迫具有较强的耐受性。
3.2 干旱胁迫下马铃薯叶片中的可溶性蛋白含量发生变化
植物在干旱胁迫下会增加渗透调节物质的含量以维持植株的正常生长发育,可溶性蛋白作为植物体内主要的渗透调节物质,在植物应对干旱胁迫时可以维持植物与环境的渗透平衡[15,17]。干旱胁迫下,植物可溶性蛋白含量升高或降低均有研究报道[19-20],本研究中可溶性蛋白含量随干旱胁迫程度的增加呈现出先升高后降低的变化趋势,PEG浓度 25 %处理,马铃薯叶中可溶性蛋白含量最高,相比PEG浓度 0 %(CK),丽薯6号变幅最大,合作88号变幅最小,这与陈浩维等研究玫瑰花瓣的结果一致[21]。说明在干旱胁迫时,不同的马铃薯品种可通过增加叶片中可溶性蛋白的合成调节细胞渗透压,以维持植物正常的生理活动及生长发育,但不同马铃薯品种间存在差异。
3.3 马铃薯叶片中非酶性抗氧化物质对干旱胁迫产生积极响应
抗坏血酸(AsA)、谷胱甘肽(GSH)、类胡萝卜素(Car)均为植物逆境条件下重要的非酶性抗氧化剂,对植物清除活性氧起到了至关重要的作用[22]。AsA在植物体内共有4条合成途径和一条再生途径,其中再生途径是植物体清除活性氧的主要途径,不仅能够作为APX的底物清除H2O2,还可作为抗氧化剂,歧化H2O2,还原超氧阴离子,猝灭单线态氧。本研究表明,随干旱胁迫程度的增加,马铃薯叶片中AsA呈先上升后下降的变化趋势,但均明显高于对照,这与郑清岭[23]等人报道的沙芥的研究结果相一致。GSH和AsA均为植物体内高丰度小分子抗氧化物质,能直接清除活性氧,也可通过AsA-GSH循环清除H2O2,本研究结果表明GSH的变化趋势与AsA类似。类胡萝卜素是氧化胁迫下,能保护叶绿体免受伤害的一类非酶性抗氧化剂,本研究发现,类胡萝卜素含量在轻度干旱胁迫(PEG浓度15 %)时含量上升,中度干旱胁迫(PEG浓度20 %~25 %)含量略有下降但仍高于对照,重度干旱胁迫(PEG浓度30 %)含量上升。前人研究中发现,干旱胁迫下,植物体的类胡萝卜素含量变化趋势不尽相同,含量升高、含量降低、先升高后降低、先降低后升高的结果均有报道[16,24]。Car变化趋势不一致的原因可能是由于植物抵御干旱胁迫的能力不同,叶绿体损伤程度不同,从而导致Car变化不一致,物种和品种间差异较大。
3.4 干旱胁迫下马铃薯叶片中各抗氧化酶活性发生不同程度变化
抗坏血酸过氧化物酶(APX)、脱氢抗坏血酸还原酶(DHAR)、单脱氢抗坏血酸还原酶(MDHAR)、谷胱甘肽还原酶(GR))、谷胱甘肽过氧化物酶(GPX)是植物体内AsA-GSH循环中的关键酶,在干旱胁迫下,对植物清除H2O2具有重要作用[25-26]。APX和DHAR、MDHAR是AsA再生途径的关键酶,APX以AsA为电子供体催化H2O2分解形成H2O和O2,减轻对植物的伤害,DHAR则利用GSH作为电子供体,将对植物有害的DHA还原为AsA,从而起到清除H2O2再生AsA的作用,MDHAR与DHAR和GSH共同协调作用维持植物体内AsA水平[26]。GR作为重要的抗氧化酶类,其主要作用是将氧化型谷胱甘肽还原为GSH,从而促进AsA-GSH循环,清除植物体内过量的H2O2,降解氧化物起到对植物的保护作用。GPX在抗氧化防御系统中主要起到清除脂类和烷基过氧化物的作用,也可与GSH协同清除H2O2。
有研究报道表明,随干旱胁迫强度的增加和时间的延长,植物体内对APX、MDHAR、DHAR、GPX、GR活性变化不同,如大豆、玫瑰、水稻等植物在中度干旱胁迫时APX、DHAR、GPX活性最强,MDHAR活性随干旱胁迫程度增大而升高或无明显变化[14,20-21]。本研究发现,随干旱胁迫程度增加,4个马铃薯品种叶片中的APX、GR和DHAR均有不同程度的上升,而MDHAR在胁迫程度较低,即PEG浓度为15 %和20 %时,含量低于对照,之后随胁迫程度上升,含量上升并显著高于对照。究其原因,可能在轻度干旱胁迫时,APX、DHAR和GR即起到清除过氧化氢的作用,但对MDHAR有一定抑制作用,所以MDHAR含量低于对照,但重度干旱胁迫时,MDHAR参与到清除过氧化氢的过程中,所以含量上升。因此,各种酶类在不同植物中的协同防御干旱的生理机制还值得进一步探究。
4 结 论
在干旱胁迫下,马铃薯通过抗氧化防御系统对干旱胁迫及时作出响应,其体内各类抗氧化酶及非酶性物质相互协调发挥作用,从而维持其正常生长发育。随干旱胁迫程度增加,马铃薯叶片中H2O2含量持续增加,抗氧化防御系统受激发,APX、GPX和DHAR的活性增加,马铃薯植株体内AsA、GSH含量上升,协同缓解干旱所造成的伤害。中度干旱胁迫时马铃薯叶片中的抗氧化酶活性最强,AsA、GSH、Car和SP的含量最高,清除H2O2能力最强。此外,合作88号马铃薯在轻度和中度干旱下适应性相对较强,较适合于干旱年份种植。
