抗凝血酶Ⅲ评价HBV感染相关慢加急性肝衰竭患者疾病进展和28天死亡率的应用价值*
2020-08-04吴晓娟赵文玲苏真珍黄珣钡袁宇珊魏彬王兰兰蔡蓓四川大学华西医院实验医学科成都610041
吴晓娟,赵文玲,苏真珍,黄珣钡,袁宇珊,魏彬,王兰兰,蔡蓓(四川大学华西医院实验医学科,成都 610041)
慢加急性肝衰竭(acute-on-chronic liver failure, ACLF)是指在慢性肝病/肝硬化基础上的急性肝损伤,起病急,可引起多器官衰竭,短期死亡率高,预后较差[1],不同于失代偿性肝硬化及急性肝衰竭类综合征。ACLF可由多种因素引起,病情进展迅速并以伴随患者短期高死亡率为主要特点。已有研究表明,ACLF患者90 d死亡率常常超过50%[2]。因此,对患者进行早期诊断与积极治疗以降低患者死亡率是现今临床研究中关注的热点与难点。
抗凝血酶Ⅲ(AT Ⅲ)是由肝细胞合成的具有抑制凝血功能的糖蛋白,70%~80%的凝血酶由其灭活,其与凝血酶形成1∶1共价复合物而抑制凝血酶,并活化凝血因子Ⅶ、Ⅸ、Ⅹ等丝氨酸蛋白酶活性,维持机体的出凝血平衡,是人体中重要的抗凝物质之一[3]。严重肝病患者由于肝脏合成AT Ⅲ减少、消耗增多以及跨毛细血管流过率改变等原因,血浆AT Ⅲ活性明显降低,合并弥散性血管内凝血(disseminated intravascular coagulation, DIC)时降低更为显著。有学者在通过蛋白质组学方法研究ALCF患者血浆中各蛋白质组分中发现,AT Ⅲ在用于评价凝血功能状态时具有较好的诊断价值[4]。目前临床上有关AT Ⅲ指标用于ACLF患者疾病进展和预后判断的相关报道较少。本研究回顾性分析和探讨AT Ⅲ在评价HBV感染相关ACLF患者疾病进展和28 d死亡率中的临床应用价值。
1 研究方法
1.1研究对象 纳入2011年1月至2018年7月于四川大学华西医院就诊的HBV相关ACLF患者269例,HBV相关急性失代偿性肝硬化(acute decompensated cirrhosis, AD)患者178例。慢性HBV感染诊断标准:HBsAg和/或HBV DNA阳性持续6个月以上[5];ACLF诊断标准参考亚洲肝病协会标准:在慢性肝病/肝硬化基础上的急性肝损伤,表现为黄疸(血清胆红素≥5 mg/dL)和凝血障碍[国际标准化比值(INR)≥1.5或凝血酶原活动度(PTA)<40%],4周内并发腹水和/或肝性脑病,并与高28 d死亡率相关[1];AD诊断标准:肝硬化基础上发生的急性失代偿事件(腹水、肝性脑病、黄疸、静脉曲张破裂出血或细菌感染)[6],且未发生或未达到ACLF诊断标准。排除标准:合并甲肝、丙肝、戊肝等肝脏相关病毒感染及合并HIV、梅毒等患者;合并肝脏及肝外相关肿瘤患者,合并肝脏相关其他疾病(如酒精性肝炎、自身免疫性肝炎、药物性肝炎等)患者;妊娠或哺乳期妇女;临床信息或实验室信息不全者。以上患者均未使用人工肝治疗,主要采用对症治疗和抗病毒治疗,其中11例AD患者在住院期间发生ACLF。所有患者均进行28 d内的死亡情况随访。
1.2器官衰竭定义 各器官衰竭定义依据文献[7]:肝衰竭指血清总胆红素(T-Bil)≥12 mg/dL;凝血功能衰竭指标INR≥2.5或血小板计数(PLT)≤20×109/L;脑衰竭为肝性脑病Ⅲ级及以上;肾脏衰竭指血肌酐(Cr)≥2.0 mg/dL或使用肾脏替代疗法;循环衰竭指平均动脉压<60 mmHg或使用多巴胺、特利加压素等治疗;呼吸衰竭指SpO2/FiO2≤200。
1.3信息收集 回顾性收集患者临床信息、患者入院时和治疗5 d后实验室指标,包括T-Bil、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总蛋白(TP)、清蛋白(Alb)、Cr、半胱氨酸蛋白酶抑制剂C(CysC)、白细胞计数(WBC)、血小板计数(PLT)、纤维蛋白原(Fib)、D-二聚体(DD)、AT Ⅲ、INR、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)等。
1.4方法 T-Bil采用钒酸盐法检测(日本和光试剂),ALT、AST和Cr采用酶法检测(Roche公司试剂),TP采用双缩脲法检测(Roche公司试剂),Alb采用溴甲酚绿法检测(Roche公司试剂),CysC采用胶乳免疫比浊检测(迈克公司试剂),以上项目均在Roche cobas c702生化分析仪上检测。WBC和PLT采用阻抗法在Sysmex XN 9100分析仪上用Sysmex公司试剂检测。Fib、DD、APTT和TT均采用凝固法检测(Siemens公司试剂),AT Ⅲ采用发色底物法检测(Siemens公司试剂),以上凝血项目均在CS5100血凝仪(Sysmex公司)上检测。
1.5统计学分析 用SPSS 23.0和MedCalc 11.4软件进行数据处理。正态分布的计量资料用均值±标准差描述,两组间差异比较采用t检验;非正态分布的计量资料用中位数与四分位数[M(P25,P75)]描述,两组间差异比较采用秩和检验Mann-WhitneyU法;计数资料比较用χ2检验或Fisher′s确切概率法;ROC曲线分析各凝血指标鉴别ACLF和AD的临床价值或确定基线AT Ⅲ活性在预判ACLF患者28 d生存与否的最佳界值;用Kaplan-Meier法绘制ACLF患者28 d存活率的生存曲线,各组间生存率比较采用Log-Rank法;相关性分析用Spearman秩相关分析;用MedCalc 11.4 软件分析各指标的ROC曲线下面积(AUCROC)鉴别诊断能力的统计学差异。以P<0.05为差异有统计学意义。
2 结果
2.1纳入患者临床特征分析 两组患者间年龄差异无统计学意义。实验室指标、器官衰竭类型及28 d死亡率分析见表1。ACLF组患者肝脏功能、肾脏功能、凝血功能等明显低于AD患者,其终末期肝脏评分、中性粒细胞/淋巴细胞比值、慢性肝脏衰竭评分明显高于AD组。在器官衰竭方面,AD并发各种器官衰竭的占比明显低于ACLF患者。ACLF组短期死亡率显著高于AD组。
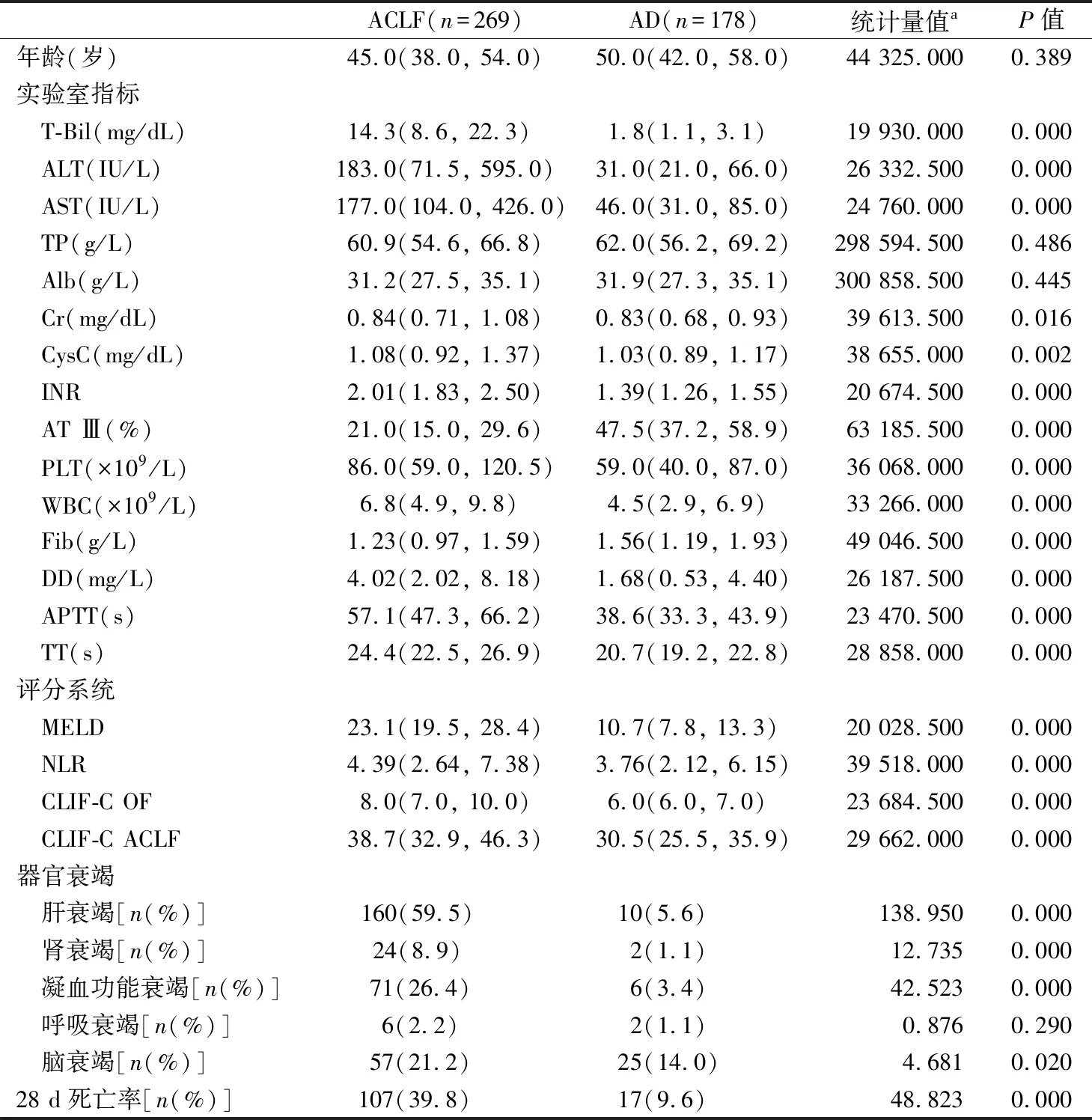
表1 患者临床基线资料分析
2.2AT Ⅲ在急性失代偿性肝硬化和ACLF中的鉴别诊断价值 分析患者基线数据发现,在AD生存组、AD死亡组、ACLF生存组、ACLF死亡组中,AT Ⅲ的活性逐渐降低,INR、APTT和TT逐渐延长,见表2。AT Ⅲ鉴别诊断AD和ACLF的AUCROC为0.906,仅次于INR(AUCROC=0.938),见图1。178例AD患者中,有11例进展为ACLF,其AT Ⅲ基线水平显著低于未发生ACLF的167例患者[36.2%(22.7%,49.3%)vs 47.8%(38.3%,61.4%),P=0.021]。
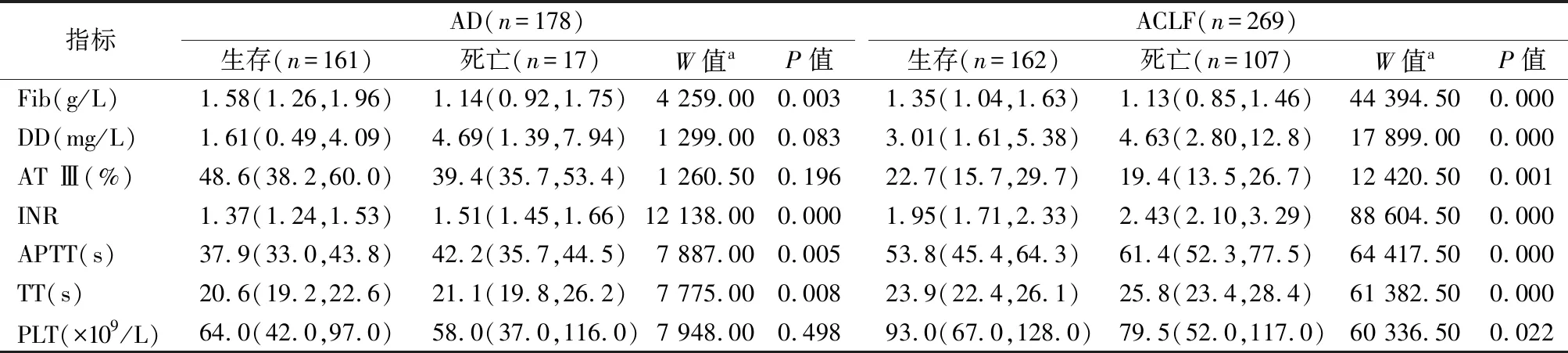
表2 凝血指标在失代偿性肝硬化与慢加急性肝衰竭患者生存组与死亡组中的比较
2.3ACLF患者AT Ⅲ与疾病严重程度的相关性分析及28 d死亡率分析 在ACLF患者中,AT Ⅲ活性与MELD评分(rs=-0.344,P=0.000)、CLIF-C ACLF评分(rs=-0.311,P=0.000)、CLIF-C OF评分(rs=-0.315,P=0.000)呈负相关。AT Ⅲ活性在凝血功能衰竭及肾衰竭患者中显著降低,见图2。根据ROC曲线的约登指数确定患者基线AT Ⅲ活性在鉴别诊断ACLF患者28 d生存与否的最佳临界值为20.1%,将患者分为AT Ⅲ≥20.1%组(151例)和AT Ⅲ<20.1%组(118例),Kaplan-Meier生存分析显示,AT Ⅲ≥20.1%组的ACLF患者28 d平均生存时间为22 d,AT Ⅲ<20.1%组患者的平均生存时间为17 d,两组间差异具有统计学意义(Log-Rankχ2=10.894,P=0.001)。见图3。进一步对ACLF患者治疗5 d后AT Ⅲ活性与28 d死亡率分析结果显示,治疗5 d后28 d死亡组患者AT Ⅲ活性较存活组明显降低[17.8%(12.6%,25.2%) vs 22.6%(18.1%,30.9%),P=0.020]。
3 讨论
ACLF是一类在慢性肝脏疾病基础上并发急性肝脏损伤或多器官衰竭的疾病,短期死亡率高,预后较差,是临床治疗面临的难题[8]。对ACLF患者早期、准确的诊断是确保患者获得更积极治疗的前提,进而可以降低患者短期死亡率并提高患者生存质量。由于多数凝血酶及凝血因子在肝脏合成,肝脏是维持机体出凝血平衡的重要器官,因此,关注凝血系统中各项凝血因子的变化在早期诊断ACLF以及评价患者预后的作用显得尤为重要。
本研究结果提示,随着肝脏疾病的逐渐进展,AT Ⅲ的活性逐渐降低,由于肝细胞是合成AT Ⅲ的主要场所,当肝细胞严重受损时,AT Ⅲ的活性进一步降低,同时体内的炎症环境促进胰蛋白酶对AT Ⅲ活性的抑制作用,使AT Ⅲ的半衰期降低至约20 h[3,9],导致机体AT Ⅲ活性严重不足。本文结果显示,检测患者外周血AT Ⅲ活性用于鉴别AD与ACLF具有较高价值(AUCROC=0.906)。该结果与Zhou等[4]研究结果一致,提示AT Ⅲ活性水平是具有评估肝脏疾病进展价值的潜在实验室指标之一。本研究还显示,入院时未发生ACLF但AT Ⅲ基线水平较低的AD患者,入院后发展为ACLF的风险更高。AT Ⅲ是反映凝血功能是否紊乱的重要指标,AT Ⅲ活性随着疾病的进展而降低,器官损伤的加重可促进凝血系统-抗凝系统的消耗,进一步激活纤溶系统,极易伴发DIC[3]。因此,我们初步认为,对于AT Ⅲ活性低但尚未诊断为ACLF的患者,在密切关注病情进展的同时应动态监测AT Ⅲ水平,该指标的变化可协助临床医生判断是否需要及时纠正AT Ⅲ水平以利维持凝血功能平衡。
本研究数据显示,在ACLF患者中,AT Ⅲ活性水平与评估患者不良预后的评分系统均呈负相关,在合并凝血功能衰竭或肾脏功能衰竭患者中AT Ⅲ活性水平显著降低。本研究通过生存曲线分析结果提示,患者入院AT Ⅲ活性的基线水平与患者短期生存率相关,当患者AT Ⅲ≥20.1%时,28 d生存率显著高于AT Ⅲ<20.1%的患者。动态观察患者治疗5 d后AT Ⅲ活性水平变化发现,AT Ⅲ活性低的ACLF患者仍然具有短期死亡的高风险,提示AT Ⅲ活性可用于评估HBV感染相关ACLF患者短期(28 d)死亡风险,AT Ⅲ活性越低ACLF患者28 d生存率越低。AT Ⅲ活性也与机体多器官功能状态密切相关。既往的研究表明,AT Ⅲ是评价肝脏合成功能的重要指标之一,不仅可以作为肝癌术后肝脏是否发生失功能的重要指标,也是预测肝硬化患者是否发生肝性脑病的实验室指标之一[9]。另外研究显示AT Ⅲ的抗炎作用还表现出一定的肾脏保护作用,在缺血再灌注损伤模型中,AT Ⅲ基因敲除小鼠呈现出更严重的肾脏功能受损,外源给予AT Ⅲ能减轻肾脏的缺血再灌注损伤并减少促炎型巨噬细胞的渗出,起到减轻肾脏损伤的保护性作用[10-11]。在心脏外科手术中,低AT Ⅲ患者进展为急性肾损伤的风险增高[12-13]。本研究结果提示ACLF合并肾脏衰竭的患者AT Ⅲ活性更低,推测肝脏损伤所致AT Ⅲ降低和肾损伤所致的AT Ⅲ丢失也可能进一步共同促进和加重了ACLF患者肾功能衰竭。
目前ACLF患者的诊断标准还未统一,不同标准关注焦点不一样,亚洲肝病协会的定义主要关注肝脏功能和凝血功能是否紊乱,而欧洲肝脏研究学会的标准主要关注肾脏功能是否发生减退及患者器官衰竭的个数。对于ACLF患者预后评估目前常用MELD(终末期肝病模型)、CLIF-C OF(慢性肝衰竭器官衰竭评分)和CLIF-C ACLF(慢性肝脏衰竭-慢加急性肝衰竭评分)等模型评分系统进行短期生存率评估,由于评分系统涉及多个指标,在提高预后评估灵敏度的同时也增加了临床应用复杂程度和时间。AT Ⅲ不仅作为参与凝血功能稳定的重要调节蛋白,也有研究表明AT Ⅲ表达水平与肝脏合成功能、肾脏功能及炎症反应相关[10,14-16]。我们认为AT Ⅲ在涉及多器官损伤的ACLF患者中发挥重要作用。考虑研究中样本量有限,本研究着重对AT Ⅲ因素在ACLF患者预后及AD患者疾病进展的临床应用价值进行评估,暂未对多因素模型进行分析和讨论。
本研究结果的重要性旨在提示基线水平AT Ⅲ的活性不仅可以作为临床医生鉴别诊断ACLF和AD的重要指标,同时可以作为评估ACLF患者短期死亡风险的重要指标之一,密切监测ACLF患者血浆AT Ⅲ活性有助于对疾病进展的准确评估,也有助于协助指导ACLF患者的临床治疗,但是由于本研究属于小样本的回顾性分析,且尚缺乏更多的文献或理论支撑,因此还需要通过大样本的队列研究数据进一步验证。
