发光铜基金属有机骨架在四环素类抗生素检测中的应用研究
2020-08-03汪嘉炎李文英
汪嘉炎 李文英
(1.宁波大学 材料科学与化学工程学院,浙江 宁波 315211;2.宁波大学 医学院,浙江 宁波 315211)
0 引言
四环素类抗生素(TCs)是广谱抗生素,对革兰氏阴性菌、革兰氏阳性菌、衣原体、支原体、螺旋体和放线菌都有较强的作用,因此被广泛用于水产养殖和畜牧业[1,2].过度使用TCs可能会导致食品和环境中存在抗生素残留,长期摄入残留四环素的食物会严重威胁人类健康,包括出现抗生素耐药性,过敏反应,肝脏和牙齿损害等[2,3].欧盟和美国食品药品监督管理局公布的食品中允许的四环素类抗生素的含量最大值为分别为225 nM和676 nM,中国标准为100 μg·mL-1与欧盟标准一致.因此,对环境及畜牧业产品中的四环素进行监测具有重要的意义.
目前,已经报导的用于TCs检测的方法包括高效液相色谱法[4,5]、质谱分析法[6,7]、免疫法[8,9]、电泳法[10,11]和微生物法[12,13]等.然而,上述方法仍有一些缺点,例如质谱分析仪价格昂贵,高效液相色谱法比较费时,而免疫法和微生物法样品制备较为复杂[14,15].荧光分析法相对操作简单、响应时间快、灵敏度高,且易于设计成试纸条,因此,很多研究者致力于发展可应用于四环素检测的荧光分析方法[16,17].
四环素能够淬灭发光材料的荧光,因此许多检测四环素的荧光分析方法都是基于合成新颖的荧光纳米材料,目前已经报道的可以用于四环素检测的荧光材料有量子点[18,19]、碳点[20,21]、荧光共轭聚合物[22,23]以及荧光金属有机骨架[24-26]等.金属有机骨架材料(MOF)是一类由金属离子与有机配体组成的化合物,由于它具有比表面积大、化学组成可调、孔结构可控、化学性质稳定和制备过程简单等优点,所以受到了研究者的广泛关注[27-34].基于金属有机骨架的荧光纳米材料,其光谱和孔隙易于通过改变配体而调节,且容易进行共价修饰,因此在传感检测方面被广泛应用,已经被报道用于金属离子、硝基甲烷、气体、pH值以及温度等的检测[35-39].但是,传统的MOF通常水稳定性和水溶性都较差,不利于水体中有毒有害物质的检测.本工作以铜离子为配位金属,5-氨基间苯二甲酸为配体,合成了一种发蓝色荧光的Cu-MOF的片层结构,并利用四环素类抗生素对Cu-MOF荧光的淬灭作用,构建了一种四环素类抗生素的检测方法.
1 实验部分
1.1 实验材料与仪器
硝酸铜、5-氨基间苯二甲酸、各种金属盐溶液、头孢购于上海阿拉丁试剂有限公司.土霉素(OTC),金霉素、强力霉素(DOXC),青霉素,氨苄青霉素,以及配置缓冲液所用试剂购自生工生物技术有限公司(中国上海).所有化学药品均为分析试剂级,市售,购买后直接使用未经任何处理.
1.2 表征与测试仪器
合成的纳米材料的形貌和组成由美国扫描电子显微镜、美国Thermo Fisher ESCALAB 250Xi X射线光电子能谱仪进行分析.紫外可见吸收光谱由中国上海光谱仪器有限公司紫外可见分光光度计测量获得,荧光光谱测量仪器为日本岛津荧光分光光度计(RF-5301),荧光寿命测量仪器为法国HoribaJobin Yvon荧光光谱仪FL3-TCSPC.
1.3 发光Cu-MOF的合成
将0.2 g PVP充分溶解于4 mL乙醇和4 mL DMF,得到溶液A;将0.024 g Cu(NO3)2·3H2O和0.0054 g 5-氨基间苯二甲酸充分溶解于4 mL DMF,得到溶液B;将溶液A和溶液B混匀并超声作用20 min;然后将上述混合液转移至反应釜中升温至100 ℃并反应8 h;反应结束后离心醇洗3次,干燥后得到蓝色Cu-MOF粉末;最后称取适量Cu-MOF粉末溶于去离子水中得到0.2 mg/mL的溶液备用.
1.4 发光Cu-MOF的光谱性质
将200 μL 10 mM MOPS缓冲液(pH 7.0),60 μL 盐酸四环素溶液(储存液浓度:1 mM),不同体积Cu-MOF溶液(储存液浓度:0.2 mg mL-1)和去离子水加入到样品管中,使其总体积为2 mL.在该测试体系中,Cu-MOF溶液浓度分别为5、10、20、30、40 μg mL-1.所得测试体系在室温下孵育5 min,然后进行光谱测试.
1.5 四环素分析检测
标准曲线:将200 μL 10 mM MOPS缓冲液(pH 7.0),100 μL Cu-MOF溶液(储存液浓度:0.2 mg mL-1),不同体积的盐酸四环素溶液(储存液浓度:1 mM)和去离子水加入到样品管中,使其总体积为2 mL.在该测试体系中,盐酸四环素浓度分别为0、1、2.5、5、10、20、30、40、50、60、70、80、90、100和110 μM.所得测试体系在室温下孵育5 min,然后进行光谱测试.
选择性考察:对于干扰实验,将200 μL 1 mM干扰分析物添加到测试体系中,干扰分析物的最终浓度均为100 μM,其他条件与标准曲线测试保持一致.
实际样品检测:环境水样品测试取自宁波市甬江水(宁波大学附近支流)作为测试样品,甬江水经过简单离心处理即可进行测试.
2 结果与讨论
2.1 发光Cu-MOF的表征
合成的Cu-MOF的形貌用SEM进行了表征,如图1(a)所示.从图中可以看出,合成的Cu-MOF展示出了二维的片状结构,片状结构交错形成花状结构.这种平面结构有利于四环素与Cu-MOF之间的相互作用.X射线光电子能谱用于分析Cu-MOF的组成,如图1(b)所示,合成的Cu-MOF主要由Cu、C、N和O四种元素组成.其中C、O以及N元素来自于配体和PVP,而金属来自于参与配位的铜盐.

图1 (a)发光Cu-MOF的SEM图;(b)Cu-MOF的XPS图
发光Cu-MOF的光学性质通过紫外可见吸收光谱、荧光激发光谱和荧光发射光谱分别进行表征.如图2(a)所示,所合成的Cu-MOF材料在302 nm处具有一个明显的吸收峰;此外,根据荧光激发光谱和荧光发射光谱,Cu-MOF的最大激发波长和最大发射波长分别为318 nm和402 nm.如图2(b)所示,通过考察不同激发波长下,Cu-MOF在402 nm处所发射的荧光强度也可以发现,Cu-MOF的荧光强度是依赖于激发波长的,这表明Cu-MOF在测试体系中是均匀分布的.

图2 (a) Cu-MOF的紫外可见吸收光谱、荧光激发光谱和荧光发射光谱;(b) 不同激发波长下Cu-MOF的荧光强度
为探究pH对荧光强度的影响,依次测定Cu-MOF在pH=4-9的荧光强度,如图3(a)所示,该材料在pH=4-9的环境中,均具有较强的荧光强度,可以满足分析测试的要求,具有较好的适用范围;此外,为探究Cu-MOF的荧光强度随时间的变化,在浓度为0.01 mg mL-1,pH=7.0的情况下测定35 min,如图3(b)所示,该材料在35 min内的荧光强度基本保持不变,具有较好的稳定性,可以满足本实验的要求.

图3 (a)pH对Cu-MOF的影响;(b)Cu-MOF的荧光随时间的变化
2.2 不同浓度Cu-MOF检测性能
如图4所示,在测试体系中没有四环素时,随着Cu-MOF浓度的升高,其荧光强度也随之增长,当加入固定量四环素后,不同浓度的Cu-MOF荧光体系均出现荧光强度下降,且下降幅度基本一致,表明定量四环素对于Cu-MOF荧光的淬灭是稳定的,不随Cu-MOF浓度的变化而明显改变,说明不同浓度Cu-MOF的检测性能较为稳定,有利于实际测试应用.

图4 不同浓度Cu-MOF检测性能(测试体系四环素浓度为30 μM)
2.3 四环素检测标准曲线
在优化的检测条件下,对不同浓度的四环素进行检测.如图5(a)所示,当测试体系中没有四环素时,Cu-MOF发射蓝色荧光,发射光谱峰值在400 nm.随着四环素的加入,Cu-MOF的荧光被逐渐淬灭,且出现红移,在0-60 μM的范围内,在400 nm处的荧光发射强度持续降低.而当四环素浓度大于60 μM后,Cu-MOF荧光强度降低变缓.Cu-MOF在400 nm处荧光强度与四环素浓度在0-60 μM范围内线性相关(图5(b)),线性回归方程为F=253.59-3.108C,R2=0.997,其中C是四环素的浓度.根据空白标准偏差的三倍计算出的TCs检测的检测限为33.33 nM,这个值远低于中国、美国和欧盟标准.

图5 (a) Cu-MOF荧光发射光谱随四环素浓度增加的变化;(b) 四环素检测标准曲线
2.4 Cu-MOF荧光淬灭机理
荧光淬灭的机理具有许多可能的途径,例如静态淬灭、动态淬灭、共振能量转移(FRET)、聚集诱导淬灭效应(ACQ)、光致电子转移(PET)和内滤波效应(IFE)等.荧光的淬灭常可以由Stern-Volmer方程解释描述
F0/F=1 +KSVcq=1 +Kqτ0cq,
(1)
其中F0和F分别为荧光测试体系中不存在四环素与存在四环素时的荧光强度,cq为测试体系中四环素的浓度,KSV是动态淬灭常数,Kq是淬灭常数,而τ0是Cu-MOF的荧光寿命.如图6(a)所示,线性检测范围的F0/F与cq呈现出良好的线性关系,经计算得KSV为0.03818 μM-1.图6(b)得到τ0为4.278 ns,计算得Kq为8.925×1012M-1S-1,因此是静态淬灭.图6(b)显示,Cu-MOF溶液加入四环素后,荧光寿命不变,也说明Cu-MOF的荧光淬灭的本质为静态淬灭.

图6 (a)F0/F与四环素浓度的线性关系;(b)Cu-MOF荧光体系在有无四环素时荧光寿命
利用紫外可见吸收光谱,我们对Cu-MOF的淬灭机理进行了进一步的探究.如图7(a)所示,四环素吸收光谱与Cu-MOF吸收和发射都有重叠,对应荧光淬灭可能的机理为IFE和FRET,而加入四环素后Cu-MOF荧光寿命不变,所以我们认为可以排除FRET淬灭机理,即IFE在Cu-MOF的淬灭中占主导作用.为了探究IFE在Cu-MOF的荧光淬灭过程中的作用,我们使用以下公式(2)对荧光进行校正
Fcorr/Fobs=10(A(ex)+A(em))/2,
(2)
其中Fobs是测量得到的荧光强度,Fcorr是从Fobs去除IFE影响后的荧光强度,A(ex)和A(em)分别为Cu-MOF溶液测试体系在激发波长(318 nm)和发射波长(402 nm)处的吸光度.对荧光强度进行校正后,我们分别计算了校正前后的荧光抑制效率,如图7(b)所示,在Cu-MOF荧光的淬灭中,IFE起到主要作用,因此Cu-MOF荧光淬灭机理的主要为IFE.

图7 (a)四环素吸收光谱与发光Cu-MOF激发和发射光谱的重叠;(b)添加不同浓度TC后Cu-MOF的荧光抑制率,Eobs=1- Fobs/F0,obs,Ecorr=1-Fcorr/F0,corr,F和F0分别是存在和不存在TC时的荧光强度
2.5 选择性考察
我们考察各种金属离子(K+、Ca2+、Na+、Mg2+、Cu2+、Fe3+、Pb2+、Hg2+)、四环素类抗生素(金霉素、土霉素、强力霉素)以及其他类抗生素(青霉素G、链霉素、氨苄青霉素、头孢噻肟钠)对发光Cu-MOF荧光传感体系的影响,Cu-MOF在400 nm处的荧光变化如图8所示.加入四环素、土霉素、金霉素、强力霉素等四环素类抗生素后,Cu-MOF的荧光淬灭程度都较高,而其他干扰物的加入对Cu-MOF的荧光较小.值得一提的是,在众多的依赖于对发光纳米材料荧光的淬灭而构建的分析方法中,Cu2+、Fe3+、Pb2+、Hg2+是非常常见的淬灭剂,而在本方法中,即便加入高浓度也未见明显淬灭.由此可见,我们的方法有很好的选择性.
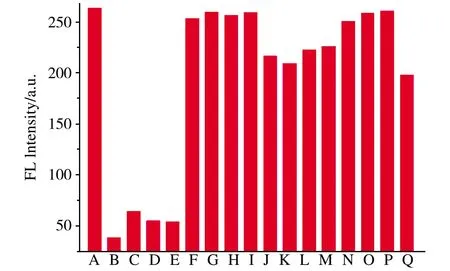
图8 选择性考察(所有干扰物质的浓度均为100 μM).A为未添加干扰物质的正常测试体系,B~Q分别是:盐酸四环素、土霉素、强力霉素、金霉素、NaCl2、MgSO4、KI、CaCl2、Cu(NO3)2、FeCl3、Pb(NO3)2、HgCl2、链霉素、青霉素、氨苄青霉素、头孢噻肟钠.
2.6 实际样品检测
为探索发光Cu-MOF体系在实际检测中的应用价值,我们将对四环素的检测扩展到河水样品中.取宁波甬江水样品,简单离心除去不溶物,并将上清液用于四环素分析.至实验发现,未加标准样品的甬江水样品不会影响Cu-MOF荧光发射强度.随后我们进行了加标回收实验,如表1所示,三组独立平行实验回收率分别为96.17%、105.02%和97.70%,相对标准偏差(RSD)分别为7.5%、5.4%和2.1%,均在合理的范围内,这证明我们的方法可以应用于实际环境水样品的检测.
3 结论
本工作利用四环素类抗生素对发光Cu-MOF荧光的淬灭作用,构建了一种四环素类抗生素含量的检测方法,并成功应用于环境水样品中四环素类抗生素的分析.本方法具有3个特点:(1) 由于引入氨基和PVP,本工作合成的Cu-MOF在水溶液中的溶解性和稳定性都更好;(2) 本方法的灵敏度高,其检测限远低于国内外规定的最大值,选择性及稳定性均较好,对常见的能够淬灭荧光的金属离子与四环素有较好的区分;(3) 此工作实现了发光Cu-MOF对环境水样品中四环素的检测,有望应用于实际分析检测中.
