羊栖菜褐藻多糖的提取及抗肿瘤活性
2020-08-03覃佑康卓民权余超鹏秦高雄
王 俊,柯 珂,覃佑康,卓民权,余超鹏,秦高雄
(1.广西化工研究院有限公司,广西 南宁 530001;2.广西科学院,广西 南宁 530001;3.广西众益生物科技有限公司,广西 崇左 532100)
羊栖菜在分类学上隶属褐藻门圆子纲墨角藻目马尾藻科马尾藻属,别称鹿角尖、羊奶子,日本称其为“长寿菜”。马尾藻含有人体所需的18种重要的氨基酸,富含对人体有益的多糖、蛋白质和微量元素,在抗氧化、抗肿瘤、增强免疫力、抗衰老、促进骨骼生长、降血糖、抗凝剂、抗病毒、抗衰老等方面有着至关重要的作用。但是日本学者发现马尾藻中重金属的积累量,尤其是砷的含量比较高,所以食用前要做一定的预处理[1]。
本文就羊栖菜中多糖的提取及抗癌活性进行讨论,期望在羊栖菜多糖的提取和抗癌机理的研究等方面提供一定的参考。
1 羊栖菜多糖
羊栖菜多糖主要包括海藻酸、褐藻多糖、褐藻淀粉、膳食纤维等。李生尧课题组[2]在人工培育羊栖菜的过程中发现,野生羊栖菜的褐藻胶、褐藻多糖胶、褐藻淀粉的含量,均高于人工培育的羊栖菜。羊栖菜多糖的水解产物可用气相色谱法或高效液相色谱法进行检测。已有研究证明,丝状多糖包含岩藻糖、半乳糖、甘露糖、葡萄糖、木糖、鼠李糖、葡萄糖胺、葡萄糖醛酸、半乳糖醛酸、甘露糖醛酸、古洛糖醛酸等[3]。近年来,甲基化反应(改良的函森方法)与气相色谱-质谱联用(GC-MS)检测糖链序列和多糖残基,已成为最经典、最有效的方法之一。已有课题组通过“部分降解-甲基化-气相色谱-质谱-核磁共振”过程,分析羊栖菜丝孢多糖的结构[4-5]。糖苷键的构型、支链的存在和单糖的比例,可以在早期通过高碘酸氧化或者史密斯降解等经典方法完成。利用质谱技术可以测定糖苷键的类型,在电喷雾电离(ESI)的负离子模式下,硫酸化的寡糖可以很容易地作为阴离子电离,因此可以用电喷雾电离串联质谱(ESI-MS)或电喷雾电离四极杆飞行时间质谱(ESI-Q-TOF-MS)法,分析糖苷键的类型和硫酸化寡糖的硫酸化位点。
海藻酸也称为海藻酸钠或海带胶,是单体中唯一含有羧基的多糖,位于褐藻的细胞壁中或分泌至细胞外层。β-D-甘露糖醛酸(M)和C-5差向异构体α-L-古洛糖醛酸(G)通过β-(1→4)/α-(1→4)糖苷,将海藻酸聚合为线性聚合物多糖[6],结构见图1。
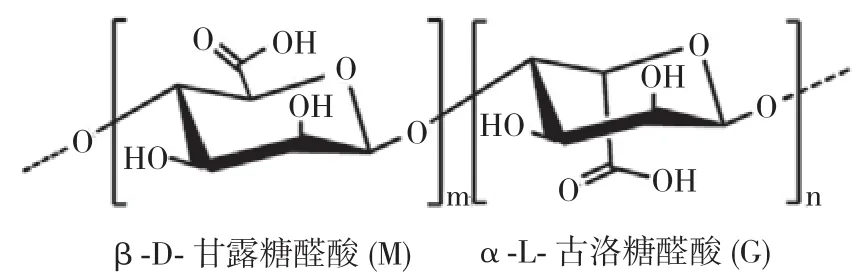
图1 海藻酸线性聚合物多糖
NMR实验表明,海藻酸中M单元和G单元的排列方式并不唯一,M嵌段和G嵌段不是单一的存在方式,还有可能是MG单元交替排列形成的MG嵌段。过菲等人[7]通过热水萃取从羊栖菜中获得粗多糖,总提取率为16.2%,总多糖中的海藻酸含量为36.2%。进一步分离纯化可得到藻酸钠,M/G比为0.75。于广利课题组对野生羊栖菜和培育羊栖菜的海藻酸含量进行了对比,发现野生羊栖菜的M/G比为0.95(1H-NMR法测定),而人工培育的仅为0.38。邹涛课题组[8]研究发现,野生羊栖菜的M/G比可以达到0.98。其中原因,可以归结于羊栖菜的原料种类、生态环境和收获季节的不同,使得两种不同的糖醛酸具有不同的键和比例,从而对其生物特性产生很大的影响。除此之外,测定方法也会对结果造成影响。一般的测定方法有NMR光谱法、IR法、CD法和HPLC法等,不同的测定方法得到的实验结果也有差异。海藻酸具有强水溶性,高稳定性,无毒,较好的凝胶性质、黏度和生物相容性等,这些理化特性使得海藻酸广泛应用于伤口敷料、药物缓释载体等制药领域,或是食品添加剂等领域。
褐藻多糖也称为硫酸化岩藻聚糖,是一种天然的水溶性硫酸化杂多糖,存在于褐藻的间质组织或黏液基质中。褐藻多糖的成分很复杂,核心结构主要由岩藻糖、硫酸、半乳糖、鼠李糖、木糖、甘露糖、糖醛酸等组成。目前仅发现了其高纯度化合物的结构,但岩藻聚糖的整体结构仍不清楚。
宁亚净[9]采用柱色谱法,从粗制的羊栖菜多糖中提取和纯化褐藻多糖,获得了主链通过L-岩藻糖与α-(1→3)糖苷键连接,并通过α-(1→4)糖苷键部分连接,可能在第2位或第4位上带有1个或2个硫酸根的核心重复单元→3)-α-L-Fucp-(1 → 3,4)-α-L-Fucp-(2/4-OSO3−)-(1 → (图 2),由岩藻糖、半乳糖、甘露糖、葡萄糖、木糖、鼠李糖组成。黄陈刚课题组[10-15]分离出岩藻多聚糖(SFPS65A),占总糖的67.5%,硫酸基17.5%,糖醛酸41.1%,蛋白质5.2%,分子量90 kDa。SFPS65由岩藻糖、半乳糖、甘露糖、葡萄糖、木糖、鼠李糖、葡萄糖醛酸组成,比例 为 19.23∶9.58∶6.64∶1∶6.52∶2.57。SFPS65A的主链由→ 3)-α-L-Fucp-(1→ 3,4)-β-L-Fucp-(1→的重复单元构建。其他课题组也得到了不同的重复单元。在不同的提取条件和水解条件下,羊栖菜多糖片段的组成和结构存在明显差异。由于其纯度高,研究者对该结构进行了大量研究,确定其主要成分为岩藻糖和硫酸盐基团,但是总体结构尚不清楚。褐藻多糖的生物活性随分子量、硫酸盐含量和硫酸盐位置等的不同而不同。
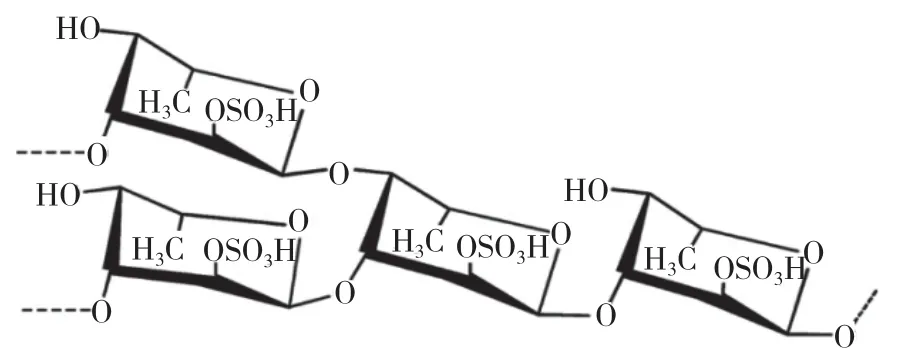
图2 褐藻多糖的核心重复单元
褐藻淀粉是羊栖菜中的一种小分子中性多糖,也被称为海带多糖、海带淀粉。它具有可溶形式和不溶形式,其功能类似于植物淀粉。张全斌课题组从粗制羊栖菜多糖中提取可溶性褐藻淀粉(HFS-1),平均分子量为3600kDa,总提取效率为0.25%。甲基化分析结果表明,HFS-1由非还原性的末端吡喃葡萄糖(15.3%)、3联β-D-吡喃葡萄糖(66.4%)、6联β-D-吡喃葡萄糖(4.1%)及3、6联等构成β-D吡喃葡萄糖(14.2%),该甲基化分析数据与NMR数据一致。 HFS-1的假想核心结构如图3所示。吴明江课题组[16]分离了褐藻淀粉(CSFP-3),提取效率约为0.70%,分子量小于3500 kDa。CSFP-3的组成主要是葡萄糖(57.7%)、岩藻糖(30.0%)和半乳糖(12.3%)。
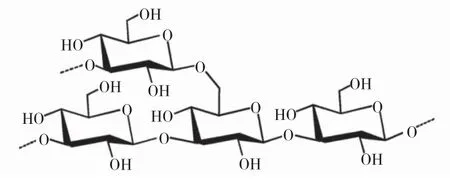
图3 褐藻淀粉的核心重复单元
羊栖菜富含膳食纤维。Lahaye[17]从羊栖菜中提取了膳食纤维,总量约为49.2%。张燕平等人[18]通过酶水解、酸和碱处理,从羊栖菜中纯化了高活性膳食纤维,总收率为26.7%。
2 羊栖菜的提取
褐藻多糖在羊栖菜丝藻多糖中具有最大的药理活性,粗多糖还含有大量的藻酸。褐藻多糖可溶于水,而藻酸不溶于水,所以从藻酸中分离褐藻糖胶,是提取褐藻多糖的重要步骤。水提取或酒精提取是羊栖菜多糖提取的常用方法,但提取时间长且产率较低。张锐等人[19]在提取过程中加入稀盐酸,在一定程度上提高了提取率。徐杰等人采用稀酸提取和乙醇沉淀的方法,得到羊栖菜岩藻聚糖硫酸酯粗品,随着洗脱盐浓度的增加,硫酸盐基团的数量增加,而糖醛酸的数量逐渐减少。值得注意的是,稀酸和稀碱在一定程度上可以提高多糖的提取率,但也会使其硫酸盐分解,进而破坏具有药理活性的多糖结构。宁亚净在85℃下采用固液比为1∶30的热水提取方法,对羊栖菜进行了2次提取(每次提取3h)。具体过程如下:在回流下用95%乙醇脱脂后,再用85℃的热水萃取3次。过滤后将其混合并浓缩,并使用80%乙醇分离沉淀物。过滤并干燥后,最终获得粗羊栖菜多糖,总提取率为20.4%。李亚娜等人[20]在提取温度为85℃时,得到的羊栖菜多糖的提取率为11.12 %。倪顺等人[21]同样利用响应面法研究了水提取羊栖菜多糖的最佳工艺:羊栖菜粉末→热水浸提→浸提液→离心→上清液→真空浓缩→无水乙醇醇析→冷冻离心→醇沉物→干燥→粗多糖,此时的提取温度为87℃,过高的温度(超过100℃)会使多糖降解,适宜的提取温度为80~90℃。丁浩淼等人[22]采用循环超声法提取羊栖菜多糖,提取率为10.54%。宋伟康等人[23]根据Box-Behnken实验设计,考察液料比、提取时间、提取温度3个工艺条件,确定了超声波辅助稀碱提取多糖的最佳工艺参数为:液料比48.56∶1、提取时间5.78h、提取温度70.91℃。与水提取相比,超声提取所需的时间更短,提取效率更高,所提取多糖的抗氧化性更好。刘洪超等人[24]探索了微波辅助水提法提取羊栖菜多糖的较优工艺条件,微波可以有效破坏细胞壁,使胞内的多糖流出,此时得到的多糖具有良好的抗氧化活性。还可以利用酶解法提取,多糖中的蛋白质可以通过Sevage方法或3%三氟乙酸(TFA))方法去除,其他小分子物质可以通过透析或超滤去除。张华芳等人[25]利用正交实验法,确定了酶解法的最佳酶量和提取温度。黄惠琴课题组[26]通过响应面法得到褐藻胶裂解酶的最适温度为50℃,中性环境下稳定,Ca2+、Mg2+和Fe2+等离子对裂解酶有促进作用,而EDTA、Ba2+、Zn2+等离子起抑制作用,为褐藻寡糖的酶解法规模制备提供了理论依据与应用参考。
提取过程中加入高浓度乙醇溶液,可以减少色素、脂质和固醇的溶解。可以采用蒽酮-硫酸法、间羟基联苯法、考马斯亮蓝法和硫酸钡比浊法,分别测量总多糖、糖醛酸、蛋白质、硫酸根的含量。
目前,应用最广泛的多糖分离和纯化的方法是柱色谱法,可以根据多糖的极性进行分离,酸性或中性组分通过DEAE-Sepharose CL-6B、DEAE-纤维素阴离子交换、DEAE-52阴离子交换得到分离,然后依据分子量的不同,通过sephadex-G系列和sephacryl-S系列得到分离,也可以通过Sephacryl S-300HR分离多糖,然后用Sephadex G-10(2种不同的凝胶过滤色谱法)洗脱。
3 药理活性
目前的报道指出,褐藻多聚糖是马尾藻中最具药理活性的成分,尤其是硫酸化多糖。已有研究证实,褐藻多糖在抗肿瘤活性、抗氧化、降血糖、抗菌、抗病毒、提高免疫力等多方面表现出了优秀的能力。不同的药理作用与多糖的分子量及硫酸盐的含量密切相关。
已有的羊栖菜多糖抗肿瘤活性的报告表明,它是通过增强机体的免疫调节,诱导肿瘤细胞凋亡,促进肿瘤抑制基因的表达和抑制肿瘤血管生成来实现的。
汲晨锋课题组[27]的实验结果表明,褐藻多糖(SFPS-B2)可以抑制人胃癌细胞SGC-7901的生长,IC50为189.30μg·mL-1。促使细胞凋亡的作用主要表现在两个方面:一方面,SFPSB2导致MPTP开放,导致Ca2+和Cyt-C释放,Ca2+的增加促进了Cyt-C从线粒体释放,释放的Cyt-C进入细胞质可激活Caspase-9,使Caspase-3酶活化,这将通过蛋白水解作用导致细胞结构破坏和功能紊乱,并最终通过线粒体途径诱导细胞凋亡。另一方面,它可以上调Bax的表达,促进细胞凋亡因子的释放,从而诱导细胞凋亡。丁侃课题组从羊栖菜中提取了藻酸(04S2P),并用氯磺酸-吡啶法,通过04S2P制备硫酸化藻酸(04S2P-S)。其抗肿瘤活性的研究结果表明,04S2P仅抑制肿瘤细胞Bel7402的增殖,而04S2P-S显著抑制肿瘤细胞Bel7402、SMMC7721和Caco-2的增殖,表现出优异的抗肿瘤活性。
佟海滨课题组[28]的研究显示,褐藻多糖(cSFF)对P-选择素介导的细胞粘附具有拮抗作用,而P-选择素在肿瘤转移中起重要作用。后来又发现,羊栖菜多糖(SFPS)可抑制人肺癌细胞SPC-A-1的增殖。在体外和体内裸鼠的肺癌细胞和异种肿瘤组织中,SFPS上调Ecadherin蛋白的表达并下调MMP2和MMP9的表达[29],这表明其具有潜在的抗肿瘤作用。陈肖鸣课题组[30]提取了褐藻多糖(SFPS)来研究其体内抗肿瘤活性。将HepG2细胞经皮下注射到小鼠体内,建立小鼠肝细胞癌模型,结果表明,SFPS显著抑制肿瘤的生长,同时促进脾脏的生长,刺激HepG2细胞的凋亡。IC50为1158.6μg·mL-1,说明SFPS是一种潜在的肝癌辅助治疗药物,可通过调节Bax和Bcl-2的表达诱导HepG2细胞凋亡,并在高浓度时具有抗肿瘤和免疫调节的活性。之后,该课题组[31]发现,在接种了鼻咽癌CNE细胞的裸鼠模型中,SFPS也显示出相似的抗肿瘤和免疫调节活性,并且该活性与TLR2/TLR4受体及p38 MAPK信号转导途径有关。
陈惠玲等人[32]初步证实,褐藻多糖(FP08S2)在体内和体外均具有显著的血管生成抑制活性。在鸡胚绒毛膜尿囊膜模型中,随着药物浓度增加,FP08S2显著抑制新的毛细血管形成,同时血管密度更低,分支更少,管道直径更细且很多结构模糊,表明FP08S2可显著抑制体外HMEC-1细胞的迁移和侵袭,并导致丝状肌动蛋白解聚。FP08S2通过抑制内皮生长因子(VEGF)的信号传递途径和转录因子的表达,阻断VEGF和VEGFR2之间的结合,并产生抗血管生成作用。此外,FP08S2是通过直接作用于A549而不是通过细胞毒性途径或诱导凋亡,来阻止裸鼠中异种A549肺癌细胞的生长和微血管形成。羊栖菜多糖在体内的抑制肿瘤作用呈现剂量依赖性,是通过阻碍相关蛋白表达进而使得细胞凋亡,而不是直接的细胞毒性造成肿瘤细胞死亡的。
此外,褐藻多糖还可以有效降低胞内单线态氧、羟基自由基等氧化活性物种的水平[33-35]。抗氧化活性取决于降解后羊栖菜多糖的活性基团以及硫酸盐基团的含量,多糖分子量的大小也直接影响其抗氧化能力。另外,羊栖菜多糖可以增强巨噬细胞的吞噬作用和自然杀伤细胞的杀伤活性,促进免疫细胞的增殖和免疫细胞分泌的细胞因子的活性,从而有效增强免疫力。在建立的小鼠模型中,小鼠的脾脏指数、胸腺指数、外周白细胞数量及胞内谷胱甘肽水平都有不同程度的提高,对免疫器官具有一定的保护作用[36-40]。褐藻多糖在降血糖[41-42]、抗凝血[43-44]、抗衰老、抗病毒[45-47]、抗菌[48-49]、抗炎[50]、抗疲劳[51]、保护皮肤方面也有重要的作用。
4 总结
羊栖菜在我国的产量很高,多作为海洋蔬菜进入市场。近些年研究者对其药理性质进行了探索,在其含有的各种成分中,褐藻多糖表现出最强的药理活性。褐藻多糖的药理活性和其硫酸化的程度密切相关,因而在提取分离过程中,如何快速并完整地提取褐藻多糖是亟需解决的问题。超声辅助法及微波法提取得到的褐藻多糖,其结构相对完整。另外,
褐藻多糖的结构仍不清楚,通过一维或二维同核(异核)NMR技术解析仍存在技术难题,目前未见到原子力显微镜(AFM)、电子顺磁共振(EPR)、X射线衍射、X射线光电子能谱(XPS)等方法在羊栖菜多糖结构分析方面的应用。充分解析羊栖菜多糖的结构,有助于理解其在发挥药理活性时的作用机理,更好地发挥羊栖菜的药用价值。
