多种无创性模型预测乙型肝炎肝硬化患者食管静脉曲张程度的价值研究
2020-08-03张东友
王 鹏,张东友
(湖北省武汉市第一医院放射科,湖北 武汉 430022)
食管静脉曲张是乙型肝炎肝硬化门静脉高压常见且较严重的并发症,食管静脉曲张破裂出血是严重威胁患者生命的急症[1-2],首次出血死亡率50%~70%,反复出血死亡率高达80%[3-4]。而食管静脉曲张的严重程度与静脉曲张破裂出血密切相关,因此早期评估食管静脉曲张严重程度至关重要。
目前确诊食管静脉曲张的金标准仍是上消化道内镜检查,但患者依从性较差,无法作为常规手段反复应用和长期随访[5-6],因此探索简便易行、准确率较高的无创性评估模型已成为肝硬化食管静脉曲张诊治急需解决的课题。食管静脉曲张的严重程度及脾脏体积与肝硬化门静脉高压密切相关,但目前与之有关的文献报道较少。本研究以上消化道内镜结果为金标准,探讨MSCT测得的脾脏体积、天冬氨酸转氨酶(AST)与血小板(PLT)比值指数(APRI),以及AST与丙氨酸转氨酶(ALT)比值(AAR)对肝硬化食管静脉曲张及其分级的诊断价值。
1 资料与方法
1.1 一般资料 选取2016年3月至2019年3月于我院就诊的慢性乙型肝炎肝硬化患者108例,男89例,女19例;年龄24~83岁,平均(50.70±10.21)岁。所有患者均于入院1周内行CT平扫和增强扫描、血常规、肝肾功能、凝血功能等常规检查,并行上消化道电子胃镜(GIF-H290)检查。根据上消化道内镜检查结果将患者分为食管静脉曲张组(A组47例)与无食管静脉曲张组(B组61例)。
1.2 纳入及排除标准
1.2.1 纳入标准 ①符合《慢性乙型病毒性肝炎防治指南(2015年版)》[7]中的诊断标准;②入院1周内均行上消化道内镜检查、CT平扫及增强扫描;③临床资料完整。
1.2.2 排除标准 ①其他肝炎病毒(甲、丙、戊和庚型病毒)感染或乙型肝炎合并其他肝炎病毒感染的肝硬化;②酒精性、非酒精性、自身免疫性、药物性及遗传代谢性等原因导致的肝炎肝硬化;③既往有脾动脉栓塞或脾脏切除手术史、行门体分流术或经颈静脉肝内门体静脉分流术(TIPS)治疗史;④乙型肝炎肝硬化合并原发性肝癌;⑤服用影响凝血机制药物者或血小板异常的其他非肝病;⑥胃底静脉曲张;⑦入院1周内未行上消化道内镜及CT检查;⑧既往有食管静脉曲张破裂出血;⑨临床资料不完整。
1.3 仪器与方法
1.3.1 脾脏体积的计算 采用Siemens Somatom Definition 64排CT行平扫和增强扫描。将CT原始图像导入后处理工作站,自上而下逐层勾画脾脏的轮廓,通过软件自动生成每层面脾脏体积,并累计测得脾脏总的体积(图1)。
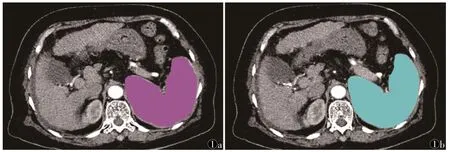
图1 Siemens后处理工作站逐层(图1a,1b为连续上下层面)勾画脾脏边缘累积获得脾脏体积
1.3.2 APRI和AAR的计算 APRI=AST/PLT,AAR=AST/ALT[8-9]。
1.3.3 食管静脉曲张分级 上消化道电子胃镜(GIF-H290)检查由内镜中心工作10年以上的主治及上医师完成。食管静脉曲张分级参照《消化道静脉曲张及出血的内镜诊断和治疗规范试行方案(2009年)》中的诊断标准[10]:轻度,食管曲张静脉呈直线或略迂曲、无红色征;中度,食管曲张静脉呈直线或略迂曲、有红色征,食管曲张静脉呈蛇形迂曲隆起、无红色征;重度,食管曲张静脉呈蛇形迂曲隆起、有红色征,食管曲张静脉呈串珠状、结节状或瘤状、有或无红色征。
1.4 统计学方法 应用SPSS 22.0软件对数据进行统计分析。计量资料以表示,计数资料用相对数表示;2组单因素分析行独立样本t检验或χ2检验;采用Spearman等级相关分析相关指标(PLT、ALT、脾脏体积、APRI、AAR)与食管静脉曲张分级的相关性;采用Medcalc 15.2.2软件分析相关指标(PLT、ALT、脾脏体积、APRI、AAR)诊断有无食管静脉曲张及其分级的临界值,并计算ROC曲线的AUC。检验水准α=0.05(双侧)。以P<0.05为差异有统计学意义。
2 结果
108例平均身高、体质量、白细胞、红细胞、血红蛋白、PLT、总胆红素、白蛋白、ALT、AST、凝血酶原时间(PT)、脾脏体积、APRI、AAR分别为(164.57±6.67)cm、(63.06±10.06)kg、(6.70±2.45)×109/L、(4.80±0.67)×1012/L、(137.81±18.29)g/L、(170.38±58.57)×109/L、(23.66±24.99)μmol/L、(30.55±5.61)g/L、(40.17±33.98)U/L、(43.25±33.55)U/L、(13.05±1.29)s、(219.54±111.69)mL、0.31±0.35、1.23±0.60。
2.1 2组临床资料比较 108例中47例(43.52%)并发食管静脉曲张,其中,轻、中、重度食管静脉曲张分别为17例(36.17%)、19例(40.43%)、11例(23.40%)。A、B 2组男女比例、身高、体质量、白细胞、红细胞、血红蛋白、总胆红素、白蛋白、AST、PT的差异均无统计学意义(均P>0.05);2组PLT、ALT、脾脏体积、APRI、AAR比较,差异均有统计学意义(均P<0.05)(表1)。
2.2 相关指标与食管静脉曲张分级的相关性比较Spearman相关性分析显示:ALT、脾脏体积、APRI与食管静脉曲张分级呈正相关(r=0.249、0.703、0.320;均P<0.05);而PLT、AAR均与食管静脉曲张分级呈负相关(r=-0.389、-0.268;均P<0.05)(表2)。
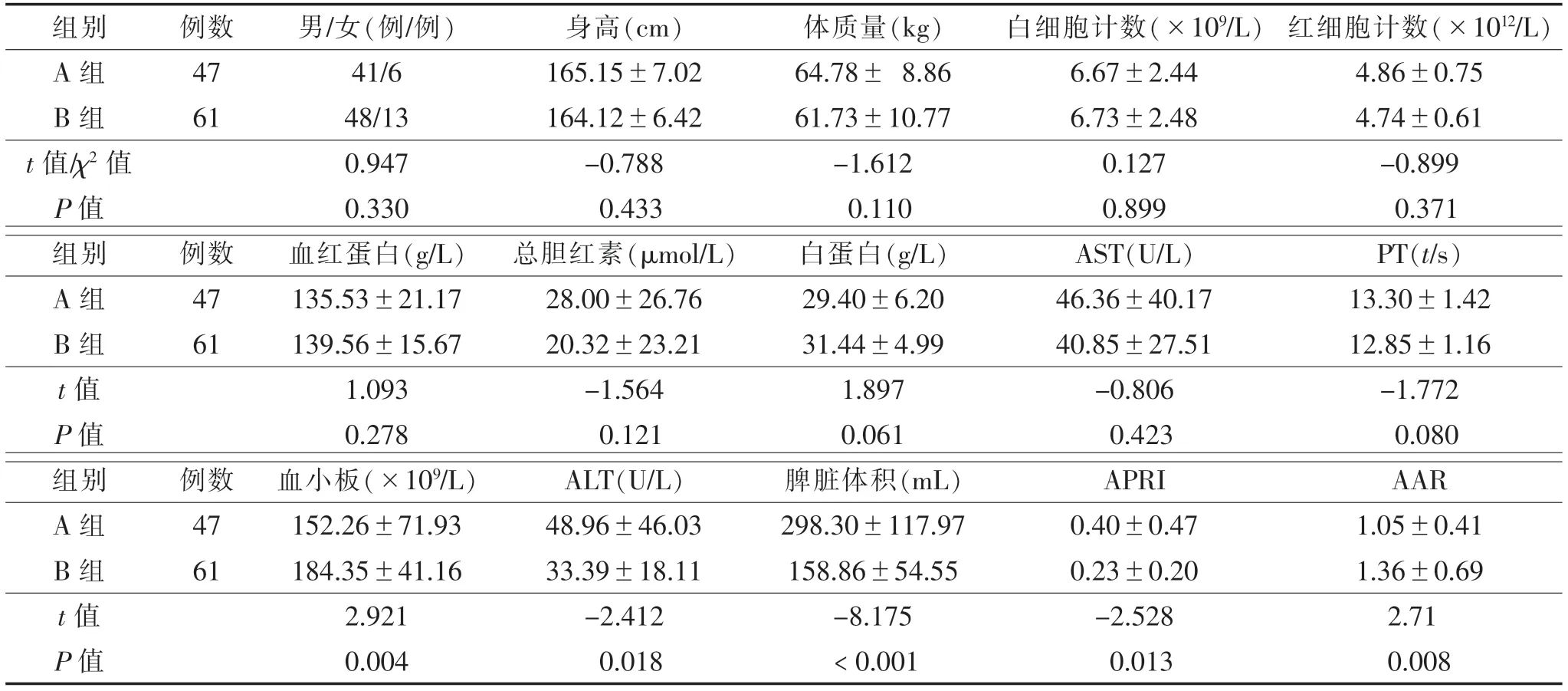
表1 2组临床资料比较
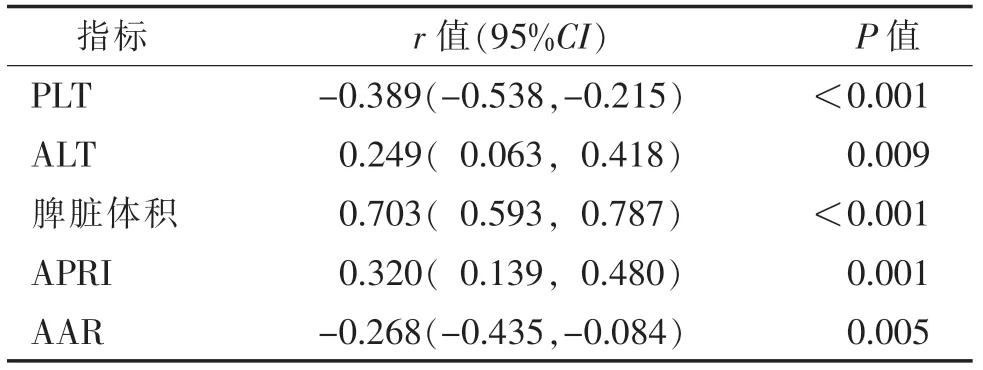
表2 相关指标与食管静脉曲张分级的相关性分析
2.3 相关指标诊断食管静脉曲张及其分级的价值效能 ROC曲线分析显示:脾脏体积能较好诊断和区分乙型肝炎肝硬化患者有无食管静脉曲张及曲张分级,PLT和APRI能诊断和区分有、无食管静脉曲张及中度食管静脉曲张,而ALT和AAR仅能诊断和区分有、无食管静脉曲张。进一步分析显示,脾脏体积分别相应诊断和区分有无食管静脉曲张、中度食管静脉曲张及重度食管静脉曲张的AUC分别为0.886、0.781、0.816(均P<0.001)(表3,图2)。
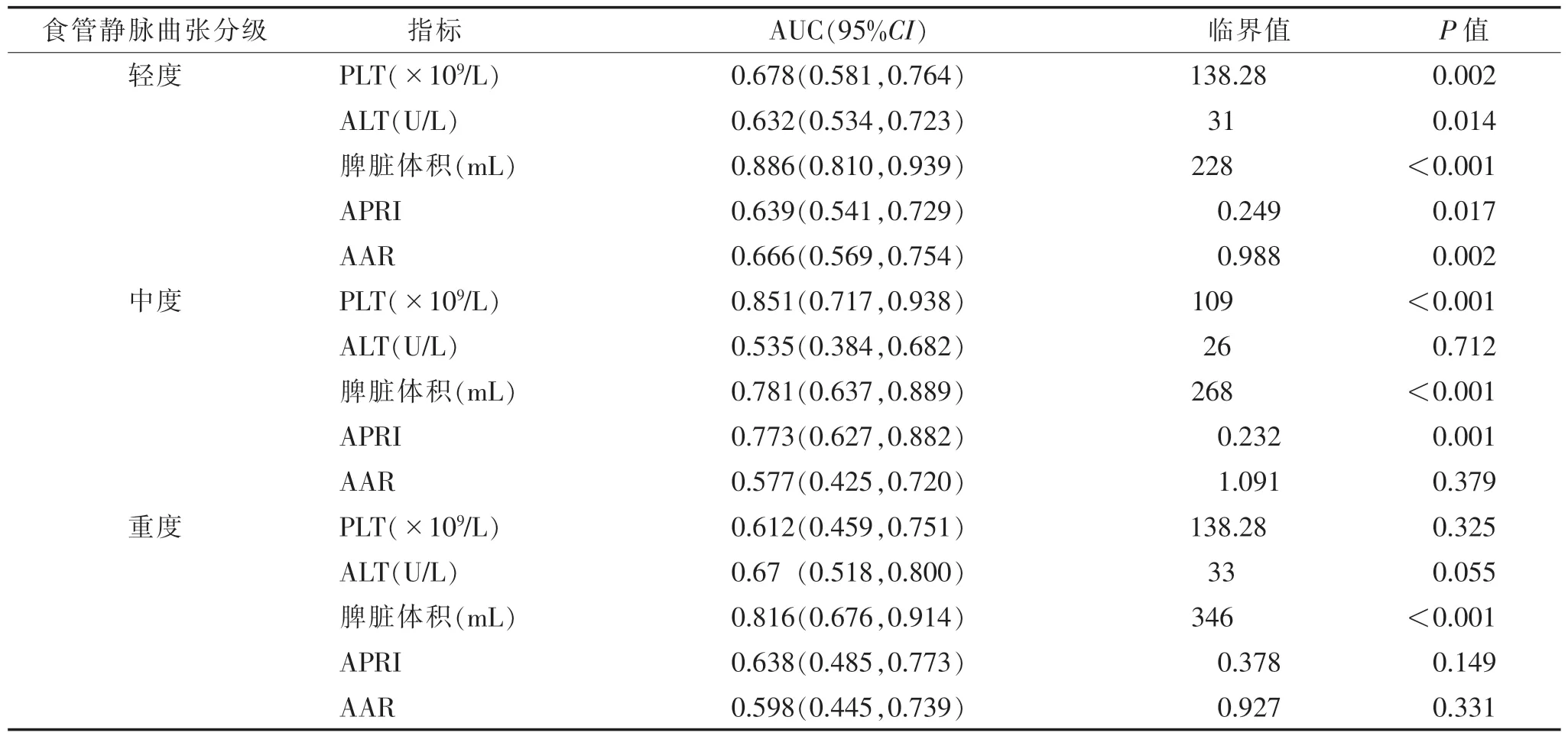
表3 相关指标诊断食管静脉曲张及其分级的价值
3 讨论
目前上消化道内镜检查是临床诊断肝硬化食管静脉曲张的金标准,但因痛苦较大,且有诱发出血风险,因此探讨简便实用、可重复性好且患者依从性好的无创性模型预测肝硬化食管静脉曲张,已成为目前临床的热点研究方向[11]。
随着计算机技术的迅猛发展和三维重建技术的广泛应用,MSCT已实现对脾脏体积的准确测量[12-14]。脾脏体积与肝硬化门静脉高压密切相关,而食管静脉曲张的严重程度也与肝硬化门静脉高压密切相关,因此从理论上讲,脾脏体积可评估食管静脉曲张的严重程度。
本研究显示,2组PLT、ALT、脾脏体积、APRI、AAR比较,差异均有统计学意义,表明PLT、ALT、脾脏体积、APRI、AAR与乙型肝炎肝硬化患者并发食管静脉曲张密切相关,与文献[15-16]报道一致。Spearman相关性分析显示,ALT、脾脏体积、APRI与食管静脉曲张分级呈正相关(均P<0.05),而PLT和AAR与食管静脉曲张分级呈负相关(均P<0.05)。原因可能是乙型肝炎肝硬化程度越重,门静脉高压也越重,继而脾功能亢进加重,导致PLT破坏越多,脾脏增生肥大的程度越高;肝硬化越重,相应的肝细胞破坏越多,血清ALT升高越明显[17-18]。
另外,脾脏体积能较好诊断和区分乙型肝炎肝硬化患者有无食管静脉曲张及曲张分级,PLT和APRI能诊断和区分有无食管静脉曲张及中度食管静脉曲张,而ALT和AAR仅能诊断和区分有无食管静脉曲张;可能的原因是肝硬化门静脉高压,导致脾脏淤血,进而增生肥大,因此脾脏体积能更好更客观反映硬化门静脉高压及食管静脉曲张的严重程度,而PLT、ALT、APRI及AAR可能受多种因素影响,如抽血时间、标本送检时间、药物治疗及肝功能情况,因此并不能真实客观反映肝硬化门静脉高压及食管静脉曲张的严重程度[19-20]。本研究显示,脾脏体积诊断和区分有无食管静脉曲张、中度食管静脉曲张及重度食管静脉曲张的AUC分别为0.886、0.781、0.816(均P<0.001),进一步表明脾脏体积能较好地诊断和区分食管静脉曲张及分级,可作为预测食管静脉曲张及其分级较稳定且无创评估指标,但该结论有待多中心大数据的进一步证实。
综上所述,PLT、ALT、脾脏体积、APRI、AAR与乙型肝炎肝硬化并发食管静脉曲张密切相关,其中脾脏体积能更好地诊断和区分乙型肝炎肝硬化患者的食管静脉曲张及其分级。
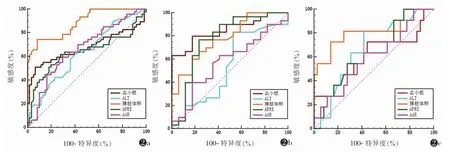
图2 相关指标诊断食管静脉曲张及其分级的ROC曲线(ALT,丙氨酸转氨酶;APRI、AAR分别为天冬氨酸转氨酶与血小板和丙氨酸转氨酶的比值)图2a 有、无食管静脉曲张图2b 中度食管静脉曲张图2c 重度食管静脉曲张
