丹参提取物抑制高糖诱导的人视网膜血管内皮细胞凋亡的机制研究
2020-08-03权联姣秦婧婧权元鼎
权联姣 秦婧婧 权元鼎
糖尿病视网膜病变(DR)是糖尿病常见的微血管并发症之一,其发病机制尚未完全明确,炎症反应、凋亡、氧化应激等与其密切相关[1-2]。丹参是一种传统的中药,具有抗炎、抗氧化、抗血栓、免疫调节等作用[3]。有关研究发现丹参及其制剂在DR的治疗过程中发挥重要作用[4-5],但其机制目前尚不清楚。本研究采用高糖处理人视网膜血管内皮细胞(HRECs)构建DR体外的细胞模型,探讨丹参提取物对HRECs凋亡的影响及其作用机制。
材料与方法
1.材料:HRECs购自美国菌种保藏中心(ATCC)细胞库;丹参购自哈尔滨市同仁堂大药房;杜氏贝科改良伊格尔培养基(DMEM)购自美国HyClone公司;胰蛋白酶、胎牛血清购自美国Gibco公司;细胞计数试剂盒(CCK-8)、二辛可宁酸(BCA)试剂盒购自碧云天生物技术研究所;膜联蛋白(Annexin)Ⅴ-FITC/碘化丙啶(PI)细胞凋亡检测试剂盒购自日本TaKaRa公司;肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β和IL-8酶联免疫吸附试验(ELISA)检测试剂盒购自南京建成生物工程研究所;剪切的含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-3兔单克隆抗体、B细胞淋巴瘤-2(Bcl-2)相关X蛋白(Bax)兔单克隆抗体、Bcl-2兔单克隆抗体购自北京中杉金桥生物技术有限公司;核因子(NF)-κB兔单克隆抗体、磷酸化NF-κB(p-NF-κB)兔单克隆抗体和辣根过氧化物酶标记的羊抗兔免疫球蛋白(Ig)G购自美国Abcam公司。
2.方法
(1)丹参提取物的制备:参照文献[6]中制备丹参提取物的方法,将丹参40 ℃烘干,粉碎成干粉,然后加入10倍水于80 ℃提取2次,每次提取30 min。过滤,弃去滤渣,合并滤液,过滤,将溶液定容至100 mL,以2 000 r/min离心10 min,上清即为丹参提取物。
(2)细胞培养方法和分组情况:将冻存的HRECs常规复苏,接种到含10%胎牛血清、5.5 mmol/L葡萄糖的DMEM培养基中,在37 ℃、5%CO2培养箱中培养,待细胞贴壁生长汇合率达80%以上时以胰蛋白酶消化进行传代培养。将对数生长期细胞分为5组,5.5 mmol/L葡萄糖培养的细胞作为对照组,30.0 mmol/L葡萄糖培养的细胞作为高糖组[7],30.0 mmol/L葡萄糖和5 μg/ml、10 μg/ml、20 μg/ml丹参提取物培养的细胞作为丹参提取物低、中、高浓度组。
(3)CCK-8法检测HRECs活性:5组细胞培养48 h后向每孔细胞中加入10 μl CCK-8溶液,在37 ℃下继续培养4 h,酶标仪检测波长570 nm处细胞光密度值(OD值),以OD值反映细胞活性。重复试验3次,取平均值。
(4)流式细胞术检测HRECs凋亡率:各组细胞培养48 h后用预冷的磷酸缓冲盐溶液(PBS)洗涤细胞,取100 μl 1×结合缓冲液重悬细胞,加入Annexin Ⅴ-FITC溶液5 μl,混匀后避光反应10 min,再加入PI染液5 μl,混匀后避光孵育20 min,最后加入400 μl 1×Binding Buffer结合缓冲液,立即上流式细胞仪测定,分析细胞凋亡率。重复试验3次,取其平均值。
(5)ELISA检测炎症因子含量:分别收集处理48 h的HRECs上清液,分别参照TNF-α、IL-1β和IL-8 ELISA检测试剂盒说明书测定TNF-α、IL-1β和IL-8的含量。重复试验3次,取其平均值。
(6)蛋白质印迹法(Western blot)检测HRECs中蛋白表达水平:5组HRECs处理48 h后,提取细胞总蛋白,使用BCA试剂盒进行定量分析。将蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳电转至聚偏二氟乙烯(PVDF)膜上,在5%脱脂奶粉中封阻2 h,TBS缓冲液加吐温(TBST)洗膜后加入一抗(Caspase-3一抗1∶500稀释,Bax一抗1∶500稀释,Bcl-2一抗1∶500稀释,NF-κB一抗1∶800稀释,p-NF-κB一抗1∶800稀释),在4 ℃下过夜杂交。TBST洗膜后再加入辣根过氧化物酶标记的二抗(1∶3 000稀释),于室温下杂交2 h,TBST洗膜后,采用电化学发光(ECL)发光液显影,转移至暗室采集图像,使用Image J软件分析条带灰度值,以甘油醛-3-磷酸脱氢酶(GAPDH)为内标,计算各组HRECs中目的蛋白相对表达水平。

结 果
1.5组HRECs活性比较:CCK-8检测结果显示,高糖组HRECs的OD值较对照组明显降低(P<0.05);与高糖组比较,丹参提取物低、中、高浓度组HRECs的OD值均依次升高(P<0.05)。见图1。
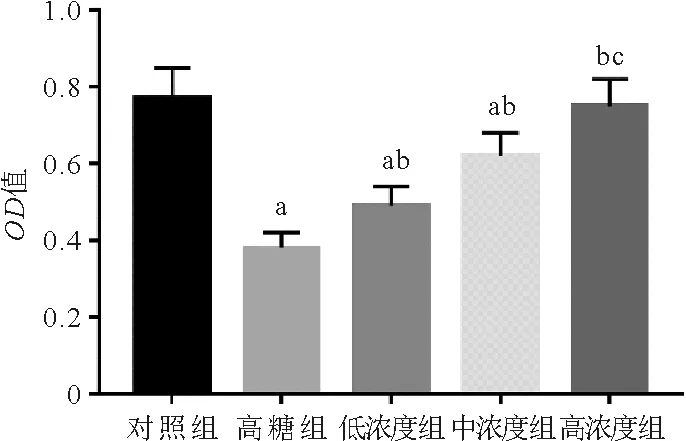
注:与对照组比较,aP<0.05;与高糖组比较,bP<0.05;与低浓度组比较,cP<0.05图1 5组HRECs的活性比较结果
2.5组HRECs凋亡率比较:流式细胞术检测结果显示,与对照组比较,高糖组HRECs凋亡率明显升高(P<0.05);与高糖组比较,丹参提取物低、中、高浓度组HRECs凋亡率均明显依次降低,各组间比较差异均有统计学意义(P<0.05)。见图2。

注:与对照组比较,aP<0.05;与高糖组比较,bP<0.05;与低浓度组比较,cP<0.05;与中浓度组比较,dP<0.05图2 5组HRECs凋亡率比较
3.5组HRECs中凋亡相关蛋白表达比较:Western blot检测结果显示,与对照组比较,高糖组HRECs中Caspase-3和Bax蛋白表达明显升高,Bcl-2蛋白表达明显下降,差异均有统计学意义(P<0.05);与高糖组比较,丹参提取物低、中、高浓度组HRECs中Caspase-3和Bax蛋白表达明显依次下降,Bcl-2蛋白表达明显依次升高,各组间比较差异均有统计学意义(P<0.05)。见图3。
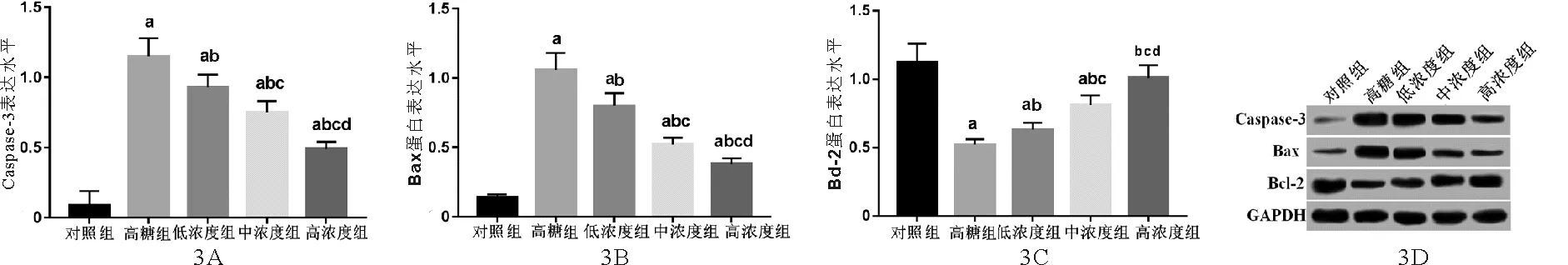
注:与对照组比较,aP<0.05;与高糖组比较,bP<0.05;与低浓度组比较,cP<0.05;与中浓度组比较,dP<0.05图3 5组HRECs中凋亡相关蛋白表达比较 A:Caspase-3蛋白;B:Bax蛋白;C:Bcl-2蛋白;D:Western blot检测结果
4.5组HRECs炎症因子TNF-α、IL-1β和IL-8含量比较:ELISA检测结果显示,与对照组比较,高糖组HRECs上清液中TNF-α、IL-1β和IL-8含量明显升高(P<0.05);与高糖组比较,丹参提取物低、中、高浓度组HRECs上清液中TNF-α、IL-1β和IL-8含量明显依次降低,各组间比较差异均有统计学意义(P<0.05)。见图4。

注:与对照组比较,aP<0.05;与高糖组比较,bP<0.05;与低浓度组比较,cP<0.05;与中浓度组比较,dP<0.05图4 5组HRECs中炎症因子TNF-α、IL-1β和IL-8含量比较 A:TNF-α;B:IL-1β;C:IL-8
5.5组HRECs p-NF-κB蛋白表达比较:Western blot检测结果显示,与对照组比较,高糖组HRECs中p-NF-κB蛋白表达升高(P<0.05);与高糖组比较,丹参提取物低、中、高浓度组HRECs中p-NF-κB蛋白表达依次下降,各组间比较差异均有统计学意义(P<0.05)。见图5。

注:与对照组比较,aP<0.05;与高糖组比较,bP<0.05;与低浓度组比较,cP<0.05;与中浓度组比较,dP<0.05图5 5组HRECs p-NF-κB蛋白表达比较A:5组HRECs NF-κB和p-NF-κB蛋白表达水平比较;B:5组HRECs NF-κB和p-NF-κB蛋白表达水平比较
讨 论
研究发现,丹参提取物具有抗炎、抗氧化等作用,在治疗DR中取得了较好的疗效[8]。本研究结果发现,高糖诱导的HRECs活力明显降低,且凋亡率明显升高,提示高糖能够诱导细胞凋亡,参与DR过程。这与近期关于DR患者存在微血管内皮细胞凋亡的研究结果相符[9-11]。不同浓度的丹参提取物均可提高高糖诱导的HRECs活性,抑制高糖诱导的细胞凋亡,且具有浓度依赖的关系,提示丹参提取物对高糖诱导的HRECs具有保护作用。Bax和Bcl-2均属于Bcl-2基因家族成员,Bax是促凋亡基因之一,其过度表达可引起Bcl-2对细胞保护效应的失衡。当细胞受到损伤后,Bcl-2构象发生改变,引起线粒体释放细胞色素C,进而激活下游的Caspase-3级联反应,引发细胞凋亡[12-13]。本研究结果显示,高糖能够诱导Caspase-3和Bax蛋白高度表达,Bcl-2蛋白表达下调,而丹参提取物能够降低Caspase-3和Bax蛋白表达水平,提高Bcl-2蛋白表达水平,提示丹参提取物可通过阻碍Bcl-2构象改变,抑制Caspase-3级联反应,从而抑制细胞凋亡。
NF-κB是转录因子蛋白家族成员之一,在免疫、炎症反应及细胞生长发育过程中起重要作用[14]。有关研究结果显示,NF-κB信号通路能够调控下游基因Bax和Bcl-2的表达,参与细胞凋亡过程[15]。丹参可通过抑制NF-κB信号通路参与肝癌细胞增殖、凋亡、侵袭和迁移的过程[16]。本研究结果显示,高糖能够促进Bax蛋白的表达,而丹参提取物能够抑制高糖诱导的Bax蛋白的表达,提示丹参提取物可能通过抑制NF-κB信号通路的激活抑制高糖诱导的HRECs凋亡。有研究结果表明,NF-κB通过调控细胞因子、趋化因子等参与调节机体炎症反应,NF-κB的过度激活是炎症反应发生的关键环节[17-18]。丹参可通过调控NF-κB信号通路进而调控炎症因子和黏附因子等的表达,影响细胞功能[19-20]。本研究结果显示,高糖诱导的细胞炎性因子TNF-α、IL-1β和IL-8的含量明显增多,丹参提取物处理后TNF-α、IL-1β和IL-8的含量明显减少,提示丹参提取物可能通过抑制NF-κB信号通路的激活降低炎症因子TNF-α、IL-1β和IL-8分泌,从而抑制细胞凋亡。本研究仅对丹参提取物影响NF-κB信号通路的作用机制进行了初步探究,涉及该通路上游或下游基因表达情况的检测尚显不足,后续研究将对此进行补充。
综上所述,丹参提取物可抑制高糖诱导的HREOS凋亡,其作用机制可能是抑制NF-κB信号通路的激活,通过上调Bcl-2蛋白表达,下调Caspase-3和Bax蛋白表达,降低炎症因子TNF-α、IL-1β和IL-8分泌来实现的。提示丹参提取物可通过抑制NF-κB信号通路,对抗炎症反应,降低细胞凋亡从而起保护HREOS的作用。
