木犀草素缓解双酚A诱导的小鼠卵巢毒性作用研究
2020-08-02张曦倩姚俐罗燕群易艳红董梅刘风华
张曦倩 姚俐 罗燕群 易艳红 董梅 刘风华
【摘要】目的 觀察木犀草素对双酚A诱导的小鼠卵巢毒性的缓解作用及初步探索p38丝裂原活化蛋白激酶(p38 MAPK)和细胞外信号调节蛋白激酶(ERK)是否参与其中。方法 32只昆明小鼠随机分为正常对照组、双酚A组、双酚A和木犀草素共处理组(共处理组)、木犀草素组,每组各8只,其中双酚A组以10 mg/(kg·d)的双酚A溶剂灌胃,共处理组依次以10 mg/(kg·d)的木犀草素溶剂和10 mg/(kg·d)的双酚A溶剂灌胃,木犀草素组以10 mg/(kg·d)的木犀草素溶剂灌胃,正常对照组以等体积玉米油灌胃;给药均持续4周。给药结束后取小鼠卵巢组织,检测各组小鼠卵巢组织中丙二醛水平、超氧化物歧化酶(SOD)及过氧化氢酶(CAT)活性的变化,并检测凋亡相关蛋白Caspase-3的活化片段(cleaved Caspase-3)、磷酸化p38 MAPK、磷酸化ERK蛋白表达。结果 经双酚A处理后,小鼠卵巢组织丙二醛水平升高(P < 0.05)、SOD和CAT活性降低(P < 0.05)、cleaved Caspase-3蛋白相对表达量升高(P < 0.05)、p38 MAPK和ERK的磷酸化水平升高(P < 0.05);与双酚A单独处理相比,木犀草素与双酚A共处理后小鼠卵巢组织丙二醛水平降低(P < 0.05)、SOD和CAT活性增高(P < 0.05)、cleaved Caspase-3蛋白相对表达量降低(P < 0.05)、而磷酸化p38 MAPK和ERK蛋白相对表达量降低(P < 0.05)。木犀草素组与正常对照组各项指标比较差异均无统计学意义(P均>0.05)。结论 木犀草素可有效缓解双酚A诱导的小鼠卵巢毒性作用,其可能与p38 MAPK和ERK信号通路的参与有关。
【关键词】木犀草素;双酚A;细胞外信号调节蛋白激酶;p38丝裂原活化蛋白激酶;氧化损伤
【Abstract】Objective To evaluate the alleviating effect of luteolin on bisphenol A-induced ovarian toxicity in mouse models and to explore whether p 38 mitogen-activated protein kinase (p38 MAPK) and extracellular regulatory kinase (ERK) are involved in this process. Methods Thirty-two Kunming mice were randomly divided into 4 groups with 8 mice in each group: negative control group (NC), bisphenol A group (BPA), bisphenol A and luteolin co-treatment group (BPA+Lut), and luteolin group (Lut), respectively. The mice in the BPA group were administrated with BPA solvent at a dose of 10 mg/(kg·d), those in the BPA + Lut group were treated with 10 mg/(kg·d) luteolin solvent and 10 mg/(kg·d) BPA solvent in sequence, animals in the Lut group were administrated with 10 mg/(kg·d) luteolin solution and those in the negative control group were given with an equal volume of corn oil. The above drugs were administered by daily gavage for 4 consecutive weeks. After corresponding administrations, the ovarian tissues were collected. The changes in the activity of malondialdehyde (MDA), superoxide dismutase (SOD) and catalase (CAT) were observed. The expression levels of apoptosis-related protein cleaved Caspase-3 (cleaved Caspase-3), phosphorylated p38 MAPK and ERK proteins were quantitatively measured. Results MDA levels in the ovarian tissues were significantly increased after BPA treatment (P < 0.05), while SOD and CAT activities were markedly reduced (both P < 0.05). The expression level of cleaved Caspase-3 protein was significantly up-regulated (P < 0.05), p38 MAPK and ERK phosphorylation levels were also significantly increased (both P < 0.05). Compared with BPA treatment alone, co-treatment with luteolin and BPA significantly reduced the MDA levels (P < 0.05), elevated the SOD and CAT activities (both P < 0.05), and down-regulated the relative expression levels of cleaved Caspase-3, phosphorylated p38 MAPK and ERK proteins (all P < 0.05). There was no significant difference between Lut and NC (all P > 0.05). Conclusion Luteolin can effectively alleviate BPA-induced ovarian toxicity in mouse models, which is probably correlated with the involvement of p38 MAPK and ERK signaling pathways.
【Key words】Luteolin;Bisphenol A;Extracellular regulatory kinase;p38 mitogen-activated protein kinase;Oxidative damage
双酚A是人们日常生活中较常接触到的化学物质之一。长期摄入双酚A具有明显的卵巢毒性,其导致的卵巢组织氧化损伤可能在生殖功能障碍性疾病中起着重要作用[1]。有研究显示,双酚A亚慢性暴露损伤雌性小鼠卵巢储备功能[2]。因此,积极探索能有效缓解双酚A蓄积所致的氧化应激损伤、抑制卵巢组织凋亡进而改善卵巢功能的新策略具有重大意义。木犀草素是一种天然黄酮类化合物,具有抗炎、抗过敏、抗肿瘤、抗菌、抗病毒等药理作用[3]。有关卵巢癌的研究显示,木犀草素可调控氧化应激水平和细胞凋亡[4]。本研究以双酚A干预昆明小鼠建立卵巢氧化损伤模型,观察木犀草素对双酚A诱导的小鼠卵巢组织氧化损伤的缓解作用,并初步探讨p38丝裂原活化蛋白激酶(p38 MAPK)和细胞外信号调节蛋白激酶(ERK)是否参与其中。
材料与方法
一、实验动物
选用6 ~ 8周龄的无特定病原体(SPF)级雌性昆明种(KM)小鼠 32只(广东省医学实验动物中心提供),体质量(20.1±2.2)g。将小鼠饲养在SPF动物室中,自然昼夜光线照明,保持良好的室内通风,相对湿度40% ~ 70%,室温(22±2)℃,光暗周期为12 h,饮食自取,喂饲普通饲料。适应性喂养 1 周后进行实验。在实验动物饲养管理过程中,严格遵守3R原则,善待实验动物,保障动物福利,确保动物享有不受饥渴、生活舒适等五大自由,动物实验操作严格按照标准操作规程,动物处死采用人道方法实施安死术。
二、主要试剂与仪器
双酚A(分子式C15H16O2,分子量228.29,纯度99%)、木犀草素(分子式C15H10O6,分子量286.24,纯度98%)购自美国Sigma公司。丙二醛试剂盒、超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒、RIPA细胞蛋白提取液、抗体稀释液购自江苏碧云天生物有限公司。凋亡相关蛋白Caspase-3的活化片段(cleaved Caspase-3)一抗、磷酸化p38 MAPK(p-p38 MAPK)、磷酸化ERK(p-ERK)、GAPDH一抗及相应二抗购自美国CST公司。其他实验常用试剂购自广州永津生物有限公司。多功能酶标仪为美国Spectramax M5型。蛋白免疫印迹电泳仪、电转仪为Bio-Rad公司产品。
三、动物模型的制备与给药
根据文献[5],长期摄入10 mg/(kg·d)剂量的双酚A可引起大鼠生殖系统功能损伤、过氧化应激等,因此本研究以10 mg/(kg·d)的双酚A作为暴露剂量。另根据既往研究,木犀草素在剂量為10 mg/(kg·d)时具有抗氧化、抗凋亡作用,剂量高达100 mg/(kg·d)也较为安全[6-7]。因此本研究设定木犀草素剂量为10 mg/(kg·d)。双酚A和木犀草素均以玉米油配制溶剂。
将32只小鼠编号,根据随机数表法分为正常对照组、双酚A组、双酚A+木犀草素组(共处理组)以及木犀草素组,每组各8只。其中双酚A组以10 mg/(kg·d)双酚A溶剂灌胃,共处理组依次以10 mg/(kg·d)的木犀草素溶剂和10 mg/(kg·d)的双酚A溶剂灌胃,木犀草素组以10 mg/(kg·d)的木犀草素溶剂灌胃,正常对照组以等体积玉米油灌胃。以上4组给药均持续4周。
四、标本采集
于最后1次灌胃给药24 h后,颈椎脱臼法处死小鼠,分离双侧卵巢,快速置入液氮保存,用于丙二醛、SOD、CAT和蛋白免疫印迹法检测。
五、小鼠卵巢组织丙二醛、SOD、CAT检测
检测步骤参考试剂盒说明书:及时取出上述超低温冻存的各组小鼠卵巢组织,迅速剪碎研磨后以预冷的生理盐水一同在冰浴中匀浆(生理盐水体积∶组织质量= 9∶1),置于EP管中以2000转/分离心8 min,取适量上清液,根据说明书于酶标仪上测定丙二醛的含量及SOD、CAT的活性。
六、小鼠卵巢组织cleaved Caspase-3、p-p38 MAPK、p-ERK蛋白检测
采用蛋白免疫印迹法:各组小鼠卵巢组织剪碎匀浆后,二喹啉甲酸(BCA)法行蛋白定量,每组各取30 μg蛋白液,行10% SDS-Page凝胶电泳,转膜,加入一抗cleaved Caspase-3(1∶1000)、p-ERK(1∶1000)、p-p38 MAPK(1∶1000)、GAPDH(1∶2000),4℃孵育过夜,加入相应二抗(1∶2000),室温孵育1 h后行发光显影,采用Image J分析条带灰度值。
七、统计学处理
使用SPSS 21.0处理数据。计量资料以表示,多组比较采用单因素方差分析,双酚A组、木犀草素组与正常对照组及双酚A组和共处理组的组间比较采用LSD-t检验。P < 0.05为差异有统计学意义。
结果
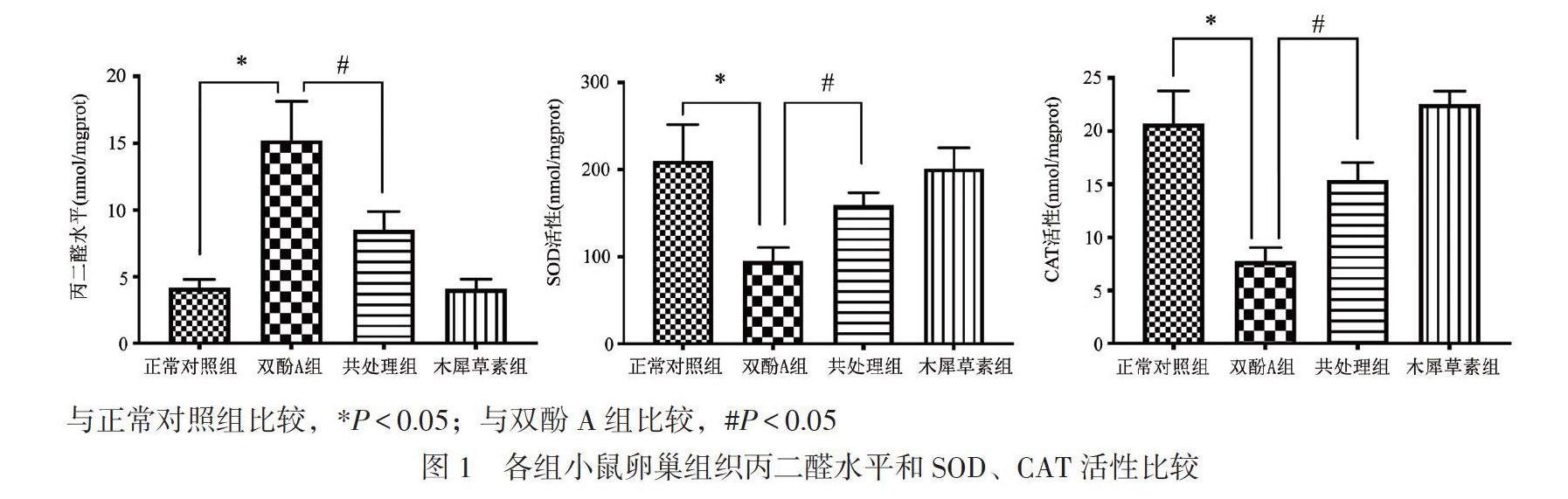
一、各组小鼠卵巢组织的丙二醛水平及SOD、CAT的活性分析
双酚A组小鼠卵巢组织丙二醛水平为(15.23 ±2.92)nmol/mgprot高于正常对照组的(4.18±0.61) nmol/mgprot(LSD-t = 8.282,P < 0.05),而共处理组小鼠卵巢组织丙二醛水平为(8.50±1.40)nmol/mgprot低于双酚A组(LSD-t = 4.666,P < 0.05)。双酚A组小鼠卵巢组织SOD活性为(95.34±15.84) nmol/mgprot,低于正常对照组的(210.34±41.09)nmol/mgprot(LSD-t = 5.839,P < 0.05),而共处理组的小鼠卵巢组织SOD活性为(159.65±13.77)nmol/mgprot,比双酚A组改善(LSD-t = 6.851,P < 0.05)。双酚A组小鼠卵巢组织CAT活性为(7.78± 1.30)nmol/mgprot低于正常对照组的(20.70±3.10)nmol/mgprot(LSD-t = 8.594,P < 0.05),而共处理组
的小鼠卵巢组织CAT活性为(15.43±1.60)nmol/mgprot,比双酚A组改善(LSD-t = 8.298,P < 0.05)。木犀草素组与正常对照组小鼠卵巢组织的丙二醛水平和SOD、CAT活性比较差异均无统计学意义(P均> 0.05),见图1。
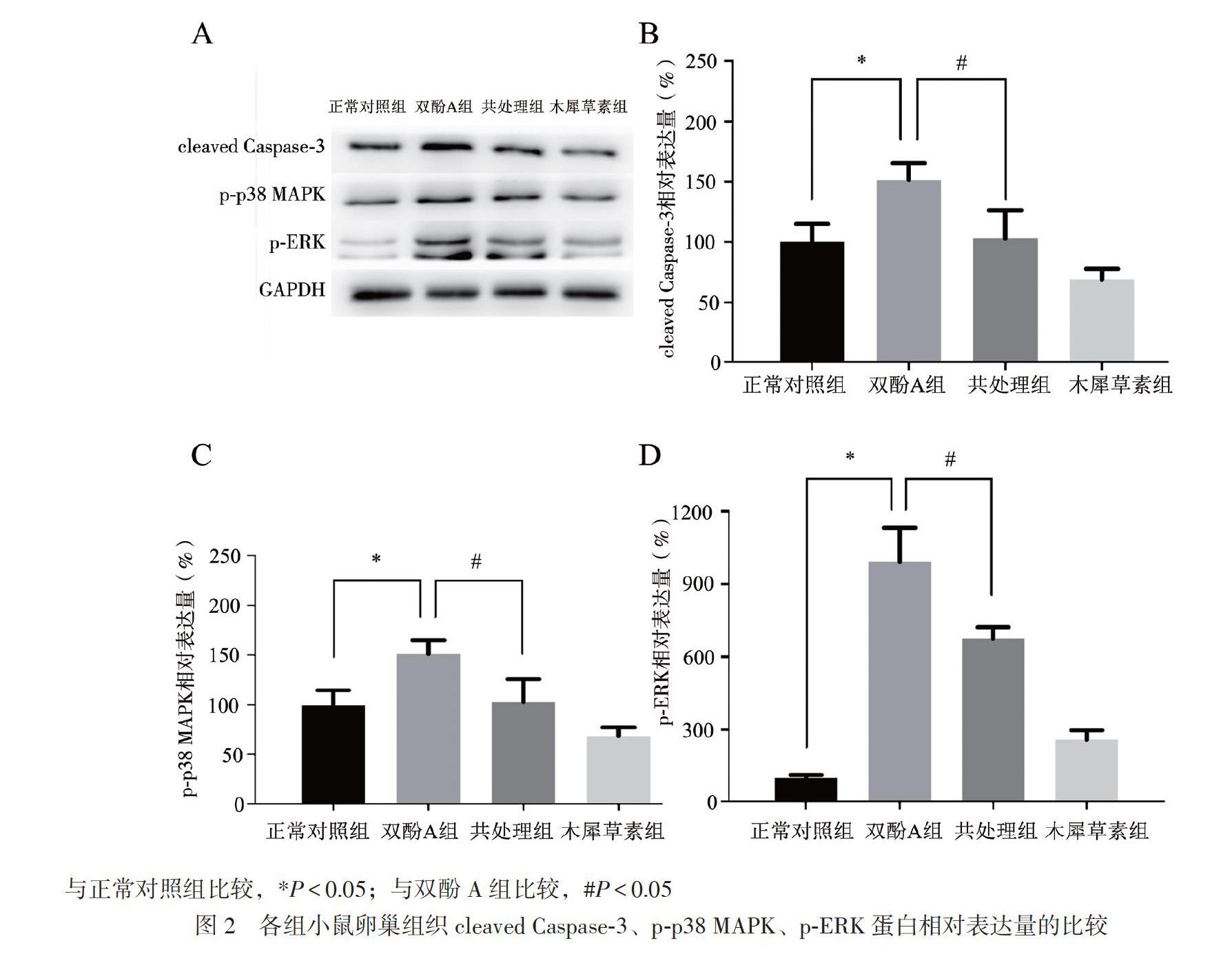
二、各组小鼠卵巢组织cleaved Caspase-3、p-p38 MAPK、p-ERK蛋白相对表达量的比较
双酚A组小鼠卵巢组织cleaved Caspase-3蛋白相对表达量为(151.54±14.00)%,高于正常对照组的(100.00±15.01)%(LSD-t = 4.351,P < 0.05),而共处理组的cleaved Caspase-3蛋白相对表达量为(68.88±9.00)%,低于双酚A组(LSD-t = 3.102,P < 0.05)。双酚A组卵巢组织p-p38 MAPK水平为(142.05±18.00)%,高于正常对照组的(100.00 ±11.00)%(LSD-t = 3.453,P < 0.05),而共处理组的p-p38 MAPK水平为(101.05±9.00)%,低于双酚A组(LSD-t = 3.475,P < 0.05)。双酚A组小鼠卵巢组织p-ERK水平为(991.63±141.01%),高于正常对照组的(100.00±12.00)%(LSD-t =
10.910,P < 0.05),而共处理组小鼠卵巢组织p-ERK水平为(674.13±48.00)%,低于双酚A组(LSD-t = 3.692,P < 0.05),木犀草素组与正常对照组小鼠卵巢组织的cleaved Caspase-3、p-p38 MAPK、p-ERK蛋白相对表达量比较差异均无统计学意义(P均> 0.05),见图2。
讨论
双酚A被广泛应用于聚碳酸酯塑料、聚氯乙烯塑料、食品容器、牙科材料、纸制品、玩具、奶嘴等产品的制作,人们可通过呼吸、皮肤黏膜接触等途径摄入双酚A。流行病学证据表明,高达93%人群的尿液或血清中可以检测到双酚A[8]。由于双酚A存在内分泌干扰作用,流行病学研究显示双酚A与子宫内膜异位等生殖内分泌疾病有关[9]。双酚A除具有内分泌干扰作用外,其慢性蓄积后组织中的活性氧水平升高、蛋白质及脂质结构不同程度遭到破坏,细胞出现凋亡。超氧化物、过氧化氢和羟基自由基等可引起卵巢组织膜脂质的氧化损伤,并导致脂质过氧化,在机体内可导致凋亡和氧化应激坏死等病理事件[10]。氧自由基攻击脂质的不饱和脂肪酸引起脂质过氧化损伤,生成一系列毒性化合物,其中就包括丙二醛,丙二醛是氧化應激反应的主要生物标记之一,其可引起细胞膜损害,导致细胞内环境改变甚至细胞死亡。SOD和CAT是生物体内重要的抗氧化酶,是机体抗氧化应激能力的可靠指标[11]。有研究者报道,双酚A处理后的大鼠卵巢颗粒细胞活力呈剂量依赖性降低、活性氧水平升高、 SOD活性明显降低[12]。双酚A暴露抑制F1雌性小鼠的卵巢发育,升高卵巢组织凋亡相关蛋白Caspase家族及Bax的相对表达[13]。本研究用双酚A诱导昆明小鼠,结果显示小鼠卵巢组织中脂质过氧化指标丙二醛升高,抗氧化酶SOD和CAT降低,表明双酚A暴露可诱导小鼠卵巢组织氧化损伤。此外,双酚A干预后的小鼠卵巢组织中凋亡相关蛋白cleaved Caspase-3表达升高,提示双酚A可诱导小鼠卵巢组织凋亡事件的发生。
MAPK信号通路广泛存在于真核生物细胞内各种生物活动,对各种刺激信号有着重要的传导功能,如增殖、分化、存活、氧化应激、炎症反应等,在肿瘤和生殖内分泌疾病等病理或疾病中发挥关键的调控作用[14]。有研究显示,双酚A的衍生物双酚芴诱导的氧化应激可导致小鼠卵母细胞DNA损伤、线粒体功能障碍以及凋亡相关基因表达升高,其与MAPK信号通路参与其中有关[15]。本研究中,双酚A干预昆明小鼠提高卵巢组织氧化损伤水平和凋亡水平的同时伴随着p38 MAPK和ERK的磷酸化水平升高,表明p38 MAPK和ERK信号通路参与双酚A诱导的卵巢毒性作用。
木犀草素在自然界中分布广泛,研究发现金银花、菊花、荆芥、黄岑属、紫苏属等天然药材中均含有木犀草素,其因具有抗炎、抗过敏、抗肿瘤、抗菌、抗病毒等药理作用备受关注。研究表明,木犀草素可以通过多条细胞信号通路发挥其抗氧化、抗炎、抗凋亡等作用,包括MAPK、Akt、NF-κB等[16-17]。此外有研究显示,木犀草素可通过降低ERK和黏附斑激酶的磷酸化水平抑制卵巢癌细胞的上皮间质转化[18]。木犀草素还可通过降低ERK和p38 MAPK的磷酸化水平缓解脂多糖诱导的BV2细胞毒性作用[3]。本研究使用木犀草素与双酚A共处理的小鼠与双酚A单独处理的小鼠相比,卵巢组织脂质过氧化损伤指标丙二醛含量下降,抗氧化酶SOD、CAT活性改善,而p38 MAPK和ERK的磷酸化水平降低,表明木犀草素可能通过调控p38和ERK信号通路抑制双酚A诱导的卵巢毒性作用。另外,木犀草素组与正常对照组各项指标比较差异均无统计学意义,显示木犀草素无明显毒性。
然而,本研究目前只初步探讨了木犀草素缓解双酚A的卵巢毒性作用,并未在细胞水平和基因层面深入探讨其抗氧化、抗凋亡的作用机制以及MAPK的调控机制,我们将在今后开展进一步工作予以证实。
参 考 文 献
[1] Avci B, Bahadir A, Tuncel OK, Bilgici B. Influence of α-tocopherol and α-lipoic acid on bisphenol-A-induced oxidative damage in liver and ovarian tissue of rats. Toxicol Ind Health, 2016, 32(8):1381-1390.
[2] 曹羽明,瞿鑫兰,张铭,左驰,姚燕如,杨寒笑,张元珍.双酚A亚慢性暴露对雌性小鼠卵巢储备功能的影响.中国生育健康杂志,2017,28(3):212-216.
[3] Fan S, Habib A, Liu J, Tan J. LED enhances anti-inflammatory effect of luteolin (3, 4, 5, 7-tetrahydroxyflavone) in vitro. Am J Transl Res, 2018, 10(1):283-291.
[4] Tavsan Z, Kayali HA. Flavonoids showed anticancer effects on the ovarian cancer cells: involvement of reactive oxygen species, apoptosis, cell cycle and invasion. Biomed Pharmacother, 2019, 116:109004.
[5] Zaid SS, Othman S, Kassim NM. Potential protective effect of Tualang honey on BPA-induced ovarian toxicity in prepubertal rat. BMC Complement Altern Med, 2014, 14:509.
[6] Zhang M, He L, Liu J, Zhou L. Luteolin attenuates diabetic nephropathy through suppressing inflammatory response and oxidative stress by inhibiting STAT3 Pathway. Exp Clin Endocrinol Diabetes, 2020 Jan 2. doi: 10.1055/a-0998-7985. Epub ahead of print.
[7] Fu J, Sun H, Zhang Y, Xu W, Wang C, Fang Y, Zhao J. Neuroprotective effects of luteolin against spinal cord ischemia-reperfusion injury by attenuation of oxidative stress, inflam-mation, and apoptosis. J Med Food, 2018, 21(1):13-20.
[8] Vandenberg LN, Hunt PA, Myers JP, Vom Saal FS. Human exposures to bisphenol A: mismatches between data and assumptions. Rev Environ Health, 2013, 28(1):37-58.
[9] Moreira Fernandez MA, Cardeal ZL, Carneiro MM, André LC. Study of possible association between endometriosis and phthalate and bisphenol A by biomarkers analysis. J Pharm Biomed Anal, 2019, 172:238-242.
[10] Luderer U. Ovarian toxicity from reactive oxygen species. Vitam Horm, 2014, 94:99-127.
[11] Fang WL, Zhao DQ, Wang F, Li M, Fan SN, Liao W, Zheng YQ, Liao SW, Xiao SH, Luan P, Liu J. Neurotropin? alleviates hippocampal neuron damage through a HIF-1α/MAPK pathway. CNS Neurosci Ther, 2017, 23(5):428-437.
[12] Lee CT, Wang JY, Chou KY, Hsu MI. 1,25-Dihydroxyvitamin D3 modulates the effects of sublethal BPA on mitochondrial function via activating PI3K-Akt pathway and 17β-estradiol secretion in rat granulosa cells. J Steroid Biochem Mol Biol, 2019, 185:200-211.
[13] Wei Y, Han C, Li S, Cui Y, Bao Y, Shi W. Maternal exposure to bisphenol A during pregnancy interferes ovaries development of F1 female mice. Theriogenology, 2020, 142:138-148.
[14] Kim EK, Choi EJ. Compromised MAPK signaling in human diseases: an update. Arch Toxicol, 2015, 89(6):867-882.
[15] Jia Z, Wang H, Feng Z, Zhang S, Wang L, Zhang J, Liu Q, Zhao X, Feng D, Feng X. Fluorene-9-bisphenol exposure induces cytotoxicity in mouse oocytes and causes ovarian damage. Ecotoxicol Environ Saf, 2019, 180:168-178.
[16] Aziz N, Kim MY, Cho JY. Anti-inflammatory effects of luteolin: a review of in vitro, in vivo, and in silico studies. J Ethnophar-macol, 2018, 225:342-358.
[17] Lu X, Li Y, Li X, Aisa HA. Luteolin induces apoptosis in vitro through suppressing the MAPK and PI3K signaling pathways in gastric cancer. Oncol Lett, 2017, 14(2):1993-2000.
[18] Dia VP, Pangloli P. Epithelial-to-mesenchymal transition in paclitaxel-resistant ovarian cancer cells is downregulated by luteolin. J Cell Physiol, 2017, 232(2):391-401.
(收稿日期:2020-03-07)
(本文編辑:林燕薇)
