抗阻训练对增龄大鼠骨骼肌线粒体功能的影响*
2020-08-01苏艳红袁乾坤张世超
苏艳红, 袁乾坤, 肖 蓉, 陈 娟, 李 强, 张世超
(1. 辽宁师范大学体育学院, 辽宁省运动人体科学重点实验室, 大连116029; 2. 辽宁省大连市旅顺口区大华小学, 大连116041; 3. 辽宁师范大学生命科学院, 大连116081; 4. 周口科技职业学院, 河南 周口 466000)
线粒体是氧化代谢的重要部位,是提供个体活动所需能量的场所,线粒体形态构造与机能的微小变化会直接或间接地影响骨骼肌的正常工作。线粒体同时又是不断变化的动态细胞器,为保持正常生理功能,不断进行动态变化,称为线粒体动力学,主要包括线粒体融合与分裂两个过程。其融合/分裂比率保持在相对平衡的动态变化下,维持着线粒体结构和功能及细胞能量代谢的正常水平。线粒体的融合和分裂过程受多种蛋白调控。其中,调控线粒体融合的蛋白有线粒体融合蛋白1(mitofusion1, Mfn1)、线粒体融合蛋白2(mitofusion2, Mfn2)和视神经萎缩蛋白1(optic atrophy protein1, OPA1)。研究显示Mfn2 不仅参与调控线粒体融合,在与糖代谢相关的病理、生理过程中,Mfn2都会存在表达的变化[1,2]。调控线粒体分裂的蛋白有分裂蛋白1(fission protein1, Fis1)、动力相关蛋白1(dynamic-related protein1, DRP1)等。当细胞处于稳定状态时,线粒体融合分裂的速度相等,使线粒体数量和形态保持稳定,从而处在不断变化的动态平衡当中。当线粒体融合增加时,线粒体的网状化结构会增加,会改善线粒体功能,也可以对细胞产生一定的保护作用。当线粒体分裂增加时,断裂的线粒体会增多,可能会导致线粒体损伤,造成线粒体膜电位(mitochondrial membrane potential, ΔΨm)降低。总而言之,线粒体融合分裂的动态变化能力影响着它在细胞完成正常生理功能的作用[3]。
衰老是随着年龄的增长不可避免发生的一种状况,表现为骨骼肌力量、耐力、爆发力等不同程度地下降,最终导致机体运动能力下降。运动能力下降可能是由于在运动时骨骼肌得不到充足的能量供应,同时随着年龄的增长,体内因受到活性氧(reactive oxygen species, ROS)等自由基攻击而造成损伤,Ca2+堆积造成线粒体膜流动性下降,进而影响到线粒体内的氧化磷酸化反应,ATP生成量剧减,抑制线粒体供能系统,机体运动能力不佳[4]。抗阻训练能够提高肌肉质量和肌肉力量,大鼠抗阻训练是延缓增龄过程中肌力下降、提高机体能量代谢速率的常用方法。实验研究显示[5,6],低、中等强度的抗阻训练能够降低衰老大鼠腓肠肌胞浆Ca2+、提高线粒体膜电位,延缓线粒体功能障碍的发生。本实验从增龄大鼠线粒体分裂融合的重要调节因子Mfn2/DRP1入手,探讨增龄对于大鼠线粒体功能的影响,以及抗阻运动的改善作用,如ΔΨm、ROS、游离钙等的改变。
1 材料与方法
1.1 实验动物
实验动物:清洁级雄性SD大鼠40只,其中2月龄大鼠20只,体重:(220±20)g;6月龄大鼠20只,体重:(400±20)g。本实验用鼠购自大连医科大学动物中心。饲养环境:实验动物房室内温度为20~24℃,按照实验设计进行分组,分笼饲养,自然昼夜节律变化光照,采用国家标准啮齿类动物饲料。自由饮食、饮水。每周记录体重。
1.2 实验分组
将2月龄SD大鼠随机分为安静对照组(C1组)和抗阻运动训练组(R1组),6月龄SD大鼠随机分为安静对照组(C2组)和抗阻运动训练组(R2组),每组10只。对照组不做任何处理,自由饮食、饮水;抗阻运动训练组进行2周适应性运动训练,之后开始正式训练,按照翁锡全[7]等人的实验模型进行8周抗阻力跑台训练,具体方法如下:跑台坡度设定为35°,速度为15 m/min,一次跑动时间为15 s,两次之间的间歇时间为30 s,4次为一组,组间间歇3 min,每3组为一次循环,一天为2个循环,2个循环之间间歇10 min,每周6 d。
1.3 取材
大鼠停止训练2 d后进行取材。按照大鼠每100 g体重0.5~1 ml的剂量腹腔注射20%的氨基甲酸乙酯(又称乌拉坦)。用消毒后的手术剪刀迅速取出大鼠后肢的股四头肌,检测线粒体相关指标的股四头肌需在剪下后立即放入RPMI 1640培养基中剪碎,研磨后过滤成单细胞放入37℃恒温箱中以待检测,剩余股四头肌组织放于-80℃冰箱保存。
1.4 仪器与试剂
仪器:美国 Becton流式细胞仪、日本三洋株式会社-80℃冰箱、动物实验跑台、冷冻离心机、垂直电泳仪、PH计、手提式高速分散器、数显恒温水浴箱、净化工作台等。
试剂:PMSF、EDTA、溴酚蓝、TEMED、EGTA,购置于AMRESCO公司;TritonX-100、BSA、Glycerol、Acrlamide-bis,购置于Scientific Research Special公司;APS、SDS、DTT、甲苯胺蓝、Tris-Base、Glycine,购置于Biosharp公司;丙烯酰胺,购置于NOVON公司。其他为国产分析纯。实验用抗体:Mitofusin-2(抗兔)ab12473,单克隆抗体(abcam公司),DRP1(抗兔)ag3644,单克隆抗体(Proteintech公司);GAPDH(抗鼠),MB001,多克隆抗体(碧云天公司);二抗抗体(羊抗兔) zb2301,中杉金桥公司;二抗抗体(羊抗鼠)zb2305,中杉金桥公司。
1.5 Western blot测试Mfn2、DRP1蛋白表达
将-80℃保存的股四头肌取出称重,剪碎,每克组织中加入3 ml RIPA 裂解液,手动匀浆,静置40 min充分裂解,离心10 min(10 000 r/min),取上清,Bradford 法测定蛋白浓度,分装,置于-80℃冰箱储存备用,以上操作均在4℃进行。取80 μg 总蛋白配制成上样体系,放入95 ℃沸水中5 min,上样前以3 000 r/min离心 5 min。配制10%分离胶,4%浓缩胶,220 V电压进行电泳,半干转膜仪220 V转移90 min将蛋白转到PVDF膜上,封闭60 min后加入一抗(Mfn2,1∶3 000;DRP1,1∶750;GAPDH,1∶ 5 000),4℃孵育过夜,PBST洗膜后用二抗(1∶ 6 000),在室温条件下孵育60 min,ECL显色、定影,使用凝胶成像系统采集图像,置于Gel-Pro32 图像分析系统中分析处理,通过与标准GAPDH条带光密度值进行比较得出其相对含量值。
1.6 裂解红细胞
取材后,将研磨过滤后的单细胞进行红细胞裂解,以去除红细胞对实验结果的影响。将已经过滤好的单细胞添加进1.5 ml离心管中,之后添加1 ml的红细胞裂解液,混匀,静置10 min;裂解后,离心4 min,设定转速为3 000 r/min;吸出上清,再用1×PBS溶液洗涤两次;将最后洗涤好的单细胞重悬于无血清培养液中,放入37℃细胞恒温箱以待之后进行探针装载和检测。
1.7 股四头肌胞浆游离钙检测
取5 mmol/L Fluo-3 AM(钙离子荧光探针)溶于无水二甲基亚砜溶液(anhydrous DMSO)中,配制成浓度为2 mmol/L的储存液;将5 μl的储存液与细胞溶液混合在一起,使终浓度为5 μmol/L,37℃恒温箱中孵育40 min左右;孵育好后离心4 min,转速3 000 r/min;吸出上清,再用1×PBS溶液洗涤一次;洗涤后便可上流式细胞仪检测。
1.8 股四头肌胞浆ROS检测
装载探针:将2',7'-二氯荧光黄双乙酸盐(DCFH-DA)稀释1000倍,取适量加入到细胞悬浮液中,使其浓度为10 μmol/L,之后放入37℃恒温箱中避光孵育20 min,间隔3~5 min颠倒摇晃一次,确保探针能够充分进入细胞内;孵育后,用无血清细胞培养液洗涤3次,离心机离心4 min,转速3 000 r/min,充分洗去未进入细胞的DCFH-DA;最后将配置好的单细胞悬浮于1×PBS溶液中,放置在流式细胞仪上进行检测。
1.9 股四头肌细胞ΔΨm检测
加入到0.5 ml细胞培养液中,稀释至10 μmol/L,混匀后放入37℃恒温箱中避光静置20 min,然后根据下述方法装载JC-1探针;JC-1染色工作液的配制:按说明书要求配置适量JC-1工作液,采取现用现配的方式;对于悬浮细胞:⑴将单细胞重悬于适量的细胞培养液中,每个离心管里有1~6×105单细胞。⑵添加适量的JC-1染色工作液,进行颠倒混匀以保证JC-1与细胞充分融合,37℃恒温箱中避光孵育20 min;⑶在孵育期间,按照1∶4的比例将JC-1染色缓冲液(5×)稀释为染色缓冲液(1×),配置适量的JC-1染色缓冲液(1×)待用;⑷孵育结束后,离心处理,4℃离心4 min,转速3 000 r/min,沉淀细胞,移液器取出并弃掉上清;⑸添加JC-1染色缓冲液(1×)将沉淀细胞洗涤2次,每次添加1 ml JC-1染色缓冲液(1×)将细胞重悬,4℃离心4 min,转速3 000 r/min,移液器取出并弃掉上清;⑹最后用适量JC-1染色缓冲液(1×)将细胞重悬,上流式细胞仪进行检测。
1.10 统计学处理
2 结果
2.1 增龄及抗阻训练对大鼠股四头肌DRP1、Mfn2蛋白表达的影响
如图1、表1所示,与C1组相比,R1组大鼠DRP1蛋白升高(P<0.01)、Mfn2蛋白无显著变化,C2组大鼠DRP1、Mfn2蛋白均降低(P均<0.01);与C2组相比,R2组大鼠DRP1、Mfn2蛋白均升高(P<0.01,P<0.05);与R1组相比,R2组DRP1、Mfn2蛋白均降低(P<0.01,P<0.05)。
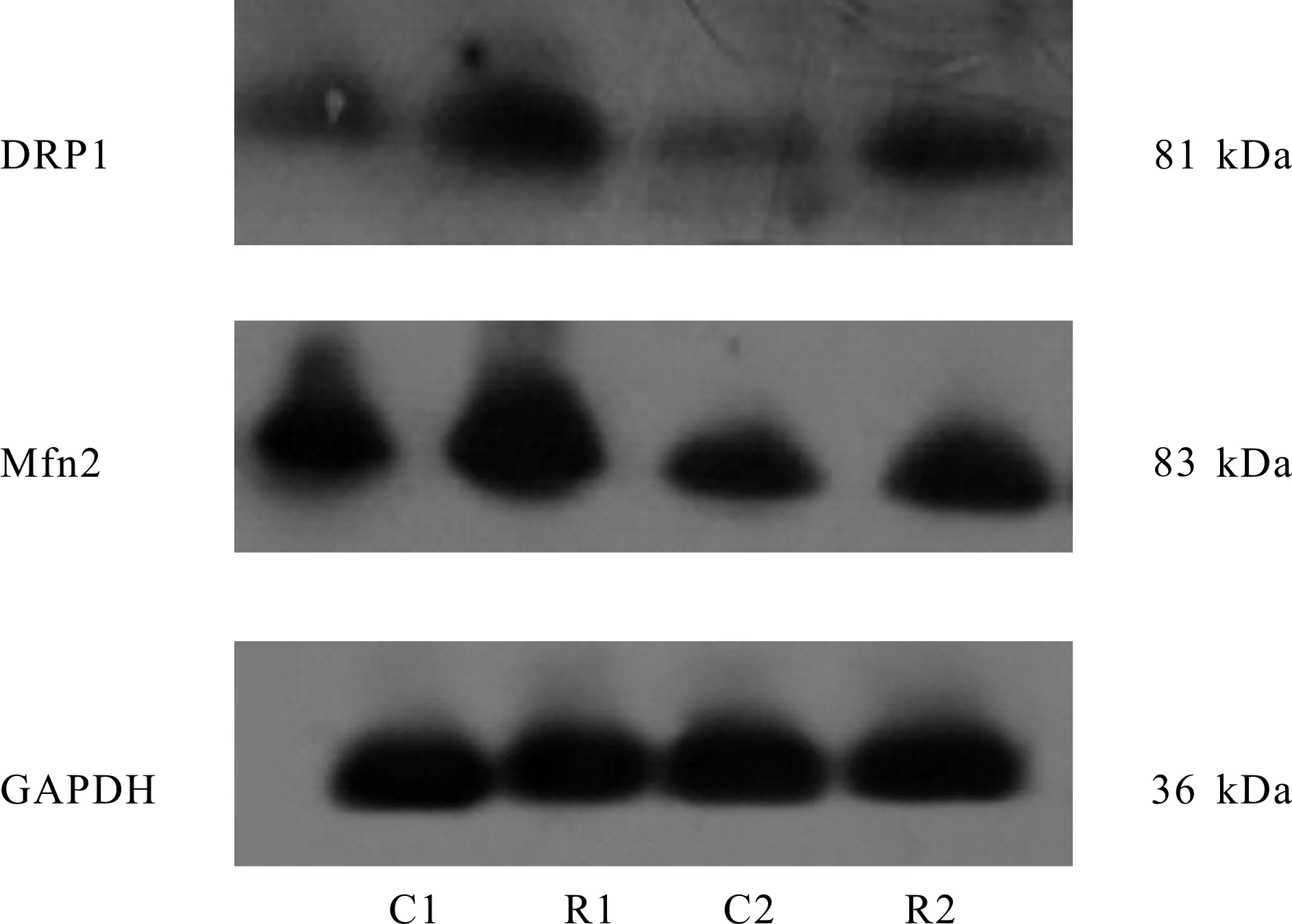
Fig. 1 Effects of resistance training on expression of DRP1 and Mfn2 in quadriceps muscle of rats
2.2 增龄及抗阻训练对大鼠股四头肌胞浆Ca2+含量的影响
由图2、表1所示,与C1组相比,R1组Ca2+含量降低(P<0.01)、C2组Ca2+含量升高(P<0.01);与C2组相比,R2组Ca2+含量降低(P<0.01);与R1组相比,R2组Ca2+含量升高(P<0.01)。
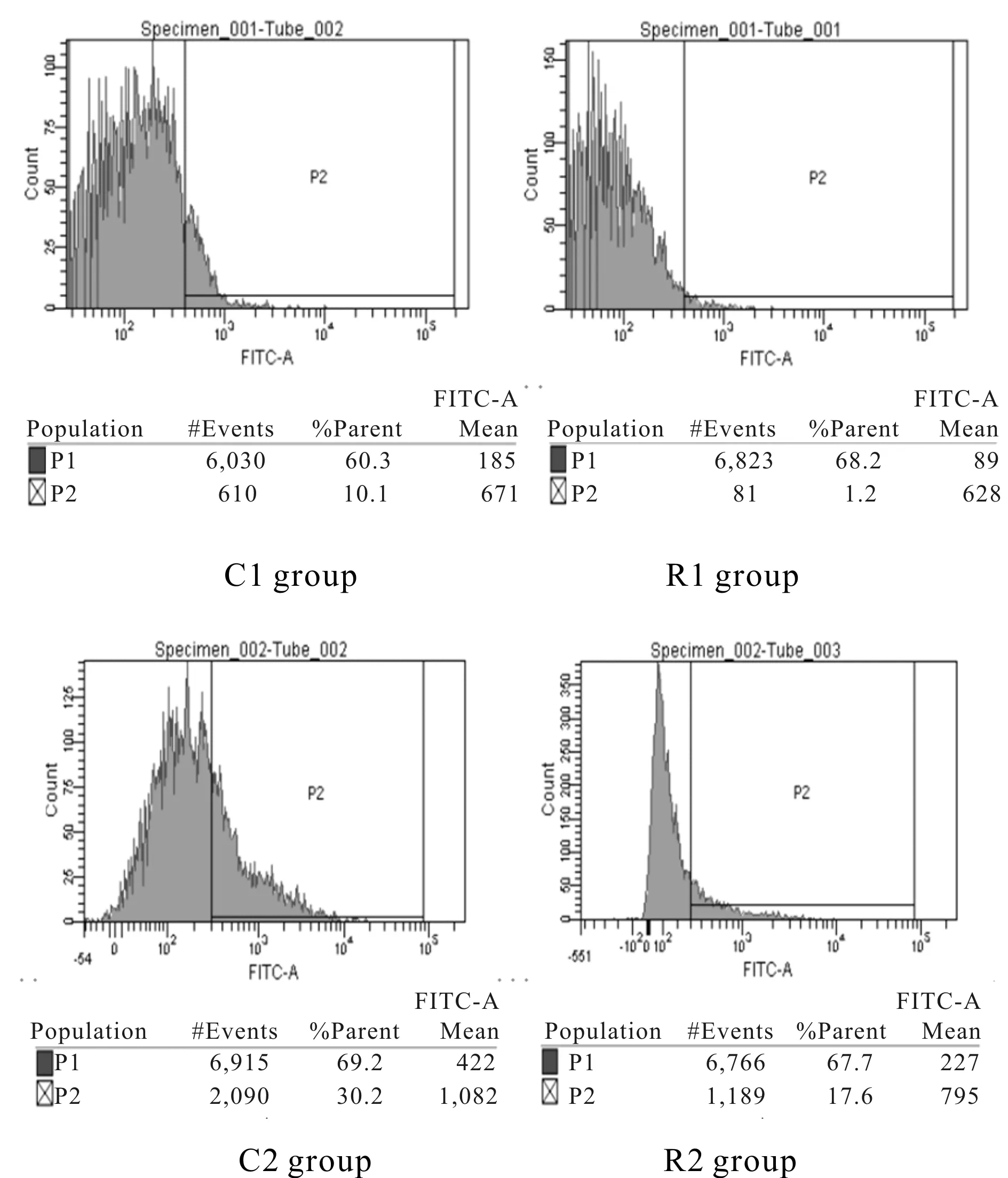
Fig. 2 Effects of resistance training on quadriceps femoris Ca2+ content in rats
2.3 增龄及抗阻训练对大鼠股四头肌线粒体ROS含量的影响
由图3、表1所示,与C1组相比,R1组ROS含量有所上升,但无显著性差异,C2组ROS含量升高(P<0.01);与C2组相比,R2组ROS含量降低(P<0.01);与R1组相比,R2组ROS含量升高(P< 0.01)。
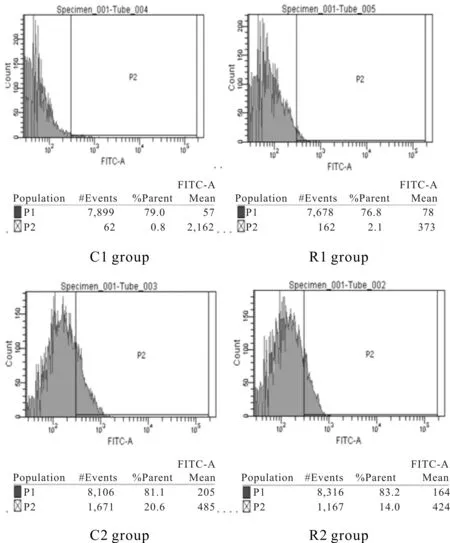
Fig. 3 Effects of resistance training on mitochondrial ROS content of quadriceps femoris in rats
2.4 增龄及抗阻训练的对大鼠股四头肌ΔΨm的影响
由图4、表1所示,与C1组相比,C2组ΔΨm降低(P<0.01);与C2组相比,R2组ΔΨm升高(P< 0.01);与R1组相比,R2组ΔΨm有所降低,但无统计学差异。
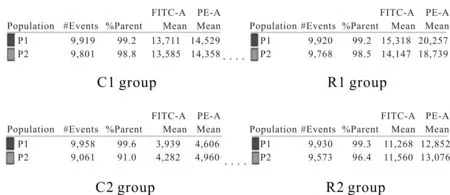
Fig. 4 Effects of resistance training on ΔΨm of quadriceps femoris in rats
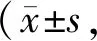
Tab. 1 Effects of resistance training on mitochondrial function of quadriceps femoris in rats n=10)
3 讨论
线粒体动力学在维持线粒体基因、细胞生物合成、细胞内钙离子转运等过程中是必不可少的,同时对线粒体、细胞健康和生物体的正常运转是不可或缺的。线粒体不断进行融合分裂,融合/分裂比率保持在相对平衡的动态变化状态下,维持线粒体结构和功能及细胞能量代谢的正常水平。同时这种平衡状态可以让细胞快速适应外界环境[7]。在线粒体融合的初始阶段,两个线粒体互相接近,位于外膜上的融合蛋白Mfn1/Mfn2结合,使外膜逐渐融合。紧接着OPA1融合蛋白发挥作用,使线粒体的内膜完成融合,最终使两个线粒体的内外膜完成融合,实现线粒体的合二为一。在线粒体的分裂过程中,位于胞质中的Drp1被招募至线粒体外膜,与外膜上的Fis1、Mff、Mid49和Mid51等线粒体分裂蛋白结合,进而发挥作用,使线粒体的内外膜向内凹陷。Drp1蛋白聚集在线粒体凹陷位置, 进一步导致内外膜的断裂, 最终使一个线粒体分裂成两个子线粒体,完成线粒体的分裂过程[8]。本研究发现6月龄安静组大鼠Mfn2蛋白、DRP1蛋白表达均显著低于2月龄安静组,提示在增龄过程中,骨骼肌线粒体融合蛋白Mfn2和分裂蛋白DRP1表达会明显减少,可能与随着年龄的增长,损伤的蛋白质和突变的 mtDNA增加,线粒体功能降低有关。
线粒体动力学变化对线粒体功能具有重要意义。过表达线粒体分裂蛋白可使分裂加速,不利于ATP合成,抑制分裂蛋白表达同样不利于ATP合成。Twig等[9]研究发现,抑制线粒体Drp1和 Fis1 表达后,线粒体分裂过程受到抑制,导致线粒体膜蛋白出现氧化损伤,线粒体呼吸功能下降。在线粒体融合过程中起重要作用的Mfn2蛋白能够促进线粒体内质网Ca2+交换,已有研究表明,高脂饮食下的肥胖小鼠骨骼肌线粒体融合蛋白Mfn1/2 表达降低,同时线粒体呼吸机能下降且ATP 含量降低[10]。离体和在体实验研究发现,敲除骨骼肌线粒体融合蛋白可使线粒体ΔΨm下降、电子链传递过程受阻,ATP合成降低,进而导致线粒体无法修复,蛋白合成受阻,影响细胞能量呼吸及能量合成[11]。Chen 等[12]研究发现敲除小鼠心肌Mfn1后,肌浆网-线粒体 Ca2+调节功能保持正常,但敲除Mfn2 后可引发 Ca2+调节紊乱,而且 NAD(P)H/NAD(P)+ 和 FADH2/FAD比值下降,提示敲除Mfn2将影响线粒体氧化还原平衡性,三羧酸循环及 ATP 合成受限。本研究发现,6月龄安静组大鼠Mfn2蛋白、DRP1蛋白表达均显著低于2月龄安静组,同时胞浆Ca2+和ROS含量较2月龄安静组大鼠显著提高,表明随年龄的增长大鼠肌浆网Ca2+摄取量减少,导致胞浆Ca2+的堆积。推测增龄过程中体内因受到ROS等自由基攻击而造成的损伤不能被及时清除,Ca2+堆积造成线粒体膜流动性下降,质子与离子等物质流动混乱,造成膜内外梯度失衡,进而导致线粒体内的氧化磷酸化反应发生改变,使线粒体的功能受到抑制,ATP生成降低。ΔΨm与膜通透性改变均会造成线粒体膜内外质子梯度失衡,引发一系列级联反应导致细胞凋亡,因而ΔΨm被认为是检测早期细胞凋亡的指标之一。ΔΨm的升高或降低,能较为快速、准确地反映出线粒体的功能[13,14]。本研究发现,随着年龄的增长,ΔΨm显著下降,这可能与线粒体膜通透性改变、线粒体质子梯度受到影响有关。
运动干预能够促进线粒体融合蛋白的表达,提示线粒体融合蛋白可促进氧化磷酸化,进而满足运动时的能量需求。已有研究表明,心力衰竭患者骨骼肌线粒体能量代谢水平、柠檬酸合成酶 (citric acid synthase, CS) 活性及 Mfn2 表达水平均低于健康人,进行6 min的步行试验干预后,Mfn2 表达水平与机体摄氧量峰值和步行距离呈正相关,表明维持线粒体融合能力有助于促进运动干预过程中ATP合成,维持机体运动能力[15]。进行5 周耐力运动干预后,小鼠心肌线粒体融合蛋白Mfn2表达提高,分裂蛋白Drp1 表达降低,同时氧耗率和ATP 含量均表现为显著增加[16],表明耐力训练可提高线粒体融合能力,有利于心肌能量合成。而抗阻运动干预下对增龄大鼠骨骼肌线粒体功能的关系研究较少,本文予以关注。
本研究观察到8周的抗阻训练后2月龄大鼠DRP1蛋白表达增加,6月龄大鼠抗阻训练后线粒体融合蛋白Mfn2、分裂蛋白DRP1表达均增多,且显著高于2月龄抗阻训练组大鼠,表明增龄过程中线粒体动力学功能仍可对抗阻运动产生适应性积极作用。已有研究表明,12周有氧耐力训练提高Mfn2和DRP1 的mRNA转录和蛋白表达程度,促进线粒体融合分裂的动力学平衡,增龄过程中线粒体融合蛋白Mfn2 mRNA和蛋白表达均降低[3],提示运动训练可使线粒体融合分裂更加活跃,提高融合分裂的动态平衡,建立适度水平的动力学平衡。
关于抗阻运动对线粒体功能的影响,国内外学者的研究很多,而结果多数都认为抗阻运动对于线粒体功能具有益处[17,18]。12周有氧运动后老龄大鼠骨骼肌线粒体SOD活性显著提高,MDA含量显著下降,提示有氧运动可以提高老龄大鼠骨骼肌线粒体抗氧化能力,降低脂质过氧化水平,提高三羧酸循环及呼吸链功能,促进线粒体能量代谢,延缓衰老过程中线粒体的退行性变化[19]。本研究发现,通过8周抗阻运动后,2月龄和6月龄大鼠胞浆Ca2+均呈现显著降低,且6月龄干预组大鼠胞浆Ca2+水平明显高于2月龄组,提示随年龄的增长大鼠肌细胞肌浆网Ca2+摄取量减少,导致胞浆Ca2+的堆积,这与Pietrangelo等[20]的研究结果一致。而抗阻运动使增龄的大鼠线粒体摄取及运输Ca2+的功能得到改善,抗阻运动可以有效地改善增龄过程中大鼠线粒体的功能,进一步说明抗阻运动对提高增龄过程中的运动能力有一定的积极作用。ROS含量增加,氧化与抗氧化之间的平衡状态改变,从而推动氧化应激的产生。本研究中,运动干预后6月龄组的ROS水平显著高于2月龄组,表明抗阻运动可有效地对抗增龄引起的ROS水平的升高,而对于2月龄鼠,抗阻运动没有显著影响ROS水平。提示抗阻训练可以在一定程度上加快机体对过量ROS的清除,可以使线粒体功能得到改善,提高机体的抗氧化能力,从而为对抗机体在增龄过程中的机能下降发挥积极的作用。本研究中抗阻训练没有改变2月龄大鼠ΔΨm,而6月龄鼠表现为ΔΨm的显著下降,6月龄抗阻训练组大鼠ΔΨm与2月龄抗阻训练组大鼠相比没有显著性差异。因此本实验研究推测抗阻训练可以有效保持正常线粒体膜的通透性,维持良性的质子梯度,抑制因ΔΨm下降导致的细胞凋亡。
综上所述,抗阻训练可以有效地提高线粒体融合蛋白Mfn2、分裂蛋白DRP1的表达,加快线粒体的代谢与更新的速度,对于增龄大鼠效果尤其明显,同时减少增龄过程中线粒体活性氧的升高,降低胞浆中游离钙离子的堆积,提高大鼠线粒体的膜电位,从而改善增龄引起的线粒体功能下降,但是关于抗阻训练介导的DRP1、Mfn2 对于线粒体功能的调控,进而对增龄过程中的机体产生积极影响的研究仍相对不够透彻,还需要从多角度、多途径来进行深入研究。
