基于高中化学“实验探究”的教学探索
2020-07-31侯磊
侯磊


摘要:基于《普通高中化学课程标准(2017年版)》的课程理念,依据“电离平衡”的相关教学要求,对“弱电解质的电离”进行教学实践,采用实验探究,问题引导,教师深化的教学策略,通过“化学平衡”迁移“电离平衡”。发展学生对水溶液中平衡的认识,深化学生对弱电解质的电离核心概念的理解。
关键词:电离平衡;弱电解质;迁移;实验探究;深化
文章编号:1008-0546(2020)06-0087-03 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2020.06.023
认识科学探究是进行科学解释和发现、创造和应用的科学实践活动;能发现和提出有探究价值的问题;能从问题和假设出发,依据探究目的,设计探究方案,运用化学实验、调查等方法进行实验探究。同时新课标还强调化学学科核心概念的学习,在教学活动中,要充分关注学生已有的知识基础,创设情境唤醒学生的前概念;通过各种负有效率意义的探究活动,将抽象内容可视化,引领学生理解概念,透过概念的宏观表现分析其微观本质;同时,将概念应用于实际问题的解决,既帮助学生深刻理解概念,又可以有效落实化学学科核心素养。
掌握好弱电解质的电离,既是对先前所学有关酸碱盐的相关概念以及电离的深化,同时又是学习水的电离,盐类水解等核心概念的铺垫,从教学体系看,其在反应原理中起到承上启下的作用。同时让同学们感知大千世界纷繁复杂的变化往往都离不开水的参与,整个自然界就是各类物质相互依存、相互制约的复杂平衡体系。在这个系统中,溶剂水与溶质之间存在相互作用,这种作用导致了物质在水溶液体系中变化的多样性和复杂性。学习它们之间的相互作用规律,对于形成与发展学生的微粒观、平衡观和守恒观。
一、学生情况分析及教学目标确定
1.学情分析
学生在必修2时已经学习电解质与非电解质以及强电解质与弱电解质的相关概念。知道强电解质在水中完全电离,弱电解质在水中部分电离。但学生对弱电解质部分电离的原因不是十分明确,以及弱电解质电离程度的认识并不深刻。
2.教学目标
知识与技能:认识弱电解质在水溶液中存在电离平衡,能判断弱电解质在水溶液中电离平衡的方向,理解一定条件下弱电解质的电离平衡移动。
过程与方法:通过对盐酸、醋酸相关实验的探究以及问题的解决,让学生体会变化观念与平衡思想,培养分析问题解决问题的能力。
情感态度与价值观:在一系列实验探究的前提下,使学生感受到探究的奇妙与欣喜,提高科学探究与创新意识的科学素养。
二、教学流程设计及分析
课堂导人:我们都知道,家用洁厕灵可以清洁洁具,其主要成分为HCl,可以看做是HCl与碱类物质反应。那在日常生活中最为常见的为CH3COOH,能否替代HCl清洁洁具呢?
环节1:认知与实验,感受强弱电解质的电离程度差异
学生实验:(1)用pH试纸测量0.1mol/LHCl溶液与0.1mol/LCH3COOH溶液的pH。
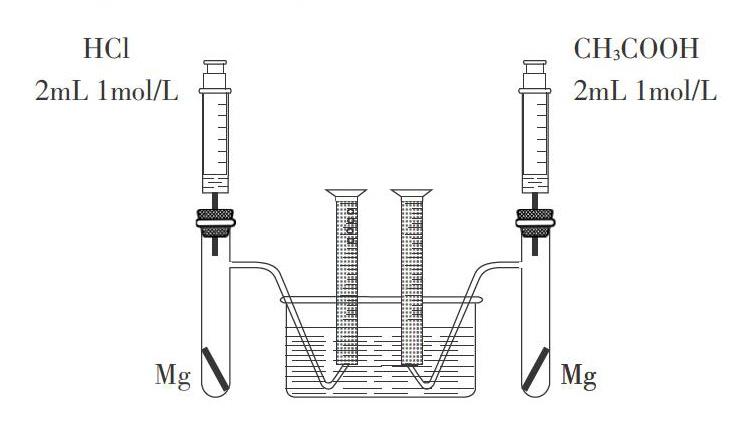
(2)在A、B两试管中分别加入2-3mL HCl与CH3COOH,与一定量的镁条反应。
设计意图:(1)在操作过程中强调实验操作的规范性。
(2)让同学们定性感受相同浓度的酸的“酸性”是有差异的;感知酸的浓度与H+浓度的区别。
演示实验:(1)用传感器检测0.1mol/LHCl溶液与0.1mol/L CH3COOH溶液导电性差异(电流大小不同)
(2)用2mL 0.1mol/LHCl溶液与0.1mol/L CH3COOH溶液分别与过量的镁条反应,观察气体产生快慢的同时比较气体最终的体积。实验装置如图1。
设计意图:(1)如果CH3COOH在水溶液中完全电离,导电程度应该与HCl相当,但二者导电能力相差悬殊,让学生进一步感受强弱电解质电离程度的不同。
(2)镁条与酸反应的实质是镁条与H+反应,刚开始反应慢是因为CH3COOH溶液中电离出的H+较少,但最终产生的气体相差不大,说明CH3COOH在反应过程申会不断电离出H+。
环节2:推理与实验,认识弱电解质的电离是可逆的,存在电离平衡
从左向右我们可以看做是离子化过程。改变条件,如减小c(H+),则离子化程度加大,那是否存在从右向左的分子化过程呢?
实验:(1)测量0.2mol/L CH3COONH4溶液的pH。
(2)量取0.2mol/L CH3COONH4溶液与0.2mol/LCH3COOH溶液各5mL,将两溶液等体积混合后,测量pH,与先前测得0.1mol/L CH3COOH溶液的pH相比较。
设计意图:实验目的是为了让学生感受平衡逆向移动,也就是分子化的过程也是存在的。实验过程等效于在0.1mol/LCH3COOH溶液申加入CH3COO-。使c(CH3COO-)=0.1mol/L,c(H+)減小意味着逆向移动,也就是说离子化与分子化共存,醋酸的电离是动态平衡。
环节3:类比化学平衡,迁移到电离平衡
电离平衡与化学平衡相类似,均在同一时间,同一条件下正逆方向同时进行。先让同学们回忆一下化学平衡的特征:逆动等定变。
电离平衡的特征:
逆:可逆过程,分子化进行的同时离子化也在进行。
动:动态平衡,平衡时为该条件下电离的最大限度。
等:当离子化速率与分子化速率相等时,达到电离平衡。
定:达到平衡时,各个微粒的净生成量或者净消耗量是相等的,即微粒的浓度保持不变。从图像中可以感受到,弱电解质电离的程度一般是很小的。
变:
讨论:在化学反应中当条件(温度、浓度和压强)改变,平衡会发生变化。那么对水溶液中的电离平衡来说,哪些因素会影响?如何影响电离平衡?
(1)温度:(在稀溶液中,电离可看作是化学键的断裂,故电离应为吸热过程)
温度升高,平衡向右移动;温度下降,平衡向左移动。
(2)浓度:(通过分子化与离子化速率的相对大小来衡量)
①在溶液中滴加几滴冰醋酸,离子化速率大于分子化速率,平衡右移。
②在溶液中加入一定量的蒸馏水,离子化速率大于分子化速率,平衡右移。
③在溶液中加入少量醋酸钠固体,离子化速率小于分子化速率,平衡左移。
环节4:学以致用
思考(1)pH=1(c(H+)=0.1mol/L)HCl溶液与CH3COOH溶液各200mL,分别与0.65gZn反应,试画出V(H2)与t的图像。
由于醋酸可不断电离出H+,所以反应开始后醋酸与Zn反应速率较快。Zn为0.01mol,能与酸完全反应,故最终产生的气体是一样的。
思考(2)某浓度的盐酸与Zn反应制备H2时反应过快,为了减缓反应速率,但又不影响气体总量,可以采取什么方法?
①加适量蒸馏水
②加固体CH3COONa
三、教学反思:
1.本课从生活场景人手,采用科学探究为主导贯穿课堂。充分体现学生的主体地位,引导学生的求知、探索的心态,发挥学生的能动性。以生活场景,实验探究,问题解决等驱动教学活动。
2.利用实验探究、迁移应用与学习实践等课堂活动,在学生基于已有的知识与经验基础上能动地建构平衡体系,丰富化学的學科方法与观念。
3.在教学设计中应加强学习内容与生活环境以及社会发展的联系,关注学生的学习兴趣和已有经验,为学生确立终身学习所必备的素养服务。
4.教学过程中会出现一些生成的、不确定的因素,对于这些动态的问题需要教师不断提高掌握课堂的能力,要及时、智慧的引导,教育学生在实践中不断完善。
5.针对水溶液体系的特点,结合实验现象、数据等证据素材,引导学生形成认识水溶液离子反应与平衡的基本思路。
6.摆脱知识本位的教学,因为在强调知识内部的逻辑、知识整体结构的同时,往往出现重结论轻过程、重理论轻实践的现象。长此以往不利于对学生化学学科核心观念的培养。
