牛 PLIN1基因CDS区扩增及时序表达
2020-07-31雷召雄魏大为汪书哲杨梦丽
雷召雄,魏大为,汪书哲,杨梦丽,马 云
(宁夏大学 农学院,银川 750021)
牛肉具有高蛋白、低胆固醇、营养价值高等特点,深受消费者欢迎。有研究报道,牛肉发酵成香肠还可以保留乳酸菌等对人体有益的菌种[1]。近年来牛肉的消费量逐年攀升,牛肉中肌内脂肪含量(IMF)直接影响牛肉的感官特征和大理石花纹的形成[2]。目前,肌内脂肪的含量和成分已经成为评判牛肉品质的重要指标[3]。此外,肌内脂肪中的不饱和脂肪酸具有促进细胞代谢、降低心脑血管疾病发生概率以及抗癌和提高机体免疫力的功能[4-5]。脂肪的生成是一种由调节细胞代谢的激素、酶和代谢物共同作用下的复杂的代谢过程[6],近年来,关于脂肪生成的研究大多集中在调控脂肪代谢的转录因子,如过氧化物酶体增殖物激活受体γ(Peroxisome proliferator-activated receptor γ,PPARγ)、CCAAT增强子结合蛋白α(CCAAT/enhancer binding protein α,C/EBPα)、固醇调节元件结合蛋白-1C(Sterol regulatory element-binding protein 1C,SREBP-1C)、脂肪酸结合蛋白-4(Fatty acid binding protein-4,FABP4)等基因及相关信号通路上。
围脂滴蛋白1(Perilipin1, PLIN1)是脂滴相关蛋白家族的核心成员之一。PLIN1通过与激素敏感性甘油三酯脂肪酶(HSL)和甘油三酯脂肪酶(ATGL)相互作用调节脂肪生成[7]。基础状态下,PLIN1包被在脂滴表面,防止HSL和ATGL接触到脂滴[8],当能量需求增加或促炎细胞因子刺激下,大脂滴分解为小脂滴,相对表面积增加,其表达量减少,同时,PLIN1和HSL蛋白的多个丝氨酸位点被磷酸化,导致对脂滴的保护作用减弱,进而促进脂肪的降解[9-10]。研究认为PLIN1在脂肪生成过程中起关键作用,与脂肪组织中线粒体生物发生相关基因呈正的相互作用[11]。已有许多研究报道了PLIN1在脂滴表面调控脂肪分解的转录机制,PKA磷酸化PLIN1是HSL由细胞质转移到细胞核中直接与脂滴接触的重要条件[12]。先前的报道显示,在人类成熟的白色脂肪细胞中PLIN1可以激活脂肪细胞特异性脂滴相关蛋白Cidec/Fsp27,从而显著增加脂质交换、转移和脂滴的生长[7]。研究表明,PLIN1基因在肥胖人群中高表达,已作为人类肥胖风险的候选因子[13]。PLIN1蛋白对脂肪分解的调控还受到表观遗传的影响,即PLIN1启动子区的CpG甲基化水平[14],如,PLIN1的甲基化水平会影响1~7周龄的脂肪型鸡和瘦肉型鸡体内PLIN1的mRNA水平和腹部脂肪百分比[15]。小鼠模型中的研究表明,PLIN1缺乏会导致脂肪含量降低,同时证明敲除PLIN1可能是一种抵抗肥胖的有效途径[16-17]。以上研究提示PLIN1已作为脂肪生成的关键调节因子,但是对牛脂肪代谢的调控机制目前尚不完全清楚。
因此,本试验欲通过基因克隆的方法得到牛PLIN1的编码区全长序列;并利用qPCR检测PLIN1在牛前体脂肪细胞诱导分化过程中的表达模式,为进一步揭示PLIN1调控牛脂肪生成的分子机制提供基础数据。
1 材料与方法
1.1 试验材料
1.1.1 组织样采集 用于基因克隆的荷斯坦公牛为2岁左右,由宁夏农垦贺兰山清真牛羊产业(集团)有限公司提供。于屠宰点采集荷斯坦牛腹部脂肪、背部脂肪和肾周脂肪,快速用手术剪分离成黄豆大小放入冻存管投入到液氮罐中,带回实验室冻存于-80 ℃冰箱,备用。
1.1.2 细胞样采集 用于时序分析的脂肪细胞来自荷斯坦牛皮下脂肪组织,于屠宰点分离后置于含双抗体积分数为1%的PBS中带回实验室。

1.2 试验方法
1.2.1 组织总RNA的提取和cDNA的获得 采用组织块研磨的方法并按照Trizol试剂盒说明书提取组织总RNA,利用核酸定量仪检测总RNA的质量浓度及OD值(OD260/OD280的比值在1.8~2.0时符合要求)。并根据反转录试剂盒说明书将获得的总RNA反转录成cDNA,保存于-20 ℃冰箱,备用。
1.2.2PLIN1基因CDS区扩增 根据Gen-Bank(登录号:NM_001083699.1)上公布的牛PLIN1的序列,利用Primer 5.0软件设计PCR引物(表1),由通用生物系统(安徽)有限公司合成。PCR反应体系为15 μL:2×TaqPCR Master Mix 7.5 μL,cDNA 1 μL,上下游引物各0.5 μL,ddH2O 5.5 μL,采用降落式PCR设计多循环反应程序:第1 次循环,预变性5 min(95 ℃),变性30 s(95 ℃),复性30 s(61 ℃),退火130 s(72 ℃),10个循环,每个循环温度降低1 ℃;第 2 次循环,变性30 s(95 ℃),复性30 s(61 ℃),退火130 s(72 ℃),延伸5 min(72 ℃),30个循 环。PCR产物3 μL用10 g/L琼脂糖凝胶电泳检测。

表1 引物信息
1.2.3PLIN1基因T载体连接及测序 将降落PCR扩增所得的目的基因用胶回收试剂盒纯化回收,并用PMD-18T载体在4 ℃过夜连接,将连接产物转入大肠杆菌DH5α感受态细胞后,挑选阳性菌落,采用菌液PCR验证后,将含有目标片段的菌液送往通用生物系统(安徽)有限公司进行测序。
1.2.4 牛皮下脂肪细胞的分离培养 采用组织块法和消化法分离培养牛皮下前体脂肪细胞,方法参照文献[18]。
1.2.5 牛前体脂肪细胞的诱导分化 待F3代细胞融合度达到100%时,将培养基更换为诱导分化培养基(含10 μg/mL胰岛素、1 μmol/L地塞米松、0.5 mmol/L IBMX和1 μmol/L罗格列酮的完全培养基),诱导2 d后,小心弃去诱导分化培养基,加维持分化培养基(含10 μg/mL胰岛素和1 μmol/L罗格列酮的完全培养基),每2 d换液1 次并收集一批细胞。诱导10 d后,收获最后一批细胞,用于qPCR分析。
1.2.6 细胞总RNA的提取及PLIN1时序表达谱检测 细胞总RNA的提取方法、检测方法及保存方法同组织提取法。采用qPCR技术检测牛皮下脂肪细胞分化0 d、2 d、4 d、6 d、10 d中PLIN1的相对表达水平,同时检测成脂标志基因PPARγ在脂肪细胞分化过程中的表达模式,以细胞cDNA(原液稀释5倍)为模板进行实时荧光定量PCR,反应体系:SYBR Green 7.5 μL,cDNA 4 μL(cDNA原液稀释5倍),10 μmol/L 上下游引物各0.3 μL,RNase-free ddH2O 2.9 μL。反应程序:预变性3 min(95 ℃),变性10 s(95 ℃),退火20 s(60 ℃),延伸30 s(72 ℃),设置40个循环,内参基因选用β-肌动蛋白(β-Actin)。
1.2.7 数据分析 2-ΔΔCt法分析荧光定量的结果,数据以“平均值±标准误”表示。用SPSS 18.0软件进行单因素方差(one-way ANOVA)分析,其中P<0.01为差异极显著,P<0.05为差异显著。
2 结果与分析
2.1 牛 PLIN1基因序列分析
根据牛PLIN1序列设计特异性引物,采用RT-PCR的方法扩增得到牛PLIN1基因,预测扩增片段长度为1 717 bp(图1-A)。测序后分析可得其CDS区长度为1 551 bp,编码517个氨基酸,利用Chromas软件分析测序结果,发现均为单一峰(图1-B),利用DNAMAN软件将克隆得到的序列与NCBI已有数据比对,发现相似度高达99.42%(图1-C)。表明克隆获得的序列是牛PLIN1基因CDS区。

A.牛 PLIN1基因PCR扩增琼脂糖凝胶电泳检测结果;B. PLIN1基因pDM-18T载体测序图谱;C.测序得到的牛 PLIN1基因序列与数据库已有序列比对结果
2.2 分离培养牛前体脂肪细胞
采用组织块法和消化法分别分离培养牛前体脂肪细胞,组织块接种到培养皿10 d 后可观察到组织块周围游离出大量细胞(图2-A),随即消化贴壁细胞,进行融合培养,待培养皿中细胞密度达到90%以上(图2-B)后冻存,备用;消化法分离的牛前体脂肪细胞在培养第3天即观察到少量细胞(图2-C),培养到第10天后视细胞生长密度(图2-D)进行冻存,备用。
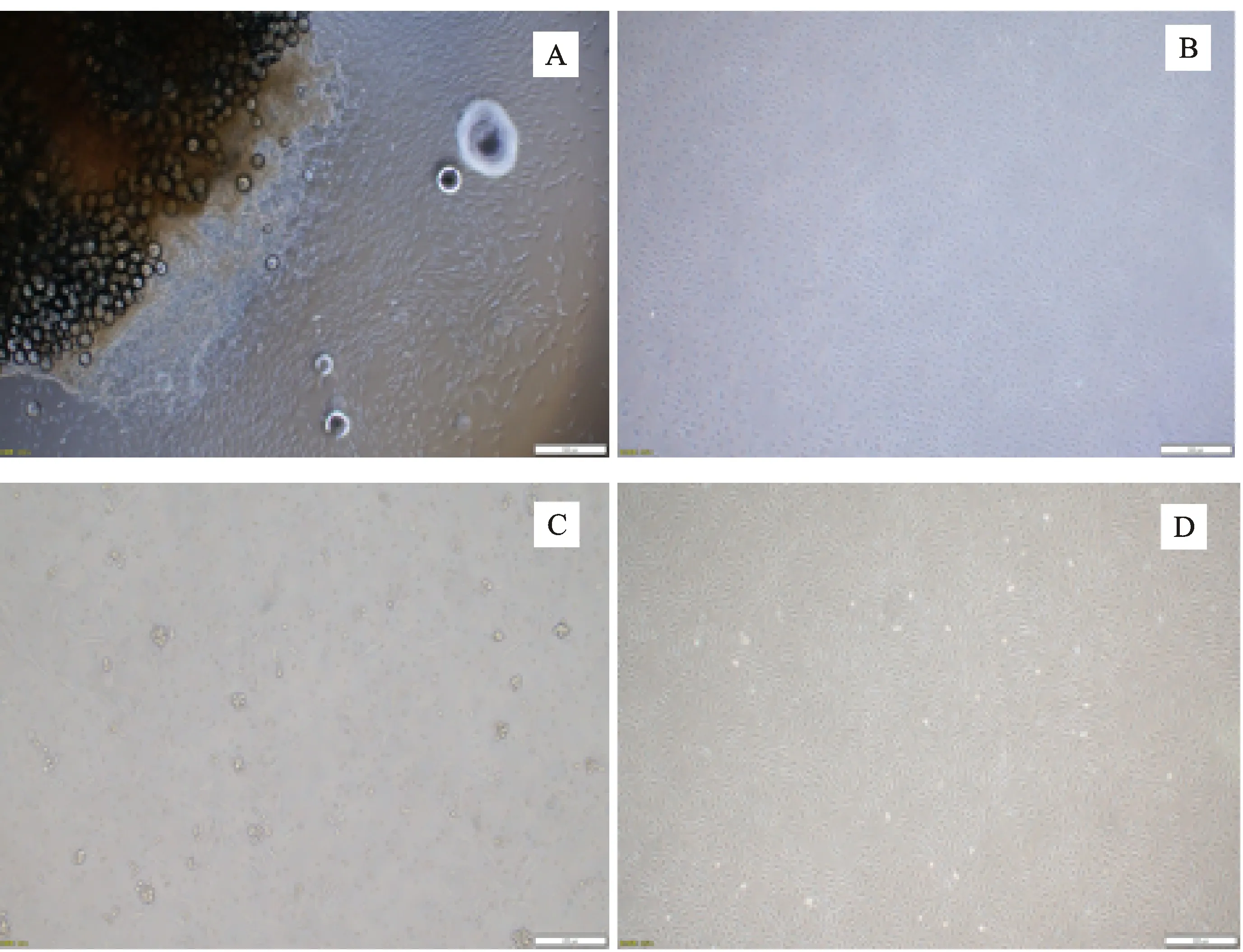
A.组织块法培养10 d后;B.组织块完全融合;C.消化法分离培养3 d后;D.消化法完全融合
2.3 诱导分化牛前体脂肪细胞
复苏事先分离冻存的牛前体脂肪细胞,培养8 d(图3-A)后将二代细胞传代继续培养至融合度达到90%以上,然后传代至六孔板中,继续培养 6 d后(图3-B)细胞基本融合。

二代完全融合的牛前体脂肪细胞(A),三代完全融合的牛前体脂肪细胞(B)
2.4 牛 PLIN1和 PPARγ细胞时序表达分析
qPCR检测PLIN1和PPARγ基因在牛前体脂肪细胞分化过程中的表达模式,结果如图4所示。PLIN1基因在脂肪细胞分化的第0天几乎不表达,随着分化时间的推移,PLIN1表达量逐渐上升,第6天显著升高(P<0.05),直到分化的终末阶段,第10天时表达量达到最大(P<0.01);PPARγ在脂肪细胞分化的第0天就开始表达,之后不断上调,在第6天和第10天时差异达到显著水平(P<0.05)。
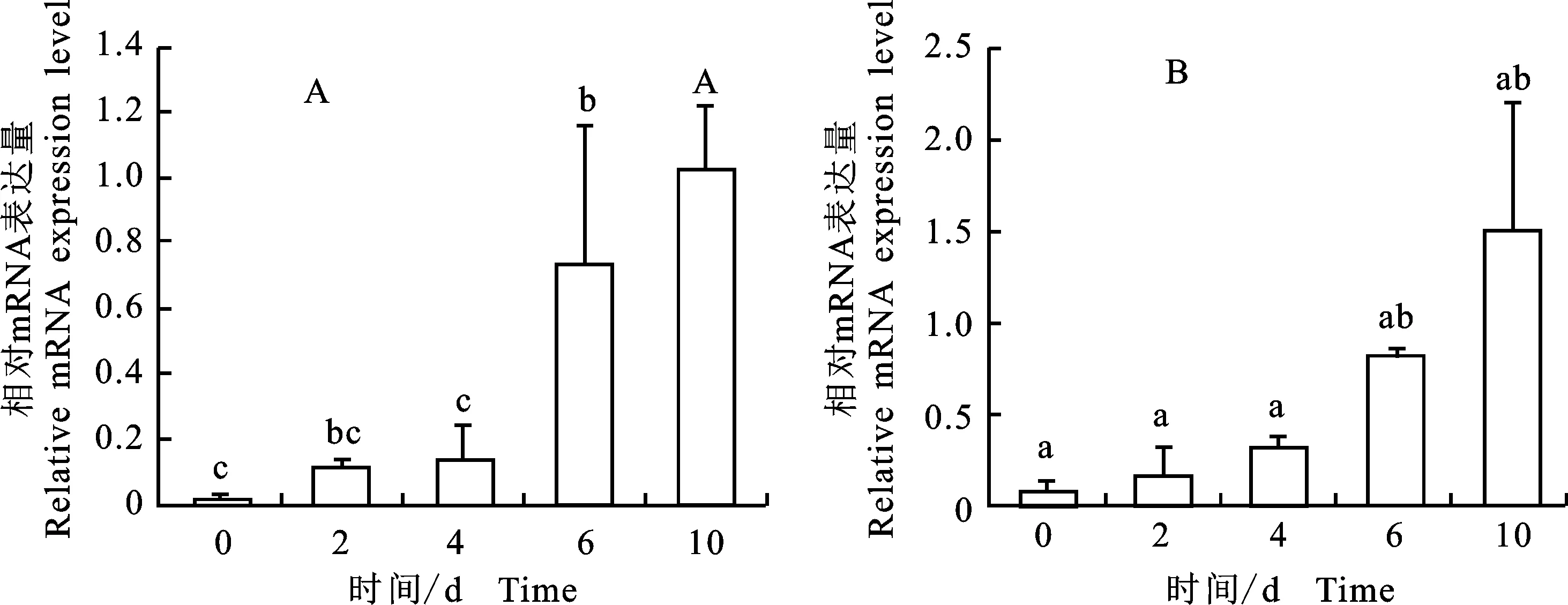
相同字母表示差异不显著,不同字母表示差异显著(P<0.05),大写字母表示差异达到极显著水平(P<0.01)
3 讨 论
脂肪细胞是机体正常生理的关键调节器,包括能量平衡、营养稳态和组织稳态[19],白色脂肪细胞在哺乳动物体内以脂滴储存的形式作为主要的能量平衡器官,也是重要的内分泌器官,能分泌激素和细胞因子[20],随着多房脂滴的出现,白色脂肪细胞向棕色脂肪细胞转化,化学能转变成热能[21]。PLIN1蛋白定位于脂滴表面,与脂滴表面脂肪酶发生互作,调控脂肪的代谢[20]。因此,本研究克隆得到牛PLIN1基因的编码区序列,并研究PLIN1在牛前体脂肪细胞分化过程中的表达模式,为解决PLIN1调控牛脂肪代谢的分子机制提供基础参考数据。
本研究得到牛PLIN1基因的CDS区全长为1 551 bp,编码517个氨基酸,与NCBI数据库中的结果一致,先前在人类上的研究表明,PLIN1基因与女性的体质量指数呈现显著的正相关,同时推测PLIN1基因调节人体的体质量和代谢变量[22],由于PLIN1蛋白参与脂肪组织中三酰甘油的水解过程,因此,研究者在PLIN1突变的小鼠模型中发现脂肪量显著降低[23];以上报道说明PLIN1的表达与脂肪的代谢密切相关。因此,本试验采用组织块法和消化法分离培养牛前体脂肪细胞,鉴定在脂肪细胞诱导分化过程中PLIN1的表达模式,前期分离得到贴壁生长并在形态多呈圆形或椭圆形的脂肪细胞,研究显示,前体脂肪细胞在培养的分化过程中多为圆形,并且随分化时间的增加,逐渐出现脂滴的聚集[24],由此,本试验成功分离得到了牛前体脂肪细胞。
PPARγ是调节脂肪细胞分化的关键转录因子。在PLIN1基因启动子区存在功能性的PPARγ的特异性应答元件PREE[25],在脂肪组织中PPARγ与PREE结合激活PLIN1的表达。同时多项研究证明,过氧化酶体增殖物激活受体(PPAR)信号通路与脂肪的发生密切相关,PLIN1显著富集在PPAR信号通路中[26-27]。因此,在本试验中分离培养牛前体脂肪细胞,并对其进行诱导分化,同时检测PLIN1和PPARγ在细胞分化过程中的表达模式,结果显示,PLIN1在诱导分化的0 d不表达,此后表达量逐渐上升,与第2天相比,在分化的第6天(P<0.05)和第10天(P<0.01)表达量达到最大,由此推测,PLIN1的高表达可能是因为细胞内脂滴聚集的结果。最近在秦川牛上的研究结果同时表明PLIN1在牛脂肪组织中表达量最高,在细胞分化的第6天和第8天表达量最高,第10天有所下降[28],与本研究中随着分化的进行表达量逐渐增加的结果有差异。该报道中并未分析第10天脂肪细胞中PLIN1表达量下调的原因,后续将继续开展重复试验验证两种结果。PPARγ在牛前体脂肪细胞分化的第0天低表达,此后逐渐上升,在分化的第10天(P<0.05)达到最大,先前有研究者报道的在牛前体脂肪细胞分化过程中PPARγ的表达模式与本研究得到的结果一致[29]。以上研究结果进一步证实PPARγ激活了PLIN1基因的表达,脂肪组织中PLIN1特异性高表达的转录调控机制将是后续研究的重点。
本试验利用基因克隆的方法得到牛PLIN1基因CDS区全长序列;采用组织块法和酶消化法成功分离得到牛前体脂肪细胞;利用qPCR技术检测在牛前体脂肪细胞分化过程中PLIN1和PPARγ的表达模式,为进一步解析PLIN1调控牛脂肪组织生成的分子机制提供参考数据。
