CRMP2真核表达质粒在大鼠缺血/再灌注脑皮质转染效率的对比研究
2020-07-31幸享凤王玉张融融秦新月王恬竹
幸享凤,王玉,张融融,秦新月,王恬竹
Collapsin 反应调节蛋白 2(Collapsin response mediator protein 2,CRMP2)是中枢神经系统里的一种多功能衔接蛋白,与细胞骨架上配体结合后可调节多种神经生理活动,如微管动力学、轴突出芽及回缩、神经分化、树突/轴突特化、依赖驱动蛋白的轴突转运、钙离子内态稳定性、神经介质的释放等[1-3]。研究发现,在脑缺血情况下CRMP2 上调是一种有效的神经保护方式[4]。因此,本实验拟通过外源性干预使脑内过表达CRMP2 来进一步研究其潜在的神经保护机制,包括改善凋亡、调节神经递质释放以及对神经再生的影响。立体定向注射外源性病毒、质粒已成为一种广泛应用的手段,常选择侧脑室、海马、前额皮质及嗅侧皮质等部位作为注射点。本课题组前期研究采用侧脑室、皮质、海马联合皮质三种方式进行病毒转染[1,5,6],均取得理想效果;但并不清楚哪种方式的转染效果更佳。所以本实验旨在探索注射真核表达质粒的适宜部位,为进一步研究CRMP2转染后的干预机制奠定实验基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康成年雄性7~8周龄SD大鼠,体质量280~300 g,由重庆医科大学实验动物中心提供。
1.1.2 主要试剂与仪器 CRMP2 真核表达质粒pCDNA3.1+(购于上海生工公司),兔抗CRMP2(购于美国CST 公司),RNA 提取、逆转录及扩增试剂盒(购于Takara 公司),山羊抗兔二抗(购于碧云天公司),PI(购于美国Sigma 公司)。大鼠脑立体定位仪(购于深圳瑞沃德公司)。
1.2 方法
1.2.1 动物分组 根据空白质粒不同的注射部位进行分组,30 只大鼠随机分为正常(normal)组、对照(control)组(单纯缺血再灌注)、侧脑室加空质粒(LV+VP)组、海马加空质粒(H+VP)组、皮质加空质粒(C+VP)组、嗅球加空质粒组(OB+VP),每组5只。根据真核表达质粒不同注射部位进行分组,另选大鼠150只,随机分为空白质粒(VP)组、侧脑室(LV)组、海马(H)组、皮质(C)组及嗅球(OB)组,每组30 只,24 h 和48 h各15 只,其中5 只用于绿色荧光蛋白(green fluorescent protein,GFP)检测,5 只用于Western blot 检测,5 只用于RT-PCR 检测。选定注射部位后,根据质粒注射情况进行分组,另选取大鼠20 只,随机分为假手术(sham)组、缺血再灌注(MCAO 组)、缺血再灌注加空白质粒(MCAO+GFP)组、缺血再灌注加CRMP2真核质粒干预(MCAO+CRMP2/GFP)组,每组5 只,用于TTC染色和神经功能评分。
1.2.2 大鼠大脑中动脉缺血/再灌注模型制备 参照本课题组前期的实验操作方法[1]:大鼠经腹腔注射10%水合氯醛(0.35 mL/100g),固定在操作台上,脑正中切口,固定好PF5000脑血流检测仪p407探头于右侧大脑中动脉供血区域,随后大鼠仰卧固定,颈正中切口,分离出右侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)、颈内动脉(internal carotid artery,ICA),游离ECA,夹闭 ICA 和CCA,将直径0.20 mm、头端0.40 mm线栓从ECA缓慢逆行插入ICA,在18~20 mm 处感阻力,并检测到血流下降达70%以上,结扎固定线栓,2 h 后再灌注。进行Longa评分,1~3分纳入实验,0、4分及取材有蛛网膜下腔出血者剔除,同批次模型中随机补充。
1.2.3 脑立体定位注射 以前囟为坐标原点,四个部位的坐标点分别为:右侧两点皮质(2,1,-1.5)mm,(2,-3.0,-1.5)mm;右侧侧脑室(1.2,-1.5,-4.5)mm;右侧海马(2,-3.0,-3.5)mm;右侧嗅球(1.7,+7.1,-3.8)mm。大鼠缺血/再灌注模型成功后立即进行立体定向手术,CRMP2真核表达质粒(160 ng/μL)或空载体质粒(160 ng/μL)分别注射到对应组别的对应靶点,每个点注射质粒4 μL,注射速度为0.3 μL/min,注射完毕后留针5 min。
1.2.4 激光共聚焦检测GFP 为检测质粒在脑内转染情况,分别于再灌注后24 h 及48 h 采用激光共聚焦观察GFP荧光。
1.2.5 Western blot 检测 质粒注射24 h、48 h 后将大鼠断头取脑,取右侧缺血区皮质液氮速冻后-80 ℃保存。按照蛋白提取说明书提取总蛋白,绘制标准曲线,计算蛋白浓度,配平至5 μg/μL。蛋白样品在10%的SDS-PAGE凝胶中分离后,转移至PVDF膜上,5%脱脂牛奶封闭90 min,CRMP2(65 kD)一抗(1∶1 000)4 ℃孵育 18 h,山羊抗兔二抗(1∶1 000)37 ℃孵育 1 h 后,Fusion cap凝胶扫描分析。
1.2.6 RT-PCR 检测 标本收集同Western blot,采用Trizol 一步法提取缺血区皮质总RNA,紫外分光光度仪测定A260/A280比值,在1.8~2.2范围内者用于实验。参照RNA逆转录试剂盒说明书合成cDNA于-20 ℃保存。上游:5'TCC GGT CTG TTC TGG CTT TTT C 3',下游:5' AGG GTC CGC TCA GGC TGT GTC 3'(CRMP-2,162 bp)。 按 照 SYBR Prime Scripttm RT-PCR 试剂盒说明书,进行聚合酶链反应。
1.2.7 脑梗死体积检测及神经功能评估 脑缺血再灌注24 h后,参照课题组前期的评分标准及脑梗死体积评估方法进行神经功能评分及TTC染色[5],评分者单盲。
1.3 统计学处理
采用SPSS22.0统计学软件分析数据,计量结果以()表示,多组间比较运用AVONA分析,方差齐性资料两两比较行LSD检验,方差不齐则用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 质粒转染效率的观察
2.1.1 不同部位注射空白质粒之后CRMP2的表达与normal组相比,脑缺血再灌注后CRMP2的表达明显降低(P<0.05)。注射空白质粒之后,各组CRMP2的表达与control 组相比差异无统计学意义(P>0.05);各个部位注射空白质粒之后,CRMP2的表达差异无统计学意义(P>0.05),见图1。因此,后续研究选择(LV+VP)组作为对照。

图1 各部位注射空白质粒之后CRMP2的表达(n=5,)
2.1.2 CRMP2 真核表达质粒转染后脑组织中GFP 的表达 海马和侧脑室注射CRMP2 真核表达质粒后24 h 及48 h 激光共聚焦结果显示,24 h 侧脑室和海马的GFP的表达量均较48 h多,见图2、表1。
2.1.3 缺血侧皮质CRMP2 的表达对比 注射真核表达质粒后 24 h 及 48 h,各组 CRMP2 表达量均较 VP 组高(P<0.05);同一时间点,LV组与H组之间CRMP2表达差异无统计学意义,且均较C 组和OB 组高(P<0.05);C 组与OB 组相比差异无统计学意义(P>0.05);不同时间点组内比较,CRMP2 表达差异无统计学意义,见图3。
2.2 过表达CRMP2 对大鼠脑缺血再灌注后保护作用的观察
再灌注后24 h,(MCAO+CRMP2/GFP)组大鼠梗死灶较MCAO 组及(MCAO+GFP)组明显缩小(P<0.05)。与sham组比,其余三组神经功能评分显著降低(P<0.05),过表达CRMP2 干预后,能明显改善大鼠的神经功能缺损情况(P<0.05)。以上结果进一步证实,CRMP2真核表达质粒不仅能成功转染大鼠脑组织,还能发挥神经保护作用,见图4、表2。

图2 GFP在大鼠颅内的表达情况(n=5,)
表1 真核表达质粒24 h和48 h在大鼠颅内的转染率①(%,)
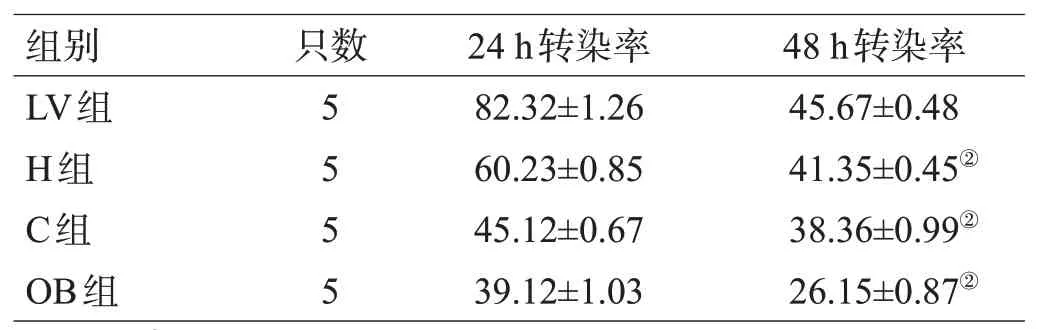
表1 真核表达质粒24 h和48 h在大鼠颅内的转染率①(%,)
注:①转染率:以注射孔为中心,相同的间距不连续取3个脑片,选取周围5 个区域计算转染细胞的数量;与24 h 比较,②P<0.05
48 h转染率45.67±0.48 41.35±0.45②38.36±0.99②26.15±0.87②组别LV组H组C组OB组只数5 5 5 5 24 h转染率82.32±1.26 60.23±0.85 45.12±0.67 39.12±1.03
3 讨论
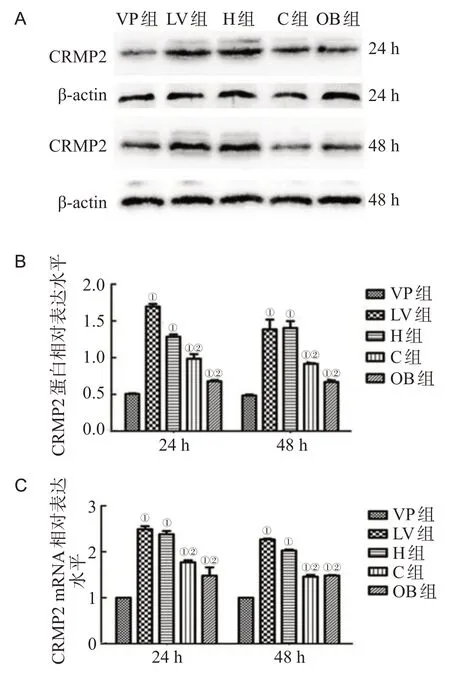
图3 各组大鼠脑组织CRMP2的表达(n=5,)

图4 脑缺血再灌注后24 h各组大鼠脑组织TTC染色(n=5,)
表2 脑缺血再灌注后24 h各组大鼠脑梗死体积及神经功能评分()

表2 脑缺血再灌注后24 h各组大鼠脑梗死体积及神经功能评分()
注:与sham组比较,①P<0.05;与MCAO组比较,②P<0.05;与(MCAO+CRMP2/GFP)组比较,③P<0.05
组别Sham组MCAO组(MCAO+GFP)组(MCAO+CRMP2/GFP)组只数5 5 5 5脑梗死体积百分比/%0.00±0.00 44.89±0.44①44.06±0.61①③24.72±0.59①②神经功能评分/分14.17±0.47 6.83±0.47①7.00±0.37①③9.33±0.42①②
CRMP2 已被证实在中枢神经系统中大部分神经元及少突胶质细胞内保持着高表达[7]。其通过调节基因的多态性、蛋白质的表达及RNA翻译后修饰等作用而参与阿尔兹海默病、精神分裂症及亨廷顿病等神经系统疾病的病理生理过程[8-10]。在大鼠脑缺血模型中,CRMP2 调节了NMDA 受体的功能,稳定了钙离子内流[11]。Shadia 等[12,13]研究发现银杏制剂 EGb761 脑缺血的脑保护作用,即缩小了脑梗死体积,减轻了细胞凋亡,CRMP2参与其具体的传导通路。因此,CRMP2对脑组织具有多重的神经保护作用。
为了深入研究CRMP2对MCAO大鼠的神经保护机制,本研究选择真核表达质粒作为基因干预载体,从不同部位外源性导入,使动物脑组织过量表达CRMP2,结果表明GFP的表达在24 h较48 h高。已有研究发现采用真核表达质粒转染动物细胞,其选择评价指标的时间点为转染后48 h[14,15],从而推测,真核质粒转染效率达到高峰需要的时间可能为48 h左右。结合本研究结果推测CRMP2 真核质粒的转染高峰时间可能在24~48 h。注入CRMP2 真核表达质粒后,24 h及48 h LV组及H组CRMP2的mRNA及蛋白在缺血区皮质的表达较其余组高(P<0.05),提示真核表达质粒能较好地转染大鼠脑组织,使目的基因及其蛋白高表达。通过表达量的横向比较,侧脑室或海马为更适宜的注射部位。尽管LV组与H组之间差异不明显,但前者CRMP2的表达稍高。此外,注入侧脑室的物质通过多种方式扩散到达其他部位的相应神经元,其中经室管膜扩散是其中一种方式[16]。在脑缺血的情况下,室管膜及室管膜下区是神经干细胞增殖的主要区域,参与神经的修复及再生[17],CRMP2可能对神经干细胞的增殖有一定的促进作用。综上,本研究选择将侧脑室作为后续研究中的立体定位注射靶点,同时发现过表达CRMP2 之后能缩小脑梗死体积,减轻神经功能缺损。进一步证实,从侧脑室注射真核表达质粒,不仅能使脑内CRMP2成功过表达,而且还发挥其对大鼠缺血脑损伤的保护作用。
在神经系统疾病,如脑梗死、脑出血、阿尔兹海默症及帕金森病等的研究中,常会涉及外源性干预机制,部分是需要立体定向注射药物或者基因载体[18,19]。注射部位的选择以经验性选择为主,本研究则证实不同部位注射之后的的效果差别,为后续研究提供了依据。本研究筛选出侧脑室作为注射部位,并且证实成功转染的真核质粒能有效发挥其功能,为后续研究CRMP2 对大鼠缺血再灌注损伤后的神经保护作用及机制提供了实验基础。
