镉砷在线蚓中的毒物-毒效动力学过程及定量模拟
2020-07-31黄雪莹何尔凯仇荣亮
李 敏,龚 冰,黄雪莹,肖 雪,何尔凯*,仇荣亮
(1.中山大学环境科学与工程学院,广州510006;2.上海交通大学环境科学与工程学院,上海200240;3.广东省环境污染控制与修复技术重点实验室,中山大学,广州510006;4.岭南现代农业科学与技术广东省实验室,华南农业大学,广州510642)
随着人类社会经济的快速发展,土壤重金属污染形势日趋严峻,在导致土壤环境产生污染的元素中,重金属镉(Cd)、类金属砷(As)问题尤为突出,已引起人们的广泛关注[1]。环境中的Cd主要来源于核工业、农业、电镀及化工领域[2],As 主要来源于采矿、冶炼及化石燃料的燃烧[3-4],这些人为来源产生的Cd、As大量进入水体和土壤中,对生态环境造成潜在危害。在自然界中过量的Cd、As等毒性元素不可降解,被生物吸收后会在其体内不断累积,根据毒性阈值假设(Critical body residue,CBR),当累积浓度达到元素的毒性阈值时就会诱导产生相应的毒性效应[5]。研究发现,Cd 污染会抑制米氏凯伦藻细胞的增长[6],造成玉米、黄瓜叶片发黄、生长缓慢[2]。As 污染会对淡水鱼的皮肤造成损伤,引起肌肉萎缩恶化[7-8],As进入人体后还会蓄积在甲状腺、肾以及头发等处,对人体健康造成严重危害[9]。
以往对金属的毒理学研究多关注某一固定暴露时间下对生物体的毒性效应,以此确定污染物的生态风险。然而研究显示污染物在生物体内的累积过程具有时间依赖性,导致毒性效应会随暴露时间而变化[10]。Zhang 等[11]研究发现随着时间的增加,铅(Pb)暴露下线蚓的存活率明显下降;He 等[12]研究表明随着暴露时间的增加,金属镍(Ni)对线蚓的半数致死浓度(LC50)逐渐变小。由此可见,基于急性毒性结果往往不能全面反映污染物的长期暴露风险。因此,为准确评估不同时间尺度下的生态风险,有必要深入开展Cd、As的动态毒性效应研究,建立健全重金属污染土壤风险评估和环境质量标准体系。利用毒物毒效动力学模型(TK-TD)可以同时考虑暴露浓度与暴露时间的影响,从而阐明污染物在生物体内的累积和毒性作用过程[13-14]。毒物动力学描述了污染物在暴露期间从体外进入体内的过程,包括其吸收、分布、生物转化和排除;毒效动力学过程将体内浓度和毒性作用有机地联系在一起,描述了时间和毒性响应的关系,包括机体损伤和恢复过程。
除了暴露时间外,生物有效性是影响污染物毒性的另一重要因素。重金属的环境暴露浓度通常被作为指示毒性效应的暴露剂量,然而金属的毒性实际是由其被生物吸收并和毒性作用位点结合的部分(即生物有效浓度)决定的[15]。金属的生物有效性受到环境因素,如:pH 值、环境共存阳离子、有机/无机配体等的影响[16-18]。相较于重金属的环境暴露浓度,体内浓度考虑了生物吸收过程中环境因素对重金属生物有效性的影响,因此能更好地指示毒性作用[12,19]。对于进入到生物体内的金属,生物体也能够通过调控金属与毒性作用位点的结合来降低其毒性作用[20]。研究Cd、As在线蚓体内含量与毒性作用的相关性,对理解其生物有效性具有重要意义。
线蚓(Enchytraeus crypticus)属于环节动物门寡毛纲单向蚓目线蚓科,广泛分布于多种土壤中,因其生命周期短、繁殖率高、对土壤特性(例如pH值、黏土含量、有机质含量、温度)的耐受范围大[21-22],且对环境胁迫较为敏感,已成为陆生生态毒理学研究的重要模式生物,能够用以预示土壤的生态和环境健康状况。在土壤-动物研究体系中,目前对重金属进入土壤中的环境行为过程已有较多了解,但对于不同时间尺度下重金属对土壤动物的毒性效应过程认知较少,因此,有必要构建TK-TD 模型定量描述Cd、As 在线蚓中的动态累积和毒性作用过程。
本文以我国污染土壤中常见的Cd、As 为研究对象,典型土壤动物线蚓(Enchytraeus crypticus)为受试生物,采用室内试验和模型拟合等手段,系统研究Cd、As对线蚓的动态累积和毒性作用过程,从毒物动力学-毒效动力学角度阐明Cd、As毒性作用机制。以期深入了解Cd、As 作用下土壤动物的毒性响应规律和机理,为精准评价Cd、As污染对陆生生态系统的影响提供科学依据和理论支撑。
1 材料与方法
1.1 受试生物
线蚓(Enchytraeus crypticus)因对重金属、有机物等化学物质的敏感性而作为模式生物广泛应用于土壤生态毒理学试验中[22]。本试验中的受试生物线蚓取自中山大学环境科学与工程学院,线蚓被置于温度为20 ℃、相对湿度为75%的黑暗气候室中,在琼脂培养基上进行培养和繁殖。每周给其喂两次燕麦制成的食物。选取同一时期繁殖、长度约为1 cm 且大小相对一致的线蚓成虫用于毒性试验,可通过观测其头部是否具有白色的生殖环带来确定其是否为成虫。
1.2 暴露介质
本研究采用溶液-惰性沙体系作为暴露介质。从河滩采集的沙经自来水不断冲洗干净后烘干,用60 目的筛网分选得到颗粒较小的沙粒,随后置于600 ℃的马弗炉中烧制3 h 以去除沙中的有机质,待冷却后用2%~3%的硝酸浸泡0.5 h,以去除有机残留物及铁锰的碳酸盐化合物,浸泡之后用自来水冲洗,洗去残余的酸,再用去离子水清洗,最后置于60 ℃的烘箱中烘干后即可得到惰性沙。
用含有0.2 mmol·L-1Ca2+、0.05 mmol·L-1Mg2+、2.0 mmol·L-1Na+和0.078 mmol·L-1K+的模拟土壤溶液作为基础溶液,制备不同浓度的Cd(CdCl2·2.5H2O)、As(Na3AsO4)暴露溶液。用0.75 g·L-1MOPS[3-(N-吗啉代)丙烷磺酸]和0.75 mg·L-1MES[2-(N-吗啉代)乙烷磺酸]pH缓冲液将所有暴露溶液的pH调节至6.0。
1.3 毒性测试
动态累积和毒性测试设置6 个不同的暴露时间:1、2、4、7、10 d 和14 d。Cd、As 的暴露浓度分别设置为:0.04、0.08、0.16、0.20、0.24、0.32、0.40、0.48 mmol·L-1和0.20、0.40、0.80、1.00、1.60、2.00、2.40 mmol·L-1。每个处理设置3 个重复,每个重复称取20 g 制备好的惰性沙,然后分别加入5.5 mL 配制好的暴露溶液,放置24 h 使其达到平衡即得到模拟土壤溶液体系。待体系平衡1 d 后,选择10 条线蚓成虫放入平衡体系中进行毒性暴露[12]。
整个试验暴露期间均在温度为25 ℃、相对湿度为75%、光照16 h、黑暗8 h的人工气候室进行,且在暴露期间每2 d给样品补充因蒸发作用而失去的水分,确保整个试验过程中相对稳定的暴露浓度。为避免食物中有机质对金属形态的影响,在此期间不进行喂食。在每个毒性试验暴露终点统计线蚓的死亡率,收集存活的线蚓,用高纯水清洗数遍,去除线蚓表面残留的暴露溶液,然后放入-20 ℃的冰箱中保存待测其体内浓度。
1.4 样品测试及数据分析
将收集到的线蚓样品冷冻干燥至少48 h,并用微量天平(Mettler-Toledo XPR2U)称质量,然后转移到洁净的玻璃管中,加入HNO3(65%~68%,GR)通过逐步升温加热步骤消解线蚓样品,将玻璃管中的残留物溶于5 mL HNO3(1%)中,用电感耦合等离子体质谱法(ICP-MS;NexION 350D;Perkin Elmer)分别测定线蚓体内Cd、As 的浓度。每次消解时需设置2 个空白样,以确保消解过程中无污染。暴露溶液中Cd、As的浓度由电感耦合等离子体发射光谱仪(ICP-OES,Optima 5300DV,PE)测定,实测的Cd、As 浓度用于进行本研究中所有数据处理和模型拟合。
1.5 毒物动力学-毒效动力学模型
1.5.1 毒物动力学模型
假设化学物质(Cd、As)的浓度在暴露过程中保持稳定,可利用一室模型(One-compartment model)通过吸收速率常数(Ku,mg·kg-1·d-1)和排出速率常数(Ke,d-1)描述Cd、As在生物体中的动态积累过程:
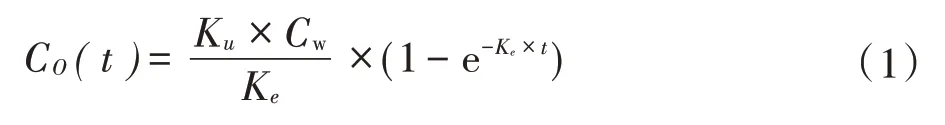
式中:C0(t)是在不同暴露时间下生物体内Cd、As 的浓度,mg·kg-1;Cw是Cd、As 的体外暴露浓度,mmol·L-1。通过公式(1)拟合Cd、As 不同暴露浓度、暴露时间下在生物体内的浓度数据,可以分别得出其吸收速率常数(Ku,mg·kg-1·d-1)和排出速率常数(Ke,d-1)。
1.5.2 毒效动力学模型
不同暴露时间下,线蚓在不同暴露浓度溶液中的存活率可采用log-logistic模型来进行描述:
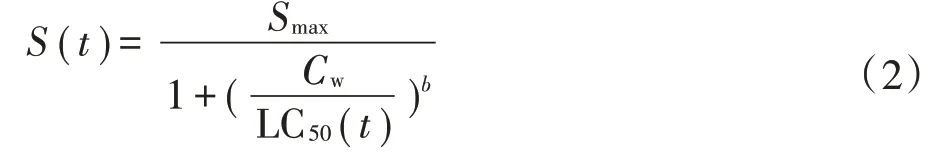
式中:S(t)是在不同暴露时间下线蚓的存活量;Cw是Cd、As溶液实测暴露浓度(mmol·L-1)或Cd、As的体内浓度(mg·kg-1);Smax是在暴露浓度下的最大存活数;LC50(t)是不同暴露时间下线蚓的半数致死浓度,mmol·L-1;b是斜率参数。
LC50与暴露时间之间的关系可以用时间-毒性响应方程表示:

式中:LC50∞是指最终LC50值,mmol·L-1;Kd是根据毒性数据得出的毒效动力学过程的损伤速率常数,d-1。
1.6 数据处理与分析
本研究中的模型拟合采用软件JMP 16.0(SAS Institute)中的求解功能。例如,Cd、As 的吸收和排出速率常数(Ku和Ke),需要利用最小二乘法,通过最小化体内浓度模型预测值和实测值的残差平方和拟合一室方程得到。
2 结果与分析
2.1 基于一室模型定量描述Cd、As动态累积过程
不同Cd、As暴露浓度下,线蚓体内浓度与暴露时间的关系如图1 所示。总体上,生物体内Cd、As 的累积浓度与暴露浓度和暴露时间呈显著正相关性。Cd在线蚓体内的浓度随时间变化不断升高,而As 暴露下(除最高浓度1.593 mmol·L-1)其体内浓度在暴露4 d 后基本达到平衡状态。Cd 在线蚓体内的累积浓度显著高于As,Cd、As体内浓度的最大值分别出现在暴露后的第10 d和第4 d,分别为459.6、32.91 mg·kg-1。
当使用一室模型[公式(1)]拟合不同暴露浓度下线蚓体内的Cd、As含量随时间变化的关系时,可以得到如表1 所示的不同暴露浓度下Cd、As 在线蚓体内的吸收速率常数Ku和排出速率常数Ke。Cd、As 的Ku值均随着浓度的增加而呈现降低趋势,Cd、As的Ku最小值分别出现在暴露浓度为0.338、1.126 mmol·L-1时,分别为1.648、0.063 mg·kg-1·d-1。而Cd、As的排出速率常数Ke值随暴露浓度的变化无明显规律。将所有Cd、As 暴露浓度下线蚓的体内浓度数据一同拟合时,得到Cd、As总吸收速率Ku和总排出速率Ke分别为1.761、0.102 mg·kg-1·d-1和0.015、0.287 d-1。
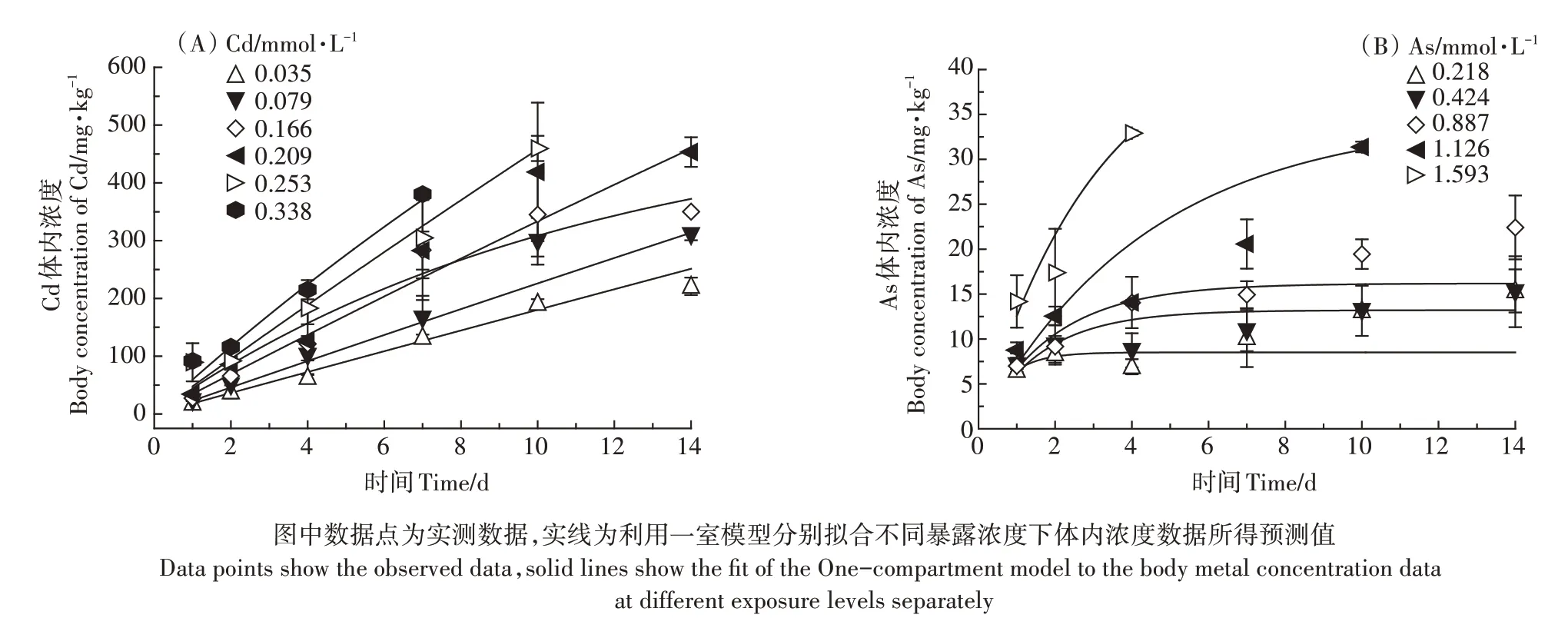
图1 不同暴露浓度下线蚓体内Cd和As含量随暴露时间的变化Figure 1 Relationship between body concentration and exposure time in Enchytraeus crypticus exposed todifferent concentrations of Cd and As
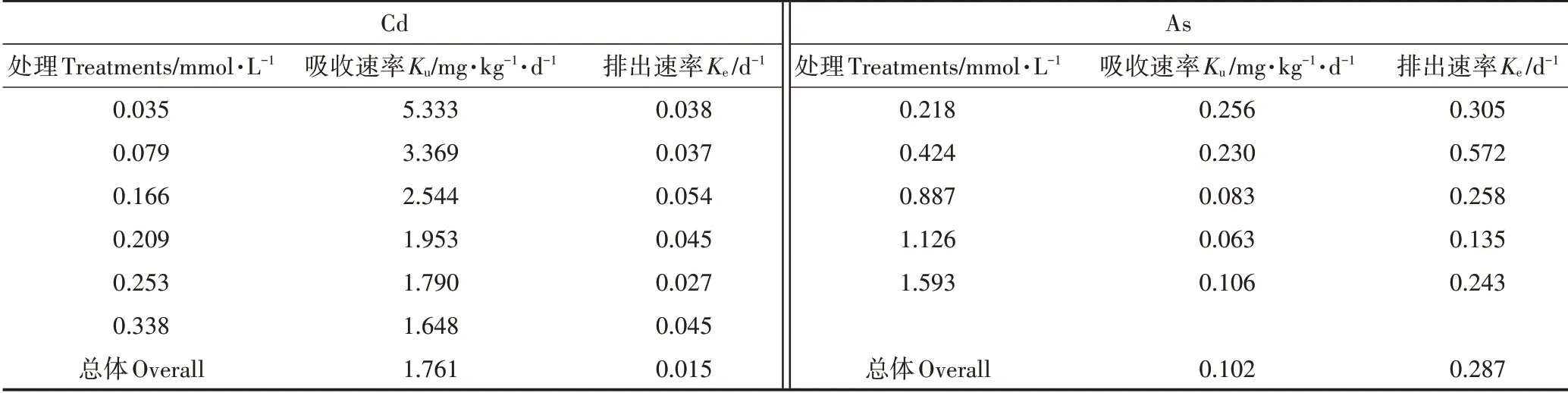
表1 基于一室模型拟合得到的Cd、As吸收-释放动力学参数Table 1 Estimated uptake,elimination parameters of Cd and As by fitting dynamic body concentration to One-compartment model
2.2 基于时间-毒性响应方程描述Cd、As 的动态毒性效应
不同Cd、As 暴露浓度下线蚓的存活率随着时间的变化趋势如图2 所示。在14 d 的暴露时间内,对照组中均未发现生物死亡,随着Cd、As暴露浓度和暴露时间的增加,线蚓的存活率不断降低。基于体外暴露浓度,利用log-logistic 模型得到不同暴露时间下Cd、As 对线蚓的半数致死浓度LC50(表2)。随着暴露时间的增加,Cd、As 的LC50值分别从0.537 mmol·L-1下降到0.208 mmol·L-1、从1.856 mmol·L-1下降到1.128 mmol·L-1,均在暴露7 d 后基本达到稳定状态(图3)。通过比较相同暴露时间下Cd、As的LC50值,可以看出Cd 的毒性强度是As 的3~5 倍。利用时间-毒性响应方程对不同暴露时间下Cd、As的LC50值进行拟合,得到最终半致死浓度LC50∞和损伤速率常数Kd值,Cd、As 的LC50∞值分别为0.314、1.253 mmol·L-1,Kd值分别为0.738、1.077 d-1(表2)。
2.3 基于Cd、As体内吸收预测动态毒性效应
不同暴露浓度和暴露时间下Cd、As 在线蚓中的体内浓度与其相应存活率的相关性如图4 所示。整体上可以看出,Cd、As的毒性效应随其体内浓度的增加而不断加强,相较于Cd,As的体内浓度与毒性效应(存活率)具有更好的相关性(R2=0.75)。利用公式(2)拟合不同Cd、As 体内浓度和毒性数据,得到基于体内浓度的半数致死浓度LC50inter值(表3),Cd、As 的总LC50inter值分别为468.8、26.65 mg·kg-1,说明线蚓体内As 的毒性强于Cd。当分别拟合不同时间点体内浓度与毒性数据时,发现Cd 的LC50inter值随着暴露时间的增加而上升,而As 的LC50inter值随着时间基本保持不变。
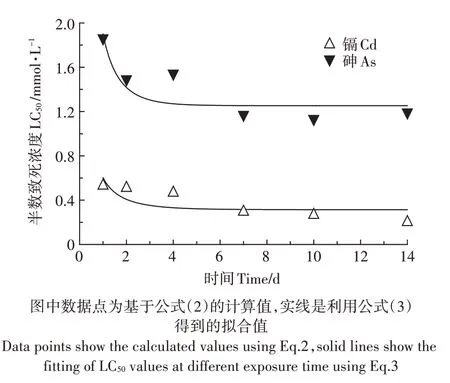
图3 基于体外暴露浓度获得的Cd、As半数致死浓度随暴露时间的变化Figure 3 Toxic effects(LC50)of Cd and As on Enchytraeuscrypticus with exposure time
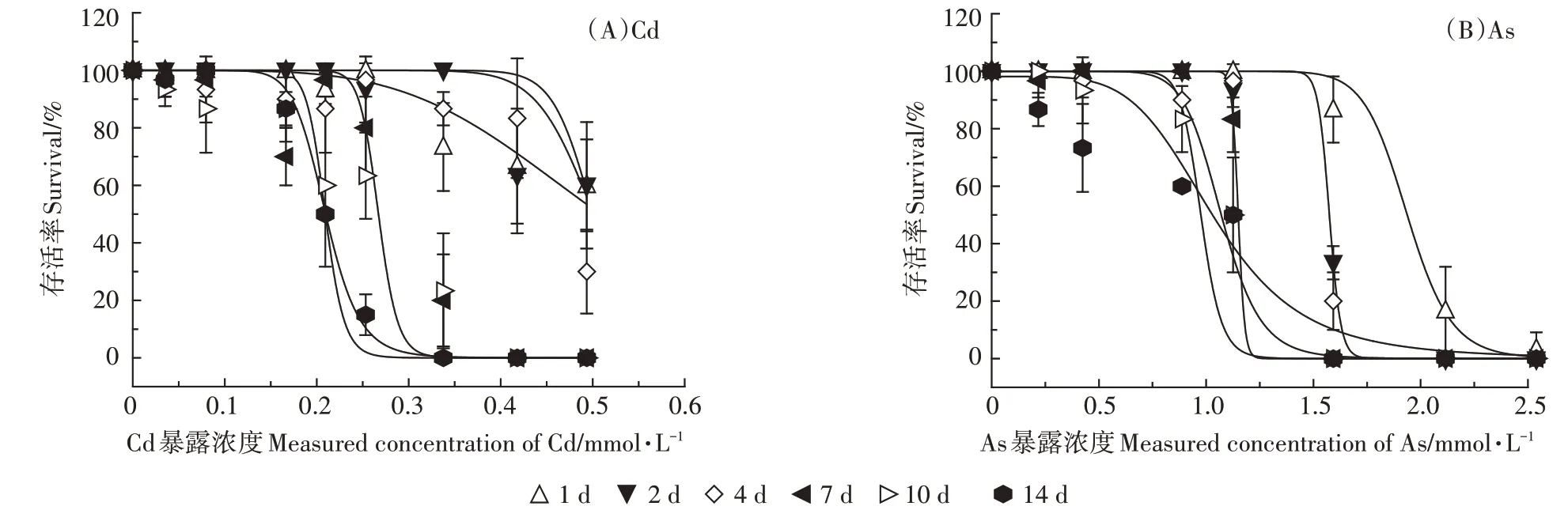
图2 不同暴露时间下线蚓存活率与Cd、As暴露浓度之间的剂量-响应关系Figure 2 Dose-response relationship between Enchytraeus crypticus survival fraction of organisms and exposure concentration of Cd and As under different exposure times

表2 基于体外暴露浓度利用log-logistics方程拟合得到的不同暴露时间下Cd、As半数致死浓度及基于时间-毒性响应方程拟合得到的动态毒性参数Table 2 LC50 values of Cd and As to Enchytraeus crypticus calculated using a log-logistics model and the estimated parametersby fitting LC50 values under different exposure
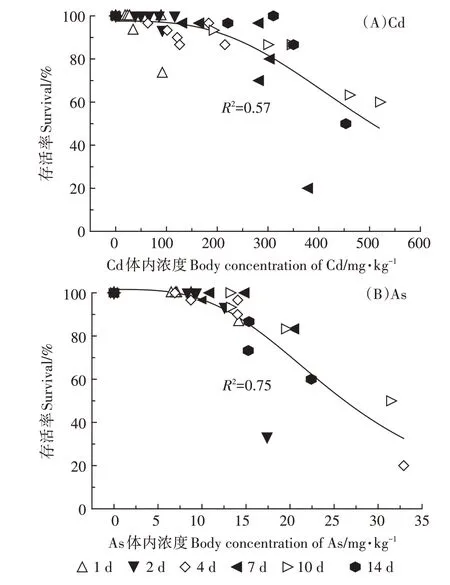
图4 不同暴露浓度和暴露时间下Cd、As的体内浓度与存活率的相关性Figure 4 Correlation between survival fraction and the body concentrations of Cd and As under different exposure concentrations and exposure time
3 讨论
3.1 重金属Cd和As在线蚓体内动态累积过程的差异性
已有研究表明,重金属在生物体内的累积具有浓度依赖性,同时暴露时间也是影响生物体内浓度的重要因素,重金属的生物累积与剂量和时间呈正相关关系[23-25]。研究发现跳虫和线蚓体内的Cd、Zn 含量会随暴露时间增加而不断升高,并最终达到平衡状态[26-27]。本研究发现重金属Cd 和类金属As 在线蚓体内的累积过程也呈现同样的趋势,这表明金属在生物体中的累积是一个动态过程。本研究利用一室模型来描述金属在线蚓体内的吸收和排出过程,模型很好地拟合了Cd、As的动态累积数据,表明吸收和排出速率常数可以用来描述环境中不同暴露水平下Cd、As的毒物动力学过程。在本研究中,Cd 的总吸收速率Ku大于As,而排出速率Ke小于As,Cd 在线蚓体内的累积量远大于As,表明Cd相较于As更容易在生物体内富集。Sheppard 等[28]指出Cd 排出速率低的原因可能是金属Cd 易与生物体内金属硫蛋白的结合,导致生物体内Cd 的浓度随着时间变化呈明显增加趋势。同样,研究发现[29]Cd、As 在枇杷中的累积情况与本研究结果类似,Cd 的生物体内浓度远大于As 的浓度。而吴庆其[30]研究发现在金针菇培养料中添加Cd(0.1~20 mg·kg-1)和As(0.1~15 mg·kg-1)后,子实体的Cd、As 累积浓度相差不大,这表明不同金属在不同生物体中累积能力具有差异性。
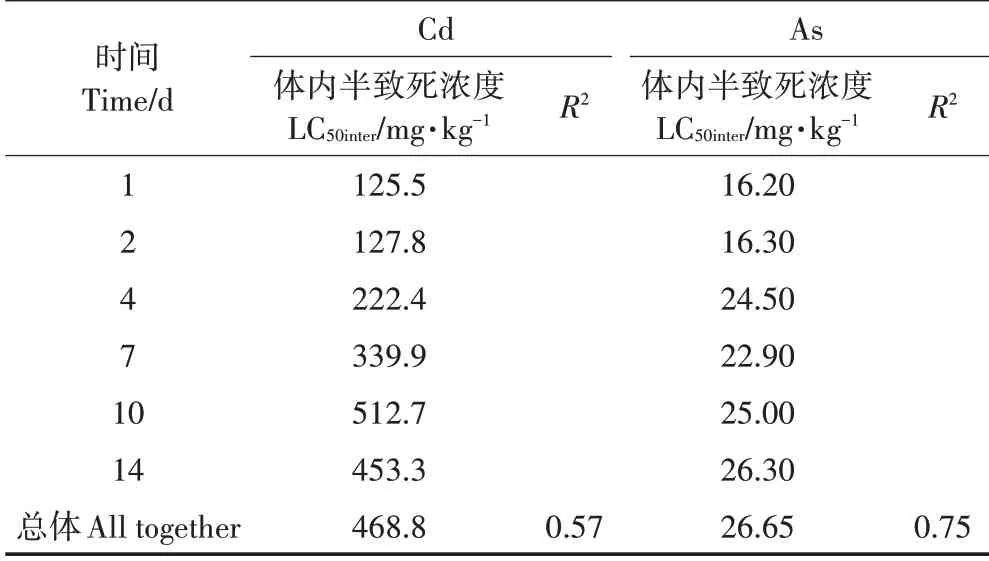
表3 基于体内浓度利用log-logistics方程拟合得到的不同暴露时间下Cd、As对线蚓的半数致死浓度(LC50inter)Table 3 LC50 values of Cd and As to Enchytraeus crypticus related to body Cd and As concentrations at different exposure timesseparately and all data together
通过一室模型拟合结果发现Cd、As 的吸收速率Ku值随着浓度增加呈下降趋势,先前的研究[31]也有相似发现,将蚯蚓暴露于含Cd 10 mg·kg-1和100 mg·kg-1的土壤中时,Cd 的吸收速率常数从0.214 mg·kg-1·d-1降至0.104 mg·kg-1·d-1。Zhang 等[11]和He 等[12]分别研究了Ni 和Pb 在线蚓体内的毒物动力学,发现吸收速率常数在达到峰值后会随暴露浓度升高而降低。暴露浓度升高导致吸收速率下降一方面可能是受到负责转运金属离子的载体的限制,另一方面在金属高暴露浓度下细胞死亡率增加,进而导致生物对毒物的吸收能力降低[32]。与吸收速率常数Ku相比,排出速率常数Ke在很大程度上取决于受试生物本身,较少受到暴露浓度的影响[33]。
3.2 重金属Cd和As对线蚓的动态毒性影响区别
重金属的暴露会显著降低生物的存活率[34],而且金属的毒性会随着暴露时间的增加而增强,然后达到稳态[10]。本研究结果同样显示随着暴露时间的增加,Cd、As的毒性不断增强并在7 d后达到平衡。前人研究发现暴露在Pb 中的赤子爱胜蚓的LC50值随时间增加而降低,最后在21 d 趋于平衡[35]。王顺昌等[36]将秀丽线虫暴露在5 mmol·L-1的砷酸钠中,发现随着暴露时间的增加,线虫的细胞凋亡数目明显大于对照组,表明As 的毒性效应随着时间增加而明显增强。因此,在对Cd、As的生物毒性研究中应该充分考虑时间因素的影响。
本研究发现Cd、As 的损害速率Kd值均大于0,最终半致死浓度LC50∞Cd小于LC50∞As,表明Cd和As均对线蚓产生毒性且Cd 的毒性作用强As。Vellinger 等[37]将淡水鱼分别暴露在Cd、As 中240 h 后,发现以存活率为终点的LC50As远大于LC50Cd,与本研究结果一致。Cd、As 毒性作用的差异可能是由于二者进入细胞的方式和毒性作用机理不同,Reid 等[38]研究发现Cd 会干扰细胞内Ca的运输和代谢,Cd2+在细胞基底膜水平通过Ca2+-ATPase 或Na+/Ca2+交换的方式进行转运[39-41],由于Cd2+和Ca2+的离子形式相似,所以它们可以竞争同一种类型的配体,因此Cd 的二价离子形态具有更高的生物利用度及毒性[42]。As 则通过磷酸盐转运系统[43]进入细胞,砷酸盐可能会干扰电子传输链或葡萄糖代谢中的磷酸化反应[44-47],进而阻碍葡萄糖的代谢及能量的产生[48]。
3.3 Cd和As在线蚓体内的累积和毒性的关系
先前的研究表明,体内浓度由于已经考虑了暴露介质及暴露时间对毒物动力学过程的影响,因此相较于体外暴露浓度可以更好地作为动态毒性的指示指标[12,49]。本研究发现基于体内浓度计算得到As 的LC50inter值随着时间变化整体保持不变,这与之前的研究结果类似[27]。而Cd 的LC50inter值随着暴露时间的增加不断变化,而且基于体内浓度表达毒性效应时Cd的毒性强度小于As,这与基于体外浓度得到的毒性作用结果不同。这可能是由于金属Cd进入生物体后会诱导金属硫蛋白MT 的产生,而MT 是生物体内重要的解毒物质[50],Wallace 等[51]研究表明,将草虾饮食中的Cd 暴露量增加5 倍会导致总Cd 组织浓度增加18 倍,但由于MT 的诱导,其细胞溶质中Cd 的储存量增加了32 倍。MT 的增加导致更多的Cd 与其结合,进而不断减弱生物体内Cd 的毒性作用,这也进一步表明Cd 的体内浓度并不能完全代表其生物有效浓度以指示其毒性生物。赵俊杰[52]研究也指出,在Cd暴露下蚯蚓体内MT 含量随着暴露时间而升高,产生的MT 会不断与Cd 结合,因此会降低Cd 对生物体的毒性。积累在生物体内的金属会被生物体通过代谢排出,或分布在不同组织中,从而抑制其与毒性作用位点的结合,这些生物体内部的解毒机制影响了金属在生物体内累积浓度与其毒性效应的相关性,进而影响体内浓度对金属毒性效应的有效预测[53]。
累积在生物体内的部分金属通过与毒性作用位点的结合从而对生物产生毒性。金属会诱导动物机体产生过氧化氢和自由基等活性氧物质,导致脂质过氧化产物累积,从而破坏细胞膜,造成DNA 损伤并干扰抗氧化防御系统[52,54]。研究发现,鱼类受到重金属Cd 胁迫时,体内会产生大量活性氧(ROS),如超氧阴离子(O-2)、羟自由基(·OH)和H2O2等[55]。如果这些ROS 不能被及时有效地清除,将造成氧化损伤,进而导致鱼体内组织和器官的损伤。杨瑞瑛等[56]研究发现累积在大鼠体内的As 主要分布在细胞的微粒体中,这些As会与巯基酶结合使酶失活,干扰细胞的生物功能、结构和正常代谢,其中分布在细胞核中的As会引起DNA 的氧化损伤并抑制抗氧化酶的产生,使得细胞中的过氧化氢(H2O2)蓄积,进而对大鼠产生毒性影响。
目前针对环境污染物的研究主要集中在单一金属的毒物-毒效动力学过程的描述,在实际环境中金属大多以混合物形式存在,而有关混合物存在下污染物的累积和毒性作用的动力学过程研究较少,应当充分考虑Cd、As交互作用对其在线蚓体内动态吸收、释放及毒性作用的影响。此外,现阶段的研究手段主要采用室内模拟试验,研究对象也主要针对单一的生物物种,不能全面反映Cd、As在实际土壤中的生态毒性效应,因此有必要采用微宇宙生态系统方法原位研究金属毒性影响,并从整个土壤生物群落出发研究污染物对群落结构和多样性等的影响,从而更全面地评估污染物的生态毒性作用。此外,当前绝大多数的毒理学研究仍是基于生物体在个体水平上对污染物的毒性响应,而对其分子水平的毒性研究仍较为欠缺,为了进一步揭示Cd、As对生物的毒性效应机制,可以利用蛋白组学、代谢组学等多组学联合手段阐释Cd、As对生物体分子水平的毒性作用。
4 结论
(1)整体上,Cd 和As 在线蚓体内的含量受暴露浓度和暴露时间的影响,Cd的吸收速率大于As,而排出速率小于As,因此Cd更容易在线蚓体内累积。
(2)当基于外部暴露浓度表达毒性效应时,Cd、As 的毒性效应(LC50)随暴露时间的增加而不断增强并最终趋于稳定,Cd对线蚓的毒性效应大于As。
(3)当基于体内浓度表达毒性效应(LC50inter)时,As 的LC50inter值基本不受暴露时间的影响,而Cd 的LC50inter值随暴露时间的增加持续升高,Cd对线蚓的毒性效应小于As;相较于Cd,As 的体内浓度能更好地预测其对线蚓的动态毒性效应,说明体内累积的Cd不能代表其生物有效浓度以指示其毒性效应。
