大豆γ-生育酚的混合遗传分析与QTL定位
2020-07-31梁慧珍许兰杰董薇余永亮杨红旗谭政委李磊刘新梅
梁慧珍,许兰杰,董薇,余永亮,杨红旗,谭政委,李磊,刘新梅
大豆γ-生育酚的混合遗传分析与QTL定位
梁慧珍1,2,许兰杰1,董薇1,余永亮1,杨红旗1,谭政委1,李磊1,刘新梅1
(1河南省农业科学院芝麻研究中心,郑州 450002;2河南省农业科学院西峡分院,河南西峡 474550)
【】通过对大豆γ-生育酚进行混合遗传和QTL定位分析,了解其遗传机制,定位其主效QTL,为高γ-生育酚含量大豆品种的选育奠定基础。以栽培大豆晋豆23为母本,以山西农家品种大豆灰布支黑豆为父本杂交衍生的重组自交系作为供试群体构建遗传图谱。图谱全长2 047.6 cM,平均图距8.8 cM,包括227个SSR标记,232个标记位点。重组自交系试验群体及亲本材料分别于2011年、2012年和2015年夏季在河南省农业科学院原阳试验基地种植,冬季在海南省三亚南繁试验基地种植。田间试验采取随机区组设计,2次重复。从6个环境中每个家系选取15.00 g籽粒饱满,大小一致的大豆种子,利用高效液相色谱法定性、定量测定样品中的γ-生育酚含量。采用主基因+多基因混合遗传分离分析法,对大豆γ-生育酚含量进行混合遗传分析;采用WinQTLCart 2.5复合区间作图法,对大豆γ-生育酚含量进行QTL定位分析。主基因+多基因混合遗传分析表明,γ-生育酚受2对重叠作用主基因×加性多基因控制。遗传基因分布在双亲中。三亚试验数据检测出2对主基因间上位性效应值为0.4010—0.5169和多基因的加性效应值为0.1797—0.2146,主基因遗传率为11.27%—13.05%,多基因遗传率为82.51%—86.55%,多基因效应大于主基因效应。原阳试验数据检测到2对主基因间上位性效应值为0.9646—1.8455,主基因遗传率为39.51%—58.96%,没有检测出多基因效应。采用WinQTLCart 2.5复合区间作图(CIM)共检测到9个影响γ-生育酚的QTL,分布于A1(Chr.5)、A2(Chr.8)、C1(Chr.4)、K(Chr.9)、M(Chr.7)和G(Chr.8)6条染色体中,单个QTL的贡献率为7.29%—29.55%。同时在2011年原阳、2012年三亚、2015年三亚3个环境下检测到,且均定位在G(Chr.18)染色体Satt275—Satt038标记区间0.01 cM处,解释的表型变异分别为8.97%、8.12%和7.91%。同时在2011年原阳和2015年原阳2个环境下检测到,且均定位在A1(Chr.5)染色体Satt276—Satt364标记区间0.01 cM处,解释的表型变异分别为29.54%和28.23%。和2个QTL能够稳定遗传。γ-T最适遗传模型符合MX2-Duplicate-A,即2对重叠作用主基因×加性多基因模型。其遗传同时受到基因型、环境和上位性的影响。检测到γ-T的2个稳定主效QTL,Satt275—Satt038和Satt276—Satt364是共位标记区间。
大豆;γ-生育酚;遗传;主基因+多基因;基因定位;上位性
0 引言
【研究意义】维生素E(vitamin E,VE)是脂溶性维生素,参与生物体内信号转导、基因表达调控、抗低温胁迫等多种代谢途径,具有抗氧化、抗衰老、抗不育、预防早老性痴呆症和老年痴呆症、防癌、提高机体免疫力等生理活性功能[1-3]。维生素E分为两类:天然VE和合成VE。天然维生素E包括α-、β-、γ-和δ-4种生育酚以及α-、β-、γ-、δ-4种剩余三烯酚。合成维生素E是生育酚的醋酸酯,严格意义说并不算是真正的生育酚,生物活性与天然VE相差甚远。同时,由于合成品中含有杂质成分,也可能存在潜在的危害,使得人们更加倾向于使用天然VE[4]。目前,人类获得的VE,20%来源于天然VE,80%来源于合成VE,并且全球合成VE供应商主要集中在新和成(NHU)、帝斯曼(DSM)、巴斯夫(BASF)和浙江医药公司,市场对天然VE的需求日趋增大[5]。γ-生育酚(γ-Tocopherol,γ-T)是生育酚同族体,其基本结构为色原醇环与一个含有16个碳的侧链。γ-T主要存在于大豆种子中,在大豆种子VE总含量中占比高达66%,人体通过油脂摄入γ-生育酌的量较多[6]。γ-T是大豆油中的一种天然抗氧化剂,可用来保持油脂的风味、延长油脂的储藏时间以及保证种子长期储藏后的活力[7]。γ-T具有抗癌、防癌功效,其作用主要通过上调抑癌或下调促癌相关基因表达、干预细胞癌变相关信号传导通路、抑制肿瘤细胞增殖、促进肿瘤细胞凋亡等方式实现[8]。【前人研究进展】目前,γ-T的抗癌和防癌研究主要集中在γ-T的吸收和代谢[9-10]、γ-T抗癌作用及其分子机制[11-13]等方面;γ-T QTL定位研究主要集中在玉米[14]、向日葵[15]、油菜[16]、芥菜[17]和大麦[18],大豆γ-T的分子遗传和QTL定位较少。Li等[19-20]利用Bayfield × Hefeng 25大豆RIL群体检测到8个控制γ-T的QTL,分别定位在第2、4、6、8、10、15、16和18染色体上。Shaw等[21]利用Bayfield×Shire重组自交系群体(RIL),检测到8个控制γ-T的QTL,分别定位在第1、4、9、13、14、15、17和20染色体上。李海燕[22]利用Bayfield×合丰25大豆BIEX群体,检测到5个控制γ-T的QTL,分别定位在第2、7、18和19染色体上。张红梅等[23]利用Essex×ZDD2315大豆RIL群体分别检测到2个和2对控制大豆γ-T的加性和上位性互作QTL。【本研究切入点】国内外已检测到的大豆γ-T QTL数量较少,能够稳定表现的QTL更少,采取分子标记辅助选择进行高γ-T含量大豆新品种选育比较困难。【拟解决的关键问题】本研究以晋豆23×灰布支黑豆衍生的RIL为试验材料,采用主基因+多基因混合遗传分离分析方法[24],分析γ-T混合遗传规律;利用WinQTLCart2.5[25]复合区间模型分析方法,对大豆γ-T进行QTL分析,为高γ-T大豆品种选育提供参考依据。
1 材料与方法
1.1 试验材料
供试材料为山西省农业科学院经济作物研究所配制的晋豆23×灰布支黑豆杂交组合。该组合包含233个家系的重组自交系(RIL)群体,即每一F2单株衍生成F2家系,每一F2家系再选株建成家系,至2011年是F14代。
1.2 试验方法
2011年6月11日、2012年6月15日和2015年6月12日在河南省农业科学院现代农业科技试验基地(原阳)、2011年11月18日、2012年11月20日和2015年11月12日在海南省三亚南繁基地种植233个家系的RIL群体F14、F15和F16代材料及其亲本,每种材料均种植30粒种子。每个田间试验采取随机区组设计,2次重复,行长和行距分别为4.0和0.4 m,常规田间管理。四周分设保护行,一播全苗。2011年10月8日、2012年10月12日和2015年10月10日在河南省农业科学院现代农业科技试验基地(原阳)收获,2012年02月20日、2013年02月25日和2016年02月15日在海南省三亚南繁基地收获。收获后,6个环境下随机区组设计2次重复的种子,从每个家系选取15.00 g大豆籽粒,要求籽粒饱满,大小一致,用旋风磨(Retsch ZM100, Φ = 1.0 mm, Rheinische, Germany)磨粉。取2.5 g豆粉样品,加入30 mL CH3CH2OH混合均匀,再加入10 mL KOH溶液和5 mL浓度10%维生素C溶液,用恒温水浴皂化30 min后提取皂化液,采用100 mL C6H14分3次进行,弃去水层;最后,用Na2SO4过滤提取液,旋转蒸发瓶蒸发后用氮气吹干残留液,再用2.5 mL CH3OH溶液进行溶解,通过0.45 μm滤膜,4℃备用。利用高效液相色谱技术(high performance liquid chromatography,HPLC),采用外标法对γ-T进行定量分析。色谱柱:DIKMA;柱规格:250.0 mm×4.6 mm;柱填料:symmetry;柱温:40℃;钻石:C18,5 μm;荧光检测器激发波长:290 nm;发射波长:330 nm;流动相:CH3OH;流速:1.5 mL·min-1。进样量:20 μL;检测时间:10 min。将γ-T峰面积代入回归方程进行定量分析,计算出γ-T含量。γ-T计量单位:μg·g-1。
1.3 数据分析
利用SPSS 19.0软件对γ-T进行描述统计和联合方差分析。遗传变异系数(genetic coefficient of variation,GCV)(100%)=g/×100。其中,g为遗传标准差,为群体平均数。遗传率2=g2/[g2+(ge2/)+(2/)],其中,g2为遗传方差;ge2为基因型×环境方差,为年份数,2为误差方差,为重复数。
采用主基因+多基因混合遗传分离分析法[24]对晋豆23×灰布支黑豆及其衍生的RIL群体γ-T含量进行混合遗传分析。主基因遗传率mg2(%) =mg2/p2,多基因遗传率pg2(%) =pg2/p2,环境遗传率e2(%) =e2/p2。各遗传方差间的关系为p2=mg2+pg2+e2。其中,p2为群体表型方差;mg2为主基因遗传方差;pg2为多基因遗传方差;e2为多环境遗传方差。
1.4 遗传连锁图谱的构建与QTL分析
王珍[26]使用晋豆23×灰布支黑豆杂交衍生的RIL群体为材料,构建了一个含有227个SSR标记的大豆遗传连锁图谱。以该图谱和大豆公共图谱中的标记为基础,梁慧珍[27]重新整合,整合后图谱全长2 047.6 cM,包括27个连锁群,平均图距8.8 cM,232个标记位点。该图谱在K(Chr.9)、F(Chr.13)和J(Chr.16)3条染色体上均出现2个间隙,在H(Chr.12)染色体出现了1个间隙,因而形成了27个连锁群。所得图谱与Song等[28]整合的图谱排序相对一致。
采用梁慧珍[27]整合后的大豆分子遗传图谱对大豆γ-T含量进行QTL定位分析。把不同年份作为环境因子处理,根据6个环境的表型数据,利用WinQTLCart 2.5软件中复合区间作图法(composite interval mapping,CIM)Zmapqtl方法的Model 6,在每个被测标记区间两侧设置10 cM的窗口(Window),同时设置该窗口之外的5个标记作为余因子,步移速度为2 cM,向前回归法。以1 000次排列测验(permutation test)、全基因组=0.05的LOD值作为QTL存在的阈值。当QTL效应≤0.05时,认为QTL存在。参照McCouch等[29]方式命名QTL。
2 结果
2.1 大豆γ-T含量的表型分析和相关分析
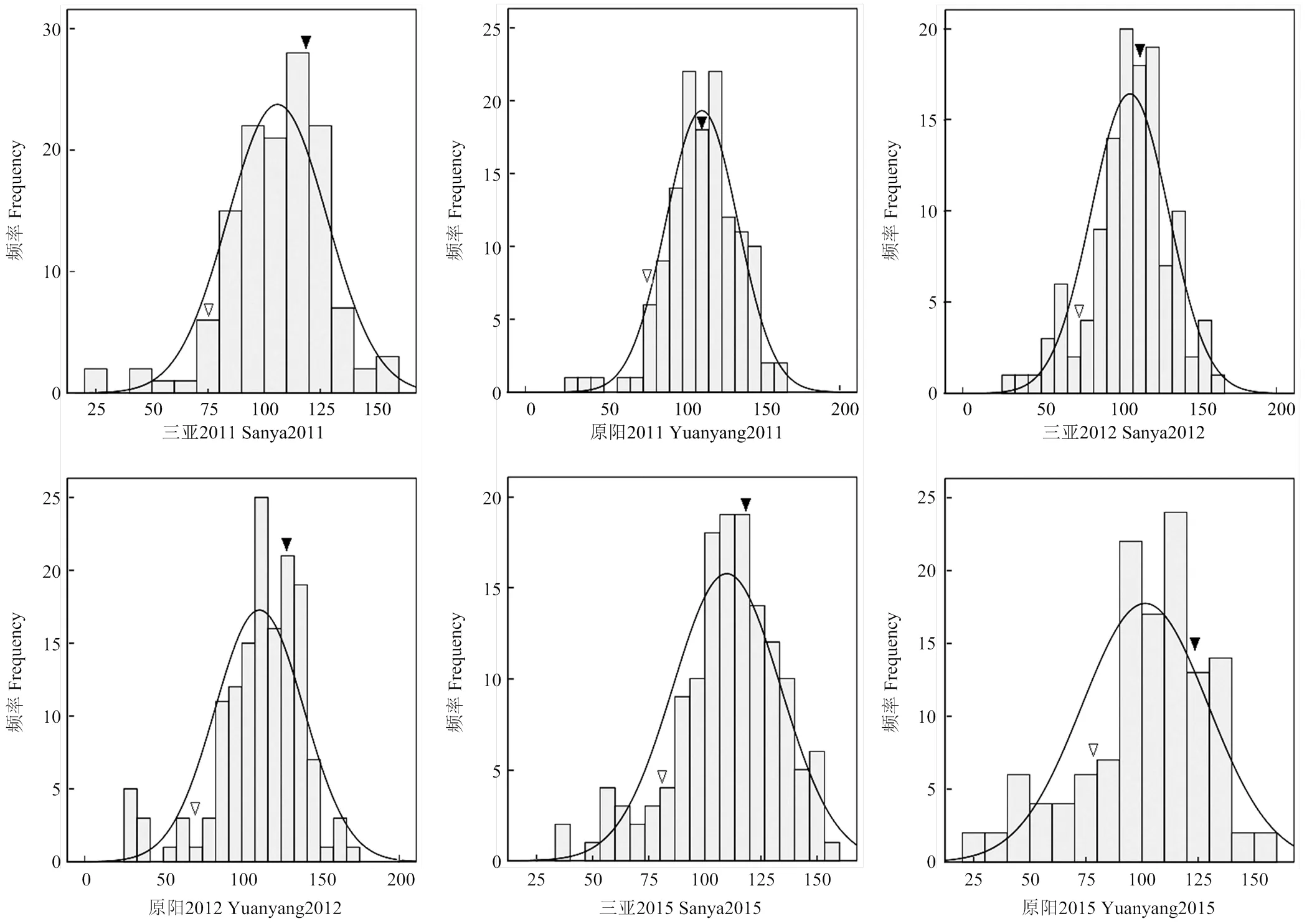
RIL群体中γ-T含量的表型变异见图1和表1。6个环境中γ-T亲本差分别为-51.12和-48.77、-49.90和-51.23、-41.10和-44.26,平均差分别为-48.43和-48.09。不同环境中,亲本在后代分离群体中差异较大,RIL群体差异显著,表现出超亲分离。γ-T呈现连续分布特点,不同环境下遗传变异系数差别较小。3年间的遗传率分别为0.509、0.437和0.498,平均遗传率0.488。联合方差分析结果(表2)表明,γ-T含量在组分间差异显著,基因型和基因型×环境的互作方差显著,表明γ-T的遗传主要受基因型和基因型与环境互作的共同影响。
相关性分析表明(表3),γ-T含量在2011年原阳和2011年三亚2个环境表现出显著相关,2012年原阳和2012年三亚2个环境表现出极显著相关,其他环境中均没有表现出显著相关性。说明γ-T含量受到基因型和环境的共同影响。相关性分析结果与γ-T含量在RIL群体中的分离及遗传分析结果基本一致。
2.2 γ-生育酚的主基因+多基因混合遗传分析
通过对2011年、2012年和2015年原阳和三亚共6个环境下试验数据的平均值进行主基因+多基因混合遗传分析,依据AIC值,结合均匀检验性检验、Kolmogorov试验和Smirnov检验选定最适遗传模型,并用最小二乘法估计γ-生育酚含量的遗传参数(表4)。γ-T最适遗传模型符合MX2-Duplicate-A,即2对重叠作用主基因×加性多基因模型。因为2对主基因间的重叠作用,三亚地点检测到2对主基因间上位性效应值0.4010—0.5169和多基因的加性效应值为0.1797—0.2146,主基因遗传率为11.27%—13.05%,多基因遗传率为82.51%—86.55%,说明γ-T存在多基因效应,且多基因效应大于主基因效应。但是原阳地点只检测到2对主基因间上位性效应0.9646—1.8455,主基因遗传率为39.51%—58.96%,没有检测出多基因效应。
:灰布支黑豆γ-T含量γ-T content of Huibuzhiheidou :晋豆23 γ-T含量γ-T content of Jindou23
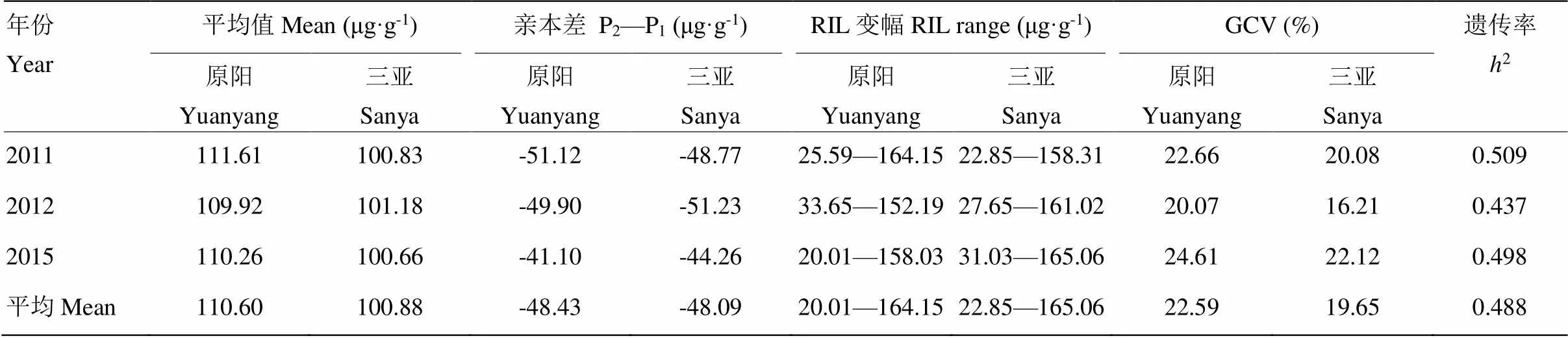
表1 RIL群体大豆γ-T含量表型变异
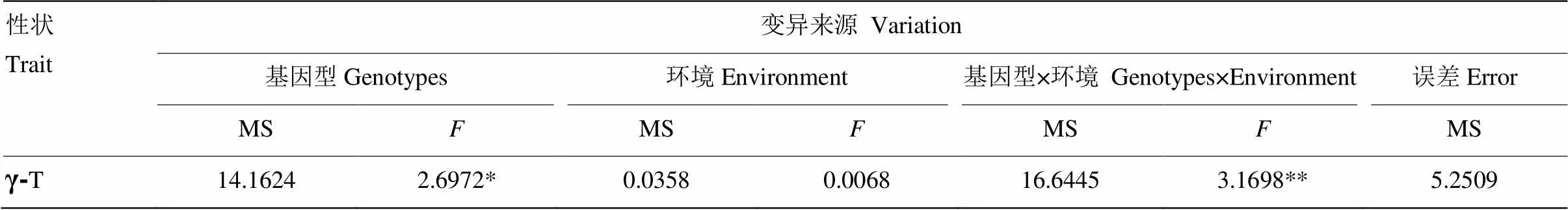
表2 大豆种子γ-T含量方差分析
*和**:分别表示在0.05和0.01水平差异显著。下同
*and **: significance at the 0.05 and 0.01 probability levels. The same as below

表3 大豆种子γ-T含量相关性分析
2.3 大豆γ-T的QTL定位
根据WinQTLCart 2.5的定位结果,共在6个连锁群上检测到9个γ-生育酚的QTL(表5和图2),分别位于A1(Chr.5)、A2(Chr.8)、C1(Chr.4)、G(Chr.18)、K_2(Chr.9)和M(Chr.7)染色体上,解释的表型变异范围为7.29%—29.55%。加性效应值正负表现不一,加性效应值为正,说明等位基因来自于母本晋豆23,该QTL对大豆γ-生育酚含量起正向作用;加性效应值为负,说明等位基因来自于父本灰布支黑豆,该QTL对大豆γ-生育酚含量起负向作用。位于A1(Chr.5)染色体Satt364—Satt382标记区间的,表型贡献率为29.55%,解释的表型变异最大。其中,同时在2011年原阳、2012年三亚、2015年三亚3个环境下检测到,且均定位在G(Chr.18)染色体Satt275—Satt038标记区间0.01 cM处,解释的表型变异分别为8.97%、8.12%和7.91%,说明这是一个能够稳定遗传的QTL。加性效应值-0.801—-0.535,增加γ-T含量的等位基因来自父本灰布支黑豆;同时在2011年原阳和2015年原阳2个环境下检测到,且均定位在A1(Chr.5)染色体Satt276—Satt364标记区间0.01 cM处,解释的表型变异分别为29.54%和28.23%,说明这可能是一个能够稳定遗传的QTL。加性效应值0.622和0.613,增加γ-T含量的等位基因来自母本晋豆23。同时,均被定位在A1(Chr.5)染色体上,加性效应分别为0.621和-0.212,且2个QTL位置相距较远,推测可能不是同一个QTL,说明D1a(Chr.1)染色体上可能存在多个与γ-T相关的基因。

表4 γ-生育酚最适模型及遗传参数估计结果

图2 检测到的QTL及加性效应QTL在连锁群上的分布
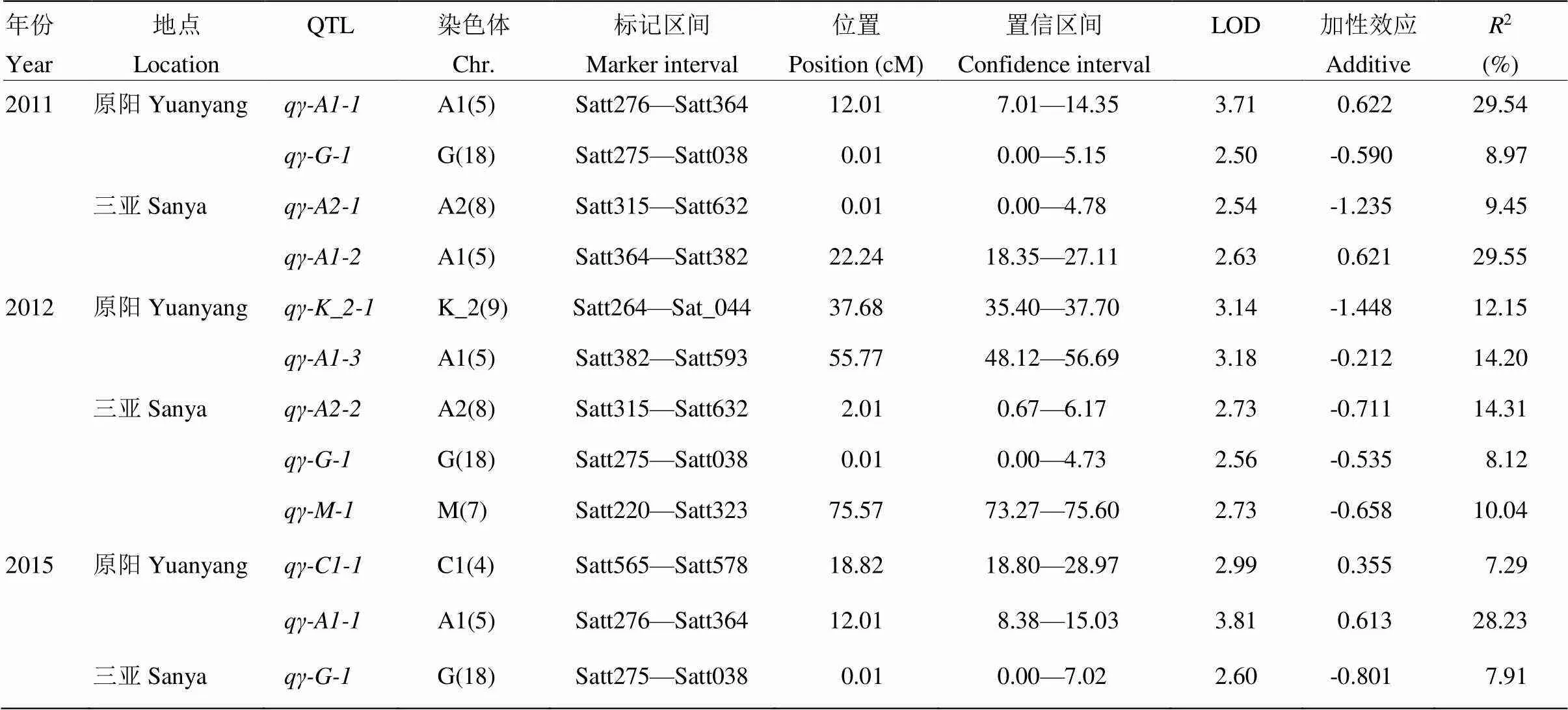
表5 γ-生育酚QTL位置及其参数
3 讨论
3.1 主基因+多基因混合遗传分析和QTL定位结果的比较
本研究采用主基因+多基因混合遗传模型分离分析方法研究大豆γ-T在河南省和海南省2个地点3个年份共6个环境中的遗传;采用WinQTLCart 2.5软件中CIM方法进行QTL定位分析。2种分析结果相比较,发现QTL定位数目与遗传模型预测的数目并不完全一致。其中,2011年原阳和三亚、2012年原阳和2015年原阳环境下检测出2个QTL,与γ-T最适遗传模型MX2-Duplicate-A相吻合;在2012年三亚和2015年三亚2个环境下分别检测出3个和1个QTL,与遗传模型预测的数目不统一。说明2种分析方法既具有科学的统一性,又具有各自的局限性。分析其研究结果不完全统一的可能原因有:1)与混合遗传模型有关。本研究选用的是4对主基因+多基因混合遗传模型[30],该模型简化了主基因间的连锁作用。只分析了主基因间无连锁的情况。同时,分析过程中成分分布数和待估参数比较多,分析过程受到限制,估算结果的准确性有待提高;2)与QTL定位图谱有关。与标准图谱相比较,本研究选用的图谱还需要进一步完善;3)控制γ-T含量的表达在时空上存在差异。因此,对于γ-T含量的遗传机理研究,在本研究的基础上尚需进一步深化。
3.2 大豆γ-T含量的QTL分析及与前人定位结果的比较
为提高QTL定位精度,得到表现稳定的QTL,采用多年多点数据分析方法是最有效的途径之一[31]。本研究采用的晋豆23×灰布支黑豆及其衍生的RIL群体γ-T定位的QTL中,在3个环境下均被检测到,且均位于G(Chr.18)染色体Satt275—Satt038标记区间0.01 cM处,加性效应分别为-0.590、-0.535和-0.801,增加γ-T含量的等位基因来自父本灰布支黑豆;在2个环境下均被检测到定位在A1(Chr.5)染色体Satt276—Satt364标记区间0.01 cM处,加性效应分别为0.622和0.613,增加γ-T含量的等位基因来自母本晋豆23。可见q和q可能是能够稳定表达的主效QTL,Satt275—Satt038和Satt276—Satt364 2个标记区间准确性较高。增加γ-T含量的2个QTL和的等位基因分别来自父本和母本,与最适遗传模型符合MX2-Duplicate-A的分析结果相一致。下一步研究将针对本次γ-T基因定位的结果,在Satt275—Satt038和Satt276—Satt364连锁标记之间的序列上,寻找新的SSR标记,分析其在亲本间的多态性,进一步寻找与目的基因连锁更为紧密的SSR标记,进而实现γ-T基因的精细定位,为高γ-生育酚含量分子标记辅助育种奠定基础。
生物的遗传和进化过程中,广泛存在多因一效和一因多效现象。这两种基因作用方式从不同角度共同促进生命活动的发现[32]。多因一效促成了生物多样性。不同的生物过程参与到同一种表型上,降低了单因素所带来的局限性,出现了多态性。一因多效将多种过程联系起来,共同参与基因表达过程,形成一系列生物轴,一方面促进行为的统一性,一方面形成正负反馈,避免生理生化过程的失稳。本研究发现,在6个连锁群上共检测到9个γ-T的QTL,加性效应值正负均有表现,这些等位基因一方面来自于母本晋豆23,一方面来自于父本灰布支黑豆,推测多因一效可能存在于γ-T的形成过程。同时也发现,本研究中稳定表达的标记Satt275,被认为与大豆孢囊线虫[33-34]和大豆染料木素形成[35]有关;Satt038与亚麻酸油合成[36]有关;Satt276与豆荚在灌浆期的相对磷浓度[37]和大豆结荚高度[38]有关;Satt364与产量、脂肪含量与根重有关[39];Satt382与侧根数有关[40]。说明控制这些性状的基因可能存在一因多效现象[41]。在大豆种子发育和营养生长不同时期,可以采取相应的措施调控γ-T的合成与积累。

表6 QTI定位结果比较
QTL与环境互作、QTL与QTL上位性互作是数量性状遗传的重要组成部分,是作物杂种优势的遗传基础[42]。本研究中,在原阳和三亚2个地点均检测到上位性效应,上位性效应值最大为0.5169,加性效应最大为0.2147,上位效应的影响比加性更显著,与Hagiwara等[43]和Zhang等[44]认为在分析QTL定位时,上位性与上位性互作效应更有效,上位性比加性QTL更重要结论相一致。
下一步研究的重点方向之一是对这些QTL间的上位性反映机制和基因位点之间的表达调控机制进行深入研究。
与以往研究相比,尽管各研究选用的群体、图谱和环境条件不同,仍有一部分γ-T定位结果相吻合(表6)。与Li等[19-20]结果相比较,均定位在C1(Chr.4)、A2(Chr.8)和G(Chr.18)染色体上,且均定位在C1(Chr.4)染色体Satt565标记处;与Shaw等[21]结果相比较,均定位在C1(Chr.4)和K(Chr.9)染色体上;与李海燕[22]结果相比较,均定位在M(Chr.7)、K(Chr.9)和G(Chr.18)染色体上;与张红梅等[23]结果相比较,均定位在K(Chr.9)染色体上。但是,本研究中检测出的相对稳定遗传的q主效QTL,前人研究中虽然在这条染色体上也检测出γ-生育酚QTL,但是不在同一标记区间,定位位置是否重叠尚不能确定。分析其原因可能受到定位群体、定位图谱、遗传背景或环境差异等诸多因素影响。随着研究手段和使用图谱的不断进步和完善,逐步验证这些标记区间是否重叠。除此之外,本研究中定位出的其他QTL,均未见公开报道。
3.3 遗传图谱对QTL定位的影响
遗传图谱的构建在基因定位、基因的图位克隆、遗传资料多样性研究,以及遗传标记辅助选择育种等方面都具有重要意义。遗传图谱应用价值的大小,依赖于标记数量的多少或图谱的饱和度、标记在图谱上定位的准确性以及标记在图谱上分布的均匀程度等。一个基本的连锁框架图要求标记间平均间距20 cM以下。对于主基因定位,其平均距离要求在10—20 cM或更小[45]。连锁群标记较少,图谱上标记的密度较低时,影响QTL的检出效率,效应值较小的QTL有可能检测不到,进而影响定位的准确性[46]。同时,从另一角度分析,标记密度降低后仍然能够被检测到的QTL应该是效应较大的主效QTL,对分子标记辅助选择和数量性状基因的图位克隆更具实际价值。但这并不能与提高LOD的阈值注重主效QTL的检测同日而语,因为前者将付出降低QTL在染色体上定位的准确性的代价。本研究图谱是由海南省热带农业资源开发利用研究所方宣钧研究员提供(论文中致谢部分有说明),图谱总长度为2 047.6 cM,平均图距为8.8 cM[27],综合看来图谱平均间距尚能满足定位要求。下一步工作中,希望能进一步提高图谱分子标记密度和图谱饱和度,不断提高定位结果的精准度。尽管如此,利用该图谱定位了一批大豆数量性状的QTL,在国内外期刊发表,研究结果仍然具有一定的理论和现实意义。
3.4 大豆γ-T遗传体系对育种的启示
通过对6个环境中大豆广义遗传力分析和γ-T方差分析研究,遗传力为43.68%—50.93%,基因型、基因型×环境均呈现出极显著差异,说明γ-T受遗传和环境因素的共同影响。主基因+多基因混合遗传模型分离分析表明,γ-T最适遗传模型符合MX2-Duplicate-A。说明在γ-T含量的遗传体系中,基因型、环境、上位性均起着重要作用,与张红梅等[23]研究结果γ-T含量的遗传主要受基因控制,环境影响程度较小的结论有所不同。WinQTLCart2.5软件QTL定位分析发现,2012年原阳、2013年原阳和三亚、2015年三亚4个环境中,每个环境下均定位出2个QTL,与主基因+多基因混合遗传模型预测的数目相吻合。但是,2012年三亚和2015年原阳分别检测出3个和1个QTL,与遗传模型MX2-Duplicate-A不一致。表明在γ-T含量的遗传中,一方面受基因型控制,表现出遗传的稳定性;一方面受环境和上位性的影响,表现出遗传的多样性和复杂性。几种不同的分析方法得出的γ-T含量的遗传结论基本一致,说明研究结果的准确性比较可靠。
社会的发展带动了生活品质的提高,人们对于天然维生素E的需要越来越大。天然维生素E主要存在于植物的种子,但含量很低,提取成本较高,从育种的角度选育高含量维生素E大豆品种迫在眉睫。在各种不同形式的维生素E中,γ-T最常见,α-T生物活性最高。前人研究认为,γ-T甲基转移酶(γ-Topherol methytransferase,γ-TMT/VET4)是α-T合成途径最后一步甲基化酶,在γ-T甲基转移酶的催化作用下,以γ-T为底物转化合成α-T[47-48],通过超表达γ-T甲基转移酶基因可以实现种子中高含量γ-T向α-T的转化,从而提高种子中α-T的含量[49]。γ-T具有抗癌和防癌功效。目前,γ-T的抗癌和防癌研究已经取得重要进展,在γ-T的吸收和代谢[9-10]、γ-T抗癌作用及其分子机制[11-13]等方面的研究比较深入,在医学临床上得到广泛应用,取得了良好的效果。但是,实际生产中缺乏高维生素E含量特别是高γ-T含量的新品种,因此,本研究对于通过分子育种手段选育高维生素E含量大豆新品种特别是高γ-T大豆新品种,具有重要的参考价值。
作为育种工作者,进行分子标记辅助选择育种工作中,非常希望能够检测出大效应的QTL。本研究检测到的在2个环境中稳定表达的加性贡献率分别为29.54%和28.23%,但是,在3个环境中稳定表达的加性贡献率均小于10%。如何聚合和转移包括微效基因在内的多基因,对育种工作者提出了新的课题。
4 结论
γ-T最适遗传模型符合MX2-Duplicate-A,即2对重叠作用主基因×加性多基因模型。其遗传同时受到基因型、环境和上位性的影响。检测到γ-T的2个稳定主效QTL,Satt275—Satt038和Satt276—Satt364是共位标记区间。
致谢:海南省热带农业资源开发利用研究所方宣钧研究员和山西省农业科学院经济作物研究所刘学义研究员提供了连锁图谱和群体材料,谨此致谢。
[1] RIMBACH G, MOEHRING J, HUEBBE P. Gene-regulatory activity of alpha-tocopherol., 2010, 15: 1746-1761.
[2] ABBASI A R, HAJIREZAEI M, HOFIUS D, SONNEWALD U, VOLL L M. Specific roles of α- and γ-tocopherol in abiotic stress responses of transgenic tobacco., 2007, 143: 1720-1738.
[3] HINCHA D K. Effects of α-tocopherol (vitamin E) on the stability and lipid dynamics of model membranes mimicking the lipid composition of plant chloroplast membranes., 2008, 582: 3687-3692.
[4] 吴雪辉, 蓝梧涛, 容欧. 响应面优化油茶籽油脱臭馏出物中维生素E的提取工艺研究. 中国油脂, 2018, 43(5): 113-116.
WU X H, LAN W T, RONG O. Optimization of extraction of vitamin E from deodorizer distillate of oil-tea camellia seed oil by response surface methodology., 2018, 43(5): 113-116. (in Chinese)
[5] 王哲, 毛善俊, 李浩然, 王勇. 维生素E的催化合成路线分析. 物理化学学报, 2018, 34(6): 598-617.
WANG Z, MAO S J, LI H R, WANG Y. How to synthesize vitamin E., 2018, 34(6): 598-617. (in Chinese)
[6] TAVVA V S, KIM Y H, KAGAN I A, DINKINS R D, KIM K H, COLLINS G B. Increased alpha-tocopherol content in soybean seed overexpressing the perilla frutescens gamma-tocopherol methyltransferase gene., 2007, 26(1): 1-70.
[7] KANWISCHER M, PORFIROVA S, BERGMULLER E. Alterations in tocopherol cyclase activity in transgenic and mutant plants of Arabidopsis affect tocopherol content, tocopherol composition, and oxidative stress., 2005, 137: 713-723.
[8] 李辉, 罗非君, 林亲录. γ-生育酚抗癌作用研究进展. 粮食与油脂, 2013, 26(3): 6-8.
LI H, LUO F J, LIN Q L. Research progress on anticancer of gamma-tocopherol.,2013, 26(3): 6-8. (in Chinese)
[9] 郑景洲, 许友卿, 丁兆坤. 维生素E的功能、吸收与代谢(1). 生物学通报, 2005, 40(11): 1-2.
ZHENG J Z, XU Y Q, DING Z K. Function, absorption and metabolism of vitamin E (1)., 2005, 40(11): 1-2. (in Chinese)
[10] SONTAG T J. Cytochrome P450 omega-hydroxylase pathway of tocopherol catabolism. novel mechanism of regulation of vitamin E status., 2002, 277: 25290-25296.
[11] JIANG Q, RAO X, KIM C Y, FREISER H, ZHANG Q, JIANG Z Y, LI G L. Gamma-tocotrienol induces apoptosis and autophagy in prostate cancer cells by increasing intracellular dihydrosphingosine and dihydroceramide., 2012, 130(3): 685-693.
[12] HUANG Y, KHOR T O, SHU L M, SAW C L, WU T Y, SUH N, YANG C S, KONG A N T. A γ-tocopherol-rich mixture of tocopherols maintains Nrf 2 expression in prostate tumors of TRAMP mice via epigenetic inhibition of CpG methylation., 2012, 142(5): 818-823.
[13] YANG C S, SUH N. Cancer prevention by different forms of tocopherols., 2013, 329: 21-33.
[14] FENG F, DENG F, ZHOU P, YAN J, WANG Q, YANG R, LI X. QTL mapping for the tocopherols at milk stage of kernel development in sweet corn., 2013, 193(3): 409-417.
[15] GUPTA S, SANGHA M K, KAUR G, BANGA S S, BANGA S S. QTL analysis for phytonutrient compounds and the antioxidant molecule in mustard (L.)., 2015, 201 (3): 345-356.
[16] HADDADI P, EBRAHIMI A, LANGLADE N B,YAZDI-SAMADI B , BERGER M, CALMON A. Genetic dissection of tocopherol and phytosterol in recombinant inbred lines of sunflower through quantitative trait locus analysis and the candidate gene approach., 2012, 29(3): 717-729.
[17] GRAEBNER R C, WISE M, CUESTA-MARCOS A, GENIZA M, BLAKE T, BLAKE V C. Quantitative trait loci associated with the tocochromanol (vitamin E) pathway in barley., 2015, 10(7): e0133767.
[18] WANG X, ZHANG C, LI L, FRITSCHE S, ENDRIGKEIT J, ZHANG W, LONG Y, JUNG C, MENG J. Unraveling the genetic basis of seed tocopherol content and composition in rapeseed (L.)., 2012, 7(11): e50038.
[19] LI H, WANG Y, HAN Y, TENG W, ZHAO X, LI Y. Mapping quantitative trait loci (QTLs) underlying seed vitamin E content in soybean with main, epistatic and QTL× environment effects., 2016, 135(2): 208-214.
[20] LI H, LIU H, HAN Y, WU X, TENG W, LIU G. Identification of QTL underlying vitamin E contents in soybean seed among multiple environments., 2010, 120(7): 1405-1413.
[21] SHAW E, RAJCAN I. Molecular mapping of soybean seed tocopherols in the cross ‘OAC Bayfield’בOAC Shire’.. 2017, 136: 83-93.
[22] 李海燕. 大豆维生素E含量的遗传分析及QTL定位[D]. 哈尔滨: 东北林业大学, 2010.
LI H Y. Genetic and QTL analysis of the content of vitamin E in soybean[D]. Harbin: Northeast Forestry University, 2010. (in Chinese)
[23] 张红梅, 李海朝, 文自翔, 顾和平, 袁星星, 陈华涛, 崔晓艳, 陈新, 卢为国. 大豆籽粒维生素E含量的QTL分析. 作物学报, 2015, 41(2): 187-196.
ZHANG H M, LI H C, WEN Z X, GU H P, YUAN X X, CHEN H T, CUI X Y, CHEN X, LU W G. Identification of QTL associated with vitamin E content in soybean seeds., 2015, 41(2): 187-196. (in Chinese)
[24] 曹锡文, 刘兵, 章元明. 植物数量性状分离分析Windows 软件包SEA的研制. 南京农业大学学报, 2013, 36(6): 1-6.
CAO X W, LIU B, ZHANG Y M. SEA: a software package of segregation analysis of quantitative traits in plants., 2013, 36(6): 1-6. (in Chinese)
[25] WANG S C, BASTEN C J, ZENG Z B. Windows QTL cartographer 2.5 user manual. Department of Statistics[J/OL], North Carolina State University, Raleigh, NC, 2005.
[26] 王珍. 大豆SSR遗传图谱构建及重要农艺性状QTL分析[D]. 南宁: 广西大学, 2004.
WANG Z. Construction of soybean SSR based map and QTL analysis important agronomic traits[D]. Nanning: Guangxi University, 2004. (in Chinese)
[27] 梁慧珍. 大豆子粒性状的遗传及QTL分析[D]. 西安: 西北农林科技大学, 2006.
LIANG H Z. Genetic analysis and QTL mapping of seed traits in soybean ((L.) Merr) [D]. Xi’an: Northwest A&F University, 2006. (in Chinese)
[28] SONG Q J, MAREK L F, SHOEMAKER R C, LARK K G, CONCIBIDO V C, DELANNAY X, PECHT J E, CREGAN P B. A new integrated genetic linkage map of the soybean., 2004, 109: 122-128.
[29] MCCOUCH S R, CHO Y G, YANO M, PAUL E, BLINSTRUB M, MORISHIMA H, KINOSHITA T. Report on QTL nomenclature., 1997, 14: 11-14.
[30] 王金社, 李海旺, 赵团结, 盖钧镒. 重组自交家系群体4对主基因加多基因混合遗传模型分离分析方法的建立. 作物学报, 2010, 36(2): 191-201.
WANG J S, LI H W, ZHAO T J, GAI J Y. Establishment of segregation analysis of mixed inheritance model with four major genes plus polygenes in recombinant inbred lines population., 2010, 36(2): 191-201. (in Chinese)
[31] JANSEN R C, VAN OOIJIEN J M, STAM P, DEAN C. Genotype-by-environment interaction in genetic mapping of multiple quantitative trait loci., 1995, 91: 33-37.
[32] HAGIWARA W E, ONISH K, TAKAMURE I, SANO Y. Transgressive segregation due to linked QTLs for grain characteristics of rice.2006, 150: 27-35.
[33] CHANG W, DONG L, WANG Z, HU H, HAN Y, TENG W, ZHANG H, GUO M, LI W. QTL underlying resistance to two HG types offound in soybean cultivar ‘L-10’., 2011, 12: 233.
[34] KAZI S, SHULTZ J, AFZAL J, HASHMI R, JASIM M, BOND J, ARELLI P, LIGHTFOOT D. Iso-lines and inbred-lines confirmed loci that underlie resistance from cultivar ‘Hartwig’ to three soybean cyst nematode populations., 2018, 131(4): 757-773.
[35] 梁慧珍, 余永亮, 杨红旗, 许兰杰, 董薇, 牛永光, 张海洋, 刘学义, 方宣钧. 大豆异黄酮及其组分含量的遗传分析与QTL检测. 作物学报, 2015, 41(9): 1372-1383.
LIANG H Z, YU Y L, YANG H Q, XU L J, DONG W, NIU Y G, ZHANG H Y, LIU X Y, FANG X J. Genetic analysis and QTL mapping of isoflavone contents and its components in soybean., 2015, 41(9): 1372-1383. (in Chinese)
[36] PRIOLLI R H G, CAMPOS J B, STABELLINI N S, PINHEIRO J B, VELLO N A. Association mapping of oil content and fatty acid components in soybean., 2015, 203(1): 83-96
[37] ZHANG D, SONG H N, CHENG H, HAO D R, WANG H, KAN G Z, JIN H X, YU D Y. The acid phosphatase-encoding gene GmACP1 contributes to soybean tolerance to low phosphorus stress., 2014, 10(1): e1004061.
[38] 梁慧珍, 余永亮, 杨红旗, 张海洋, 董薇, 李彩云, 杜华, 巩彭涛, 刘学义, 方宣钧. 大豆产量及主要农艺性状QTL的上位性互作和环境互作分析. 作物学报, 2014, 40(1): 37-44.
LIANG H Z, YU Y L, YANG H Q, ZHANG H Y, DONG W, LI C Y, DU H, GONG P T, LIU X Y, FANG X J. Epistatic effects and QTL × environment interaction effects of QTLs for yield and agronomic traits in soybean., 2014, 40(1): 37-44. (in Chinese)
[39] CREGAN P B, JARVIK T, BUSH A L, SHOEMAKER R C, LARK K G, KAHLER A L, KAYA N, VANTOAI T T, LOHNES D G, CHUNG J, SPECHT J E. An integrated genetic linkage map of the soybean genome., 1999, 39(5): 1464-1490.
[40] 梁慧珍, 董薇, 许兰杰, 余永亮, 杨红旗, 谭政委, 许阳, 陈鑫伟. 不同氮磷钾处理大豆苗期主根长和侧根数的QTL定位分析. 中国农业科学, 2017, 50(18): 3450-3460.
LIANG H Z, DONG W, XU L J, YU Y L, YANG H Q, TAN Z W, XU Y, CHEN X W. QTL mapping for main root length and lateral root number in soybean at the seedling stage in different N, P and K environments., 2017, 50(18): 3450-3460. (in Chinese)
[41] 梁慧珍, 余永亮, 许兰杰, 杨红旗, 董薇, 谭政伟, 李磊, 裴新涌, 刘新梅. 大豆α-生育酚的遗传与QTL分析. 中国农业科学, 2019, 52(1): 11-20.
LIANG H Z, YU Y L, XU L J, YANG H Q, DONG W, TAN Z W, LI L, PEI X Y, LIU X M. Inheritance and QTL mapping for α-tocopherol in soybean., 2019, 52(1): 11-20. (in Chinese)
[42] 李婕, 王忠, 李永慈, 盖钧镒, 黄中文, 邬荣领. 异速生长的QTL定位模型及一因多效性扩展. 南京林业大学学报(自然科学版), 2014, 38(3): 35-39.
LI J, WANG Z, LI Y C, GAI J Y, HUANG Z W, WU R L. A novel QTL mapping model for allometric growth and pleiotropic extension., 2014, 38(3): 35-39. (in Chinese)
[43] HAGIWARA W E, ONISH K, TAKAMURE I, SANO Y. Transgressive segregation due to linked QTLs for grain characteristics of rice., 2006, 150: 27-35.
[44] ZHANG Z H, YU S B, YU T, HUANG Z, ZHU Y G. Mapping quantitative trait loci (QTLs) for seedling-vigor using recombinant inbred lines of rice (L.)., 2005, 91: 161-170.
[45] 方宣钧, 吴为人, 唐纪良. 作物DNA标记辅助育种. 北京: 科学技术出版社, 2001.
FANG X J, WU W R, TANG J L.. Beijing: Science and Technology Press, 2001. (in Chinese)
[46] SONG K, SLOCUM M K, OSBORN T C. Molecular marker analysis of genes controlling morphological variation in(syn. campestris)., 1995, 90: 1-10.
[47] HOFIUS D, SONNEWALD U. Vitamin E biosynthesis: biochemistry meets cell biology., 2003, 8(1): 6-8.
[48] KOCH M, LEMKE R, HEISE K P, MOCK H P. Characterization of γ-tocopherol methyltransferases fromL. and., 2003, 270(1): 84-92.
[49] 涂世伟. 甘蓝型油菜γ-生育酚甲基转移酶基因(BnVET4)克隆及其遗传转化的研究[D]. 金华: 浙江师范大学,2006.
TU S W. Manipulation ofencoding γ-tocopherol methyltransferases in oilseed rape (l.) [D]Jinhua: Zhejiang normal university, 2006. (in Chinese)
Mixed Inheritance Analysis and QTL Mapping for γ-tocopherol content in Soybean
LIANG HuiZhen1,2, XU LanJie1, DONG Wei1, YU YongLiang1, YANG HongQi1, TAN ZhengWei1, LI Lei1, LIU XinMei1
(1Sesame Research Center, Henan Academy of Agricultural Sciences, Zhengzhou 450002;2Xixia Branch, Henan Academy of Agricultural Sciences, Xixia 474550, Henan)
【】Inheritance and main QTL for the content of γ-tocopherol were detected by genetic analysis and QTL mapping. The results lay a genetic foundation for the selection of soybean varieties with high γ-tocopherol content in soybean.【】The RILs were derived from a cross between Jindou23 of commercial cultivar as the female parent and Huibuzhi of farm variety from Shanxi Province as the male parent that construct genetic linkage map. The map consisting of 232 marker loci spanned a total of 2 047.6 cM in length with an average spacing of 8.8 cM between adjacent marker loci. The parent lines and the RILs were cultivated in summer at Yuanyang experimental farm of Henan Academy of Agricultural Sciences, and in winter at Sanya of Hainan province in 2011, 2012, 2015. Random block design was adopted in field experiment, and the entire planting experiment was replicated twice. 15.00 g fully filled and uniform soybean seeds from each RILs in six environments were sampled. The content of γ-tocopherol was quantitatively and qualitatively analysis by High Performance Liquid Chromatography (HPLC). The content of γ-tocopherol in soybean was analyzed by major gene plus polygene mixed inheritance model approach. QTL for the content of γ-tocopherol in soybean were detected by composite interval mapping model using WinQTLCart 2.5. 【】The results showed that the content of γ-tocopherol was controlled by two pairs of main overlapping major gene × additive polygenes using major gene plus polygene mixed inheritance analysis. According to the data of Sanya, the epistasis effect value between two major genes was 0.4010-0.5169, and the additive effect value of polygene was 0.1797-0.2146. The results of Sanya experiment showed that the heritability of major gene and polygene were 11.27%-13.05% and 82.51%-86.55%, respectively. The polygene effect was greater than that of major gene effect. The data of Yuanyang experiment showed that the epistasis effect between the two major genes was 0.9646-1.8455, and the heritability of the major genes was 39.51%-58.96%. No polygenic effect was detected. QTLs resolved by using WinQTLCart 2.5 Compound Interval Mapping (CIM) analysis. Nine QTLs for the content of γ-tocopherol were mapped on chromosomes A1(Ch.5), A2(Chr.8), C1(Chr.4), K(Chr.9), M(Chr.7) and G(Chr.18), respectively. These QTL individually explained 7.29%-29.55% of the total phenotypic variation. The QTL offlanked by Satt275 and Satt038 (0.01 cM) on chromosome 8, were detected in three environmental conditions of 2011 at Yuanyang, 2012 and 2015 at Sanya, and explained 8.97%, 8.12%, 7.91% of the phenotypic variation, respectively. The QTL offlanked by Satt276 and Satt364 (0.01 cM) on chromosomes 5, were detected in three environmental conditions of 2011 and 2015 at Yuanyang, and explained 29.54%, 28.23% of the phenotypic variation, respectively.andcan be stably expressed in different genetic backgrounds. 【】The content of γ-tocopherol was controlled by two pairs of overlapping major Gene × additive Polygenes genetic model (MX2-Duplicate-A). Its inheritance was influenced by gene, environment, and epistasis. The two stable inheritance main-effect QTL for the content of γ-tocopherol were co-localization with marker Satt275-Satt038 and Satt276-Satt364 intervals in soybean, respectively. The co-localization marker interval has certain reference value for molecular marker assisted soybean breeding.
soybean;γ-Tocopherol; genetic; major genes plus polygene; gene mapping; epistasis

10.3864/j.issn.0578-1752.2020.11.002
2019-09-26;
2019-12-03
国家现代农业产业技术体系建设专项(CARS-21)、国家农业科研杰出人才及其创新团队(农财发(2016)45号)、国家973计划(2008CB117005)、河南省药用植物遗传改良创新型科技团队、河南省科技攻关计划(182102310062)、河南省重大科技专项(181100110300)、河南省农业科学院创新创意(2020CX03)
梁慧珍,Tel:0371-65751589;E-mail:lhzh66666@163.com
(责任编辑 李莉)
