东农冬麦1号TaPRK基因的生物信息学分析及低温和ABA、SA、MeJA对其表达模式的影响
2020-07-31宋春华崔婉琳王多佳王军虹
宋春华,苍 晶,于 萍,崔婉琳,张 达,王多佳,孟 婧,王军虹
(东北农业大学生命科学学院,黑龙江哈尔滨 150030)
小麦作为主要的粮食作物具有很高的营养和研究价值。黑龙江高寒地区受大陆季风性气候控制,低温胁迫是限制该地区种植冬小麦的主要因素。东农冬麦1号(Dn1)是首例能在黑龙江高寒地区安全越冬的冬麦品种(返青率大于85%),是抗寒研究的珍贵材料[1-2]。因此,开展冬小麦抗寒机制研究对于丰富作物抗寒理论、推动黑龙江高寒地区农业生产具有重要的理论和现实意义。
研究表明,对初级碳水化合物代谢相关的基因进行遗传操作是一种具有广阔前景的作物改良方式[3]。卡尔文循环是碳水化合物代谢的基本途径之一,了解其基因调控过程,有利于对植物光合作用进行有目的地改造。在卡尔文循环中,磷酸核糖激酶(PRK)在调节糖代谢过程中起着关键作用,同时也是负责控制同化和再生阶段之间平衡的关键酶之一[4]。PRK催化核酮糖1,5-二磷酸(RuBP)再生,为同化CO2提供受体[5]。这种激酶反应,是将ATP的g-磷酰基转移到核酮糖5-磷酸C-1羟基上的唯一途径,通过该途径可以重新引导Calvin循环中间体用于CO2固定[6]。PRK由核基因组编码并在细胞质中合成,其N-末端具有转运肽的前体蛋白,可以将酶运送到叶绿体[7]。PRK的活性受光、NADP/NADPH比和Mg2+水平的调节,同时也可通过PRK/CP12/GAPDH复合物的可逆解离来调节。有关PRK与植物各种代谢途径之间的调控关系[8-9],及其时空调控网络还有待于进一步研究。
研究表明,脱落酸(ABA)对植物的光合作用有一定的影响,在稳定光合器官及防护光抑制等方面起着重要的作用[10-11]。外源水杨酸(SA)可提高干旱胁迫下RuBP的活性以及叶绿素的含量,进而改善干旱胁迫下作物的生长,增加干物质积累量和产量。在植物遭受逆境胁迫(如低温和盐碱)时积累大量活性氧(ROS),喷施外源SA可以增加过氧化氢酶(CAT)和超氧化物歧化酶(SOD)的活性,进而增强清除ROS的能力[12-13]。茉莉酸甲酯(MeJA)同样参与作物应对低温胁迫的过程,在氧化胁迫中起信号传递作用[14-15]。但目前关于ABA、SA和MeJA参与调控植物碳同化的研究仍然十分有限,本研究对PRK进行了生物信息学预测分析,同时通过qRT-PCR分析了寒胁迫下冬小麦PRK基因的表达模式,进而探索TaPRK参与冬小麦响应寒胁迫的机制,为丰富冬小麦抗寒理论及选育抗寒新品种提供理论依据。
1 材料与方法
1.1 材 料
试验材料:强抗寒冬小麦品种东农冬麦1号(Dn1)(可耐-30 ℃),在黑龙江地区返青率≥80%;弱抗寒冬小麦品种济麦22(J22),在黑龙江地区返青率<2%。
于2016年9月13日播种于东北农业大学试验田,属中温带大陆性季风气候,年平均气温 3.5 ℃,年平均降雨量约为400~600 mm。小区面积4 m2(2 m×2 m),每区10行,行距为 0.2 m。每行播种150粒,播深5 cm,田间常规管理[16]。
于三叶期(2016年10月1日)对冬小麦叶片分区喷施1 mmol·L-1MeJA、1 mmol·L-1SA和10-5mol·L-1ABA,喷洒蒸馏水为对照。大田自然降温,连续7 d最低温度分别达到5 ℃(2016年10月8日)、0 ℃(2016年10月25日)、-10 ℃(2016年11月9日)和-25 ℃(2017年1月11日)时,分别取样叶片和分蘖节,剪成1 cm小段,分别装袋,用液氮迅速冷冻后置-80 ℃冰箱备用。
1.2 试验方法
1.2.1 RNA提取和实时荧光定量PCR分析

1.2.2 生物信息学分析
通过NCBI中的Blastp在线工具进行其他物种的同源氨基酸序列检索,使用Clustal X 1.8 和DNAMAN 7.0进行氨基酸序列同源比对,用MEGA 6.0软件构建系统进化树。利用在线软件GSDS(http://gsds.cbi.pku.edu.cn/)进行基因结构分析,用ExPASy-ProtParam tool(http://web.exp asy.org/protparam/)软件分析PRK蛋白的理化性质,利用在线预测软件SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(http://swissmodel.expasy.org/)分别预测PRK蛋白质的二级和三级结构。利用TMHMM Server 2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行跨膜结构域分析,利用CELLO v2.5(http://cello.life.nctu.edu.tw/)进行TaPRK蛋白的亚细胞定位分析,利用Siqnal P Server(http://www.cbs.dtu.dk/services/SignalP)进行信号肽预测,利用Netphos Server(http://www.cbs.dtu.dk/services/NetPhos)预测磷酸化位点。
2 结果与分析
2.1 PRK蛋白生物信息学分析
2.1.1 PRK蛋白的理化性质
序列分析表明,冬小麦TaPRK基因与中国春(X51608)一致,含有一个1 215 bp的开放阅读框,编码404个氨基酸。经ExPASy-ProtParam tool在线预测分析,PRK蛋白的相对分子质量为45.09 kDa,理论等电点(pI)为5.72,是弱酸性蛋白。其不稳定系数(Instability index)为28.67,属于稳定蛋白质(<40,蛋白质稳定);脂肪族系数(Aliphatic index)为82.30,总平均亲水系数(Grand average of hydropathicity)为-0.302,表明该蛋白是亲水蛋白。该蛋白由20种氨基酸组成,分子式为C2011H3158N540O607S15,含有20个丝氨酸(Serine)磷酸化位点、16个苏氨酸(Threonies)磷酸化位点和6个酪氨酸(Tyrosines)磷酸化位点。TMHMM Server 2.0和SignalP Server表明,该蛋白无信号肽和跨膜结构域,属于非分泌蛋白。经在线工具CELLO 2.5分析可知,小麦PRK蛋白质只存在于叶绿体,并具有一段由52个氨基酸构成的叶绿体转运肽。
2.1.2 PRK蛋白质的二、三级结构
利用SOPMA在线对PRK蛋白进行二级结构预测,结果显示,小麦中PRK蛋白二级结构主要由α-螺旋、延伸链和无规则卷曲3种成分组成,分别占总蛋白的33.91%、16.83%和49.26%。预测结果表明,PRK蛋白二级结构为mixed型。
为了进一步了解PRK的蛋白特性,使用同源建模在线预测SWISS-MODEL分析系统进行三维模型的构建,结果如下:构建模板蛋白为5b3f.1.A,PRK与模板的氨基酸序列同源性为91.54%,低聚糖状态为同源二聚体,1种配体(4xSO3),属于尿苷激酶家族,GMQE(Global Model Quality Estimation)值为0.51,QMEAN值为-3.48。
2.1.3 PRK蛋白质多序列比对
经过DNAMAN 7.0软件进行多序列比对显示,小麦PRK蛋白质与水稻(Oryzasativa)、玉米(Zeamays)和二穗短柄草(Brachypodiumdistachyon)的PRK蛋白质相似性分别为 92.1%、84.78%和94.8%。在小麦PRK蛋白质序列发现了残基Cys-52和Ser-53之间转运肽的切割位点,在N-末端发现了含有52个氨基酸构成的叶绿体转运肽,与ATP结合的保守区域Cys-68和Cys-107参与小麦PRK蛋白质的氧化还原活化,残基Cys-107也是催化所必需的。His-112和Arg-116这两个残基参与了底物核酮糖5-磷酸的结合(图1)。
2.1.4 PRK蛋白质系统进化树分析
利用 MEGA 6.0 软件对小麦与节节麦(Aegilopstauschii)、乌拉尔图小麦(Triticumurartu)、大麦(Hordeumvulgare)、二穗短柄草(Brachypodiumdistachyon)、水稻(Oryzasativa)、狗尾草(Setariaitalica)、玉米(Zeamays)、博落回(Macleayacordata)、黄麻(Corchoruscapsularis)、月季(Rosachinensis)、蓖麻(Ricinuscommunis)、山萮菜(Eutremasalsugineum)、红车轴草(Trifoliumpratense)、拟南芥(Arabidopsisthaliana)和大豆(Glycinemax)物种PRK蛋白质序列进行分析,采用邻接法(Neighbor-Joining)构建进化树,结果(图2)表明,TaPRK与AetPRK、TuPRK、HvPRK和BdPRK亲缘关系较近(皆为单子叶禾本科植物),其中小麦与节节麦聚到了一组,乌拉尔图小麦、大麦和二穗短柄草分别聚为一组,水稻和玉米聚到一组。在双子叶植物中,拟南芥和山萮菜聚到了一组,而大豆与其他几种植物的聚类关系最远(图2)。

图2 PRK蛋白质系统发育进化树
2.1.5TaPRK基因结构分析
如图3所示,利用在线软件GSDS(http://gsds.cbi.pku.edu.cn/)对小麦、节节麦、乌拉尔图小麦、大麦、二穗短柄草、水稻、狗尾草、玉米、博落回、黄麻、月季、蓖麻、山萮菜、红车轴草、拟南芥和大豆物种的PRK基因结构进行分析,发现除二穗短柄草外,均含有5个外显子和4个内含子,基因长度均小于4 000 bp。进化树中大麦、节节麦和乌拉尔图小麦和冬小麦的PRK基因进化关系较近,且具有相似的基因结构和外显子数量,保守性较高(皆为单子叶禾本科植物),其中TaPRK含有5′UTR,TaPRK的5′UTR发现有调控元件控制基因表达的元件启动子。这些调控元件可能与TaPRK基因表达有关。

图3 PRK基因结构
2.2 TaPRK在不同冬小麦品种的表达模式分析
如图4a所示,在大田自然降温的条件下,Dn1叶片中TaPRK的相对表达量随温度降低呈现“降-升-降”的变化规律,-10 ℃时达到峰值;J22叶片中TaPRK的相对表达量随着温度的降低呈逐渐降低趋势。Dn1叶片中TaPRK相对表达量在-10 ℃和-25 ℃时显著高于J22,而在0 ℃时显著低于J22叶片中TaPRK的相对表达量。
如图4b所示,Dn1和J22分蘖节中TaPRK的相对表达量随着温度降低呈先增后降趋势。Dn1分蘖节中TaPRK的相对表达量在-10 ℃达到峰值;J22分蘖节中TaPRK的相对表达量在0 ℃达到峰值,在-10 ℃和-25 ℃趋势平缓。在整个越冬期间,Dn1分蘖节中TaPRK相对表达量都极显著高于J22。

*和**分别表示两个品种之间具有显著(P<0.05)和极显著(P<0.01)差异。图5同。
2.3 外源ABA、SA和MeJA对Dn1分蘖节和叶片TaPRK表达模式的影响
RT-PCR分析外源ABA、SA和MeJA诱导分蘖节和叶片中TaPRK的表达模式,结果显示,在外源ABA处理下,Dn1叶片中TaPRK的相对表达量表现为明显的先增后降趋势,在-10 ℃达到峰值,并且显著高于对照;外源SA处理下,Dn1叶片中TaPRK的相对表达量呈现“降-升-降”的变化规律,-10 ℃时显著高于对照;外源MeJA处理下,Dn1叶片中TaPRK的相对表达量在5 ℃时与对照组差异不显著,在0 ℃和-25 ℃时显著高于对照,在-10 ℃时显著低于对照,且在0 ℃时TaPRK的相对表达量达到峰值(图5a)。
外源ABA、SA和MeJA处理下,Dn1分蘖节中TaPRK的相对表达量均随着温度的降低表现为先升后降的趋势,且均在-10 ℃时达到峰值。在整个越冬期间,外源ABA和MeJA处理的Dn1分蘖节中TaPRK的相对表达量显著高于对照;在0 ℃和-10 ℃时,外源SA处理Dn1分蘖节TaPRK的相对表达量显著高于对照(图5b)。
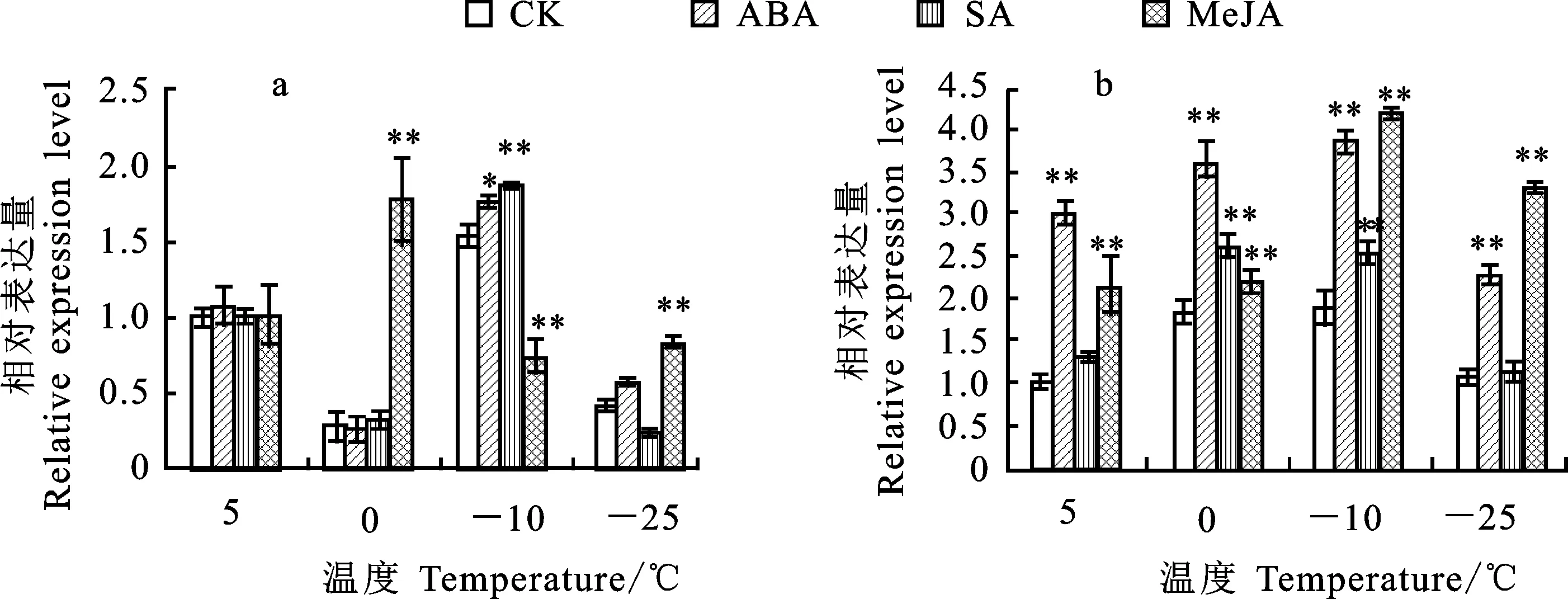
图5 不同温度下exo-ABA、SA、MeJA对Dn1叶片(a)和分蘖节(b)中TaPRK相对表达量的影响
3 讨 论
本研究发现PRK蛋白质含有的核酮糖5-磷酸、ATP结合位点和调节TaPRK基因的半胱氨酸残基与水稻的PRK蛋白质相似。TaPRK基因的5′UTR发现有许多控制基因表达的元件。这些调控元件可能与TaPRK基因表达有关,但没有直接证据证明这些元件调节TaPRK基因的表达。一般来说,TaPRK基因5′UTR的调节元件通过与一些转录因子的相互作用来发挥重要的调节作用[17]。因此,我们认为TaPRK基因可能是研究卡尔文循环中基因表达调控机制的非常好的候选者。
以往研究表明,PRK类转录因子在植物组织中有表达差异,如许多在叶片中高量表达,在茎和花中却表达量很少或不表达[17]。本研究结果表明,Dn1分蘖节和叶片中TaPRK的相对表达量随着温度降低呈现不同的趋势,在-10 ℃表达量最高,这与实验室前期证明-10 ℃是Dn1启动抗寒机制的关键温度点相一致[16]。而J22分蘖节和叶片中TaPRK的相对表达量在0 ℃时达到峰值,比Dn1提前响应低温胁迫。总体来说,越冬期间Dn1分蘖节和叶片中TaPRK的相对表达量明显高于J22,进一步说明强抗寒冬小麦品种Dn1,在越冬期间碳同化效率更高,为积累更多的碳水化合物奠定了基础,在土壤封冻后叶片和地下茎均有较多的蔗糖和果糖积累,为植物越冬及返青提供重要能量保障[18-20]。
寒冷、干旱、盐碱和水涝等逆境都会使植物体内ABA的含量迅速增加,喷施外源ABA可以刺激叶片内源ABA含量增加,从而提高植物对环境胁迫的适应性[21-22]。刘丽杰等[23]发现在冬小麦越冬期间喷施外源ABA促进了分蘖节中可溶性糖和淀粉的积累。ABA在植物中参与葡萄糖传导途径,ABA的增加会提高相应基因的表达水平及发育的抑制[24]。本研究结果表明,外源ABA促进低温(-10 ℃)环境中Dn1叶片中TaPRK的表达,呈现正调控,但在5 ℃和0 ℃时ABA调控TaPRK的机制并未启动,这可能是5 ℃和0 ℃时ABA处理过的Dn1幼苗中的TaPRK还未对寒冷做出应答。寒胁迫和外源ABA共同作用使冬小麦幼苗中ABA含量增加,促进了TaPRK上调表达。此外,确定ABA介导的信号通路参与冬小麦响应低温胁迫的机制,以及它们如何调节TaPRK基因表达将是未来工作的一个重要领域。
JA作为一个植物对逆境响应关键的调节因子,对植物生长和发育起着重要作用[25]。它可以促进种子萌发、幼苗生长、叶绿素形成和光合作用过程等。研究发现外源MeJA可以促进光合基因(如rbcS、rbcL、cab和PRK等)的转录[26-28]。本研究结果表明,外源MeJA促进低温(0 ℃和-25 ℃)环境中Dn1叶片中TaPRK的表达,呈现正调控,与上述结果一致,即MeJA处理过的冬小麦幼苗中的TaPRK提前对寒冷做出响应。有研究表明,外源SA喷施叶片使叶绿体的结构发生变化,调节气孔开放程度,进而提高植物的光合作用效率,减轻逆境对植物的伤害[20,29-30]。Soliman等[31]研究表明,植物通过调节SA变化获得最佳光合性能,以此来适应不断变化的环境刺激。本研究表明,外源SA促进低温(-10 ℃)环境中Dn1叶片中TaPRK的上调表达,碳同化效率更高,积累更多的光合产物。
综上,外源ABA、SA和MeJA通过TaPRK的上调表达,在一定程度上减轻低温胁迫对冬小麦光合作用的抑制,从而提高冬小麦的抗寒性。
