人工主动脉瓣膜功能障碍二次置换术临床报道及思考
2020-07-29王志盛
王志盛
瓣膜置换是临床治疗心脏瓣膜病变的成熟技术,可以有效降低心脏负荷,改善临床症状,提高患者生活质量,延长其寿命。随着人工瓣膜使用时间的延长,术后出现人工瓣膜功能障碍的患者也逐渐增多。人工瓣膜置换术后最严重的并发症之一是瓣膜功能障碍,具有极高的病死率,而目前针对人工瓣膜功能障碍最有效的治疗方法是再次瓣膜置换[1]。据相关学者研究指出,针对人工瓣膜功能障碍患者实施再次瓣膜置换,其疗效显著,可显著消除患者瓣膜狭或是反流,提升瓣口面积指数以及生活质量,改善患者运动耐力。近年来,在临床实践中,笔者采用回顾分析方式针对收治的9例主动脉瓣置换(aortic valve replacement,AVR)术后瓣膜功能障碍患者,其中7例实施了二次AVR术,取得了较为满意的治疗效果,现报道如下。
1 资料与方法
1.1 临床资料
2010年1月—2016年12月期间,收治9例主动脉瓣膜置换术后主动脉瓣膜功能障碍患者。男性4例、女性5例;年龄43~65岁,平均(52.6±5.5)岁;首次AVR术前病因:风湿性心脏病瓣膜病变5例、老年瓣膜退行性变3例、冠心病左房室瓣膜缺血病变1例;单瓣置换6例,双瓣置换3例;首次主动脉瓣膜置换术至出现瓣膜功能障碍的时间为5~12年,平均(8.2±2.6)年。
1.2 超声心动图检查
采用PHILIPS IE33彩色超声诊断仪行经食道超声心动图(transesophageal echocardiography TEE)检查,探头频率调整为2.0~4.0 MHz。在患者的食道中段主动脉长轴以及经胃深部长轴图实施扫查。对患者的主动脉瓣膜开放以及关闭状况进行观察,同时将跨瓣压差进行记录,查看患者是否出现反流和瓣周漏等情况。
1.3 再次AVR术
主动脉瓣选择:19 mm的SJM Regent瓣,瓣口直径在17 mm以上,但是在19 mm或是以下者;现将牛心包补片加宽,随后挑选19 mm的SJM Regent瓣,瓣环瓣口直径在17 mm或是以下者;21 mm的Hancock II ultra生物瓣,瓣口直径在19 mm以上,但是在21 mm或是以下者。
手术操作:指导患者保持平卧位,随后实施全麻。常规桡动脉留置测压管、右颈内静脉留置测压管和Swan-Ganz漂浮导管监测血流动力学变化。在心脏停跳下、中度低温以及中度稀释体外循环状态下实施AVR术。全部利用原有手术切口(胸骨正中切口),开胸采用摆动锯,将心包切开,全身肝素化,将插腔房管插入右心房,主动脉插管。并行循环,渐渐降温,控制在28~30℃的时候,把主动脉阻断,右冠状动脉开口上方1.5 cm斜行切开主动脉壁,经左冠状动脉和右冠状动脉的开口将冷血心脏停搏液直接灌注其中,采取温诱导-冷维持-温复苏的策略保护心肌,心包内置冰屑。当患者的心脏停跳后,将原有主动脉瓣拆除,把钙化组织完全去除,防止左心室内落入小碎块。沿主动脉瓣环间断褥式缝合1周换瓣线,缝线另一端穿过置换瓣膜的瓣环,落瓣后依次打结。当左心排气后,对主动脉切口连续缝合。开放阻断钳,恢复心脏灌注,心脏复跳后,TEE检查主动脉瓣反流情况(仅允许轻度反流),持续辅助循环,维持血流动力学稳定和酸碱平衡,监测尿量和出入量,稳定逐渐停机。随后将导管依次拔出,并逐层关胸。
1.4 术后处理
AVR术后,予以常规改善心功能药物治疗3个月,并给予患者华法林抗凝,使用方式为口服,对患者的凝血四项进行定期化验,严格按照国际标准化比值(international normalized ratio,INR)调整华法林用量,INR维持在1.5~2.0。
1.5 主要观察指标
分别于术前、术后7 d,采用TEE测量手术前后的有效瓣口面积指数、跨瓣平均压、跨瓣峰速以及跨瓣压差。患者顺利出院后,对患者进行跟踪随访,复查超声心动图。
1.6 统计学方法
应用统计学软件SPSS 22.0对资料进行分析处理,计数资料采用例(%)表示,采用χ2检验,计量资料采用(±s)表示,采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 手术相关情况
9例患者中,7例实施了二次AVR术。术中发现人工主动脉瓣均有不同程度结构性破坏,主要为瓣叶撕裂或钙化,如左冠瓣及无冠瓣交界处上下有内膜增生,主动脉瓣口可见赘生物(见图1),因此阻挡了瓣叶的开启,其中以早年国产侧倾碟瓣尤为明显。7例患者均成功拆除了原有瓣膜,原有瓣膜中19号瓣5例、21号瓣2例,其中4例为国产双叶瓣、3例进口双叶瓣。7例患者均尽可能的切除了增生的内膜组织,并行瓣环扩大术,植入大一号人工主动脉瓣膜,原5例19号瓣膜改植入21号瓣、2例21号瓣改植入23号瓣膜。体外循环时间92~205 min,平均(117.5±20.3) min;主动脉阻断时间67~119 min,平均(83.6±18.3) min。手术过程顺利,术后患者安全返回ICU。术后早期并发频发室性早搏1例,经治疗后痊愈;III度房室传导阻滞1例(风湿性主动脉瓣病变患者),经药物调理后心率维持在50~60次/min,未安装永久起搏器,患者无不适出院。住院期间无死亡病例。
2.2 TEE所见
术前经TEE检查,二叶瓣畸形超声影像特征为两叶呈“=”横裂关闭状态者2例,呈“//”斜形关闭状态者3例(图2),呈“||”纵裂关闭状态者2例;主动脉瓣尖均有不同程度的回声增强、瓣膜增厚并有点状或团状钙化(图3)。3例单纯主动脉瓣口狭窄(中度狭窄2例、重度狭窄1例),4例单纯主动脉瓣反流(中度反流2例、重度反流2例)。术后7 d,复查TEE,跨主动脉瓣峰速、跨瓣平均压差均较术前显著降低,有效瓣口面积指数均较术前显著增加,P<0.05,差异有统计学意义,见表1。
表1 二次AVR手术前后TEE指标水平比较 (±s)

表1 二次AVR手术前后TEE指标水平比较 (±s)
时间点 跨瓣峰速(m/s) 跨瓣平均压差(mmHg) 有效瓣口面积指数(cm/m2)术前 4.45±0.36 52.86±5.37 0.72±0.03术后 7 d 2.46±0.61 15.34±3.76 1.80±0.12 t值 8.429 17.170 26.194 P值 0.000 0.000 0.004
2.3 术后随访
术后7例患者均获得随访,随访11个月~3年,平均(21.3±8.6)个月,随访期内无死亡病例。术后所有患者体质量均显著增加、心功能指标及运动耐力明显改善;随访期间,机械瓣膜功能正常,无瓣膜功能失调或者是卡瓣,无瘤样膨出、牛心包补片撕裂、血栓形成、钙化、感染以及免疫反应等状况发生;除1例患者发生低心排综合征外,其余患者均未述明显不适症状。

图1 手术切除标本(瓣口可见赘生物)
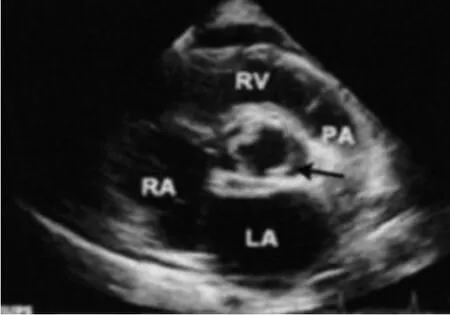
图2 斜裂式BAV的二维显像图(两叶呈“//” 斜裂开放)

图3 斜裂式BAV的三维显像图(主动脉窦及瓣叶的立体形态)
3 讨论
先天性二叶瓣、风湿性和老年性瓣膜钙化是主动脉瓣狭窄的常见原因,患者在代偿期没有明显的临床体征,当发生心力衰竭、呼吸困难,晕厥以及心绞痛等症状,其两年内的死亡率约为60%[2]。主动脉瓣置换手术治疗主动脉。主动脉瓣膜置换是外科手术治疗主动脉瓣狭窄的成熟术式,人工生物瓣与机械瓣是临床较为常用的瓣膜,但两者临床应用也各有利弊。生物瓣比机械瓣具有更好的血液动力学特性,因此不需要终生抗凝剂,血栓形成的发生率更低,并且可以避免抗凝剂治疗引起的致命性出血。但是,随着时间的流逝,生物瓣膜会受到损害,同时限制生物瓣在临床使用只要原因分别为功能丧失引起的瓣膜返流和狭窄[3-4]。近年来,随着生物瓣制作工艺的改进,生物瓣与机械瓣的近中期效果基本相当,但远期疗效如何尚有待长期随访结果。
随着人工瓣膜使用时间的延长,特别是早期置换的生物瓣膜,普遍存在衰败早、失功的缺点,是限制其使用的主要原因。本研究中9例患者首次主动脉瓣膜置换术至出现瓣膜功能障碍的时间为5~12年,平均(8.2±2.6)年,这显示大多数瓣膜衰坏进展是比较缓慢的。首次瓣膜置换后一旦出现瓣膜失功等,对于心功能Ⅲ/Ⅳ级(NYHA分级)或者是临床症状严重者,可将二次瓣膜置换作为金标准[5]。二次瓣膜置换术可能面对术后严重的低心排、严重的粘连、长时间体外循环以及术中大出血等风险[6]。文献[7]研究表明,二次主动脉瓣膜置换术后的病死率为2%~7%,高危患者可高达30%。本研究中,7例患者实施了二次AVR术,术后TEE检查及随访显示取得了良好的治疗效果,具体表现在有效消除了瓣膜反流、狭窄等,复查TEE降低了跨主动脉瓣峰速、跨瓣平均压差,提高了有效瓣口面积指数;术后随访,机械瓣膜功能良好,显著改善了运动耐力和患者的生活质量,且未出现明显的术后并发症,提示二次AVR术具有较高的安全性。这与类似文献[8-9]研究的观点是一致的,低风险患者在瓣膜功能失效后进行了二次瓣膜手术,并且手术的风险没有显著高于初次手术的风险。 然而,随着许多老年患者的增加,还有许多其他严重的长期疾病,例如无法承受再循环手术、呼吸衰竭或是严重的肝衰竭,由此可能降低了二次AVR术的成功率及增加了围手术期的风险。但是,本研究中患者病例数偏少,还需要进一步扩充样本数据来证实。
在瓣膜置换技术方面,2002年Cribier等完成了首例经导管主动脉瓣置换术(transcatheter aortic valve implantation,TAVI),为高危或有手术禁忌证的患者提供了可选择的治疗途径[10],首例经导管在损毁的生物瓣内再次种植中主动脉瓣的手术,简称“瓣中瓣”技术(valve-in-valve,VIV)[11]。新近文献[12]报道,经导管再次生物瓣膜置换(VIV)相对于传统二次开胸手术可以明显降低高危患者的术后病死率和并发症发生率。但是,目前经导管在主动脉瓣生物瓣内再次种植瓣膜(TAV-in-SAV)[13]的报道尚不多见,多为个案报道,样本量最大的病例数仅11例。在瓣膜材料方面,近年来兴起的组织工程心脏瓣膜彰显出良好的广泛前景,具有优良的血流动力学特征、低或甚至无免疫反应、不需长期抗凝治疗、耐用性好等特点,很好地克服目前临床上使用的机械瓣和生物瓣的缺点,成为潜在的理想的人造心脏瓣膜[14]。
综上所述,对于主动脉瓣膜置换术后瓣膜失功者,就目前而言最有效的治疗途径仍是二次瓣膜置换,具有较好的术后效果和较高的安全性。对于部分高龄、高危、存在体外循环手术禁忌的患者,TAVI、瓣中瓣等技术提供了可选择的替代治疗途径。
