转录因子ZmMYB153 与TPL/TPRs 蛋白的互作研究
2020-07-29曹宏哲刘鹏飞藏金萍董金皋邢继红
白 华,曹宏哲,刘鹏飞,周 帆,藏金萍,董金皋,张 康,邢继红
(河北省植物生理与分子病理学重点实验室/河北农业大学 真菌毒素与植物分子病理学实验室,河北 保定 071000)
在植物中,MYB 转录因子超家族数量庞大且功能多样,它们在不同组织和不同生理阶段特异性表达,是植物发育、代谢和抗逆反应体系中的关键因子[1-2]。R2R3-MYB 型转录因子是MYB 转录因子超家族中数量最多的成员,其包含2 个保守MYB结构域,在植物初生和次生代谢、细胞形态建成、生长发育、抵抗生物和非生物胁迫中发挥重要作用[2-4]。R2R3-MYB 型转录因子中的一些蛋白能够通过与TPL/TPRs(TOPLESS/TOPLESS-related proteins)蛋白互作,参与植物抗虫、防御非生物胁迫和种子发育等多种过程[5]。
TPL/TPRs 蛋白是一类保守的植物转录辅抑制因子家族蛋白,包括TPL、TPR1、TPR2、TPR3 和TPR4。在植物中,TPL/TPRs 蛋白家族通过与乙烯反应因子相关的反应抑制基序(EAR motif)相互作用,参与调控植物生长发育、应激反应以及信号通路调节等一系列生理生化过程[6]。研究发现,TPL/TPR 转录辅抑制因子蛋白家族在茉莉酸信号转导通路、植物生长激素信号通路和独角金内酯信号通路中起非常重要的作用[7]。MYB44 转录因子在R2R3-MYB 型转录因子中研究最为深入,并含有EAR 基序。研究已明确MYB44 转录因子通过EAR 基序与TPL/TPRs 蛋白直接互作,从而抑制特定基因的转录活性,进一步调控植物的发育、胁迫反应和激素信号等[8]。研究发现,MYB44 与TPRs 形成复合物,并招募组蛋白去乙酰化酶以信号非依赖性方式抑制蛋白磷酸酶2C(PP2Cs)基因的转录,增强植株对干旱和盐胁迫的耐受性[8-9]。此外,MYB44 参与调控多种植物抗逆信号通路,包括脱落酸介导的对非生物胁迫的耐受性、通过调控乙烯信号通路参与抵抗害虫的作用以及通过水杨酸信号通路增强拟南芥对丁香假单胞菌番茄致病变种(PstDC3000)的抗性[10-11]。Causier 等人通过酵母双杂交和双分子荧光互补试验,证实了EAR 基序在MYB44 与TPRs蛋白互作中具有重要作用,EAR 基序突变能阻断AtMYB44 与TPRs 蛋白之间的互作[12-13]。目前,玉米中R2R3-MYB型转录因子的相关研究尚未见报道。
本实验室前期通过对玉米R2R3-MYB 基因家族进行分析,发现ZmMYB153 与MYB44 序列一致性最高,为63.54%(NCBI-blastp),且同样含有EAR 基序。但是,ZmMYB153 与TPL/TPRs 的互作关系以及EAR 基序在其互作中的功能尚未明确。本研究拟利用酵母双杂交技术对ZmMYB153与TPL/TPRs 的互作关系进行分析验证,为阐明ZmMYB153 在玉米生长、发育和抵抗生物、非生物胁迫中的功能和调控机制奠定基础。
1 材料与方法
1.1 试验材料
酵母双杂交载体PGBKT7(BD)和PGADT7(AD)、酵母菌株AH109、玉米自交系B73 和拟南芥野生型Col-0,由河北省植物生理与分子病理学重点实验室/河北农业大学真菌毒素与植物分子病理学实验室保存和提供。
1.2 ZmMYB153、ZmMYB153-mEAR 的酵母双杂交载体的构建
利用SDS 法,提取玉米自交系B73 的总RNA;利用TaKaRa cDNA 合成试剂盒,进行其cDNA 的合成。使用ZmMYB153 和ZmMYB153-mEAR 的特异性上下游引物(表1),以玉米自交系B73 的cDNA 为模板,扩增ZmMYB153 和ZmMYB153-mEAR。将ZmMYB153 和ZmMYB153-mEAR 分别与入门载体pBM27 连接,转化Trans 5α,抗性筛选获得的阳性克隆进行菌落PCR 和测序鉴定后,与终载体BD、AD 进行LR 重组反应,经PCR 和测序鉴定后获得BD-ZmMYB153、AD-ZmMYB153、BD-ZmMYB153-mEAR、AD-ZmMYB153-mEAR。
1.3 TPL/TPRs 的酵母双杂交载体的构建
利用OMEGA 植物RNA 提取试剂盒,提取拟南芥Col-0 的总RNA;利用TaKaRa cDNA 合成试剂盒,进行其cDNA 的合成。使用TPL/TPRs 特异性上下游引物(表1),扩增TPL/TPRs 基因序列,并将其分别与入门载体pBM27 连接,进行克隆、测序后获TPL/TPRs 的入门载体TPL-pBM27、TPR1-pBM27、TPR2-pBM27、TPR3-pBM27 和TPR4-pBM27。利用LR 重组试剂盒,将TPL/TPRs 的入门载体分别与终载体BD、AD 进行重组反应,经PCR 和测序鉴定后获得TPL/TPRs 的酵母双杂交载体。

表1 试验所用引物Table 1 Primers used in this study
1.4 ZmMYB153、TPL/TPR 的自激活活性检测
将5 μL 预冷的BD-ZmMYB153、BD-TPL、BD-TPR1、BD-TPR2、BD-TPR3、BD-TPR4 和空载体BD 分别转化酵母感受态AH-109,涂布于-Trp 培养基上,30 ℃培养48 ~96 h。挑取BDZmMYB153、BD-TPL、BD-TPR1、BD-TPR2、BD-TPR3、BD-TPR4 和BD 的酵母菌落, 接种于5 mL 的-Trp 液体培养基中,30 ℃ 200 r/min 震荡培养24 h,定量点于-Trp 和-Trp/-His 培养基上,30 ℃培养2 ~3 d。依据菌落生长情况,判定ZmMYB153、TPL/TPRs 的自激活活性。
1.5 ZmMYB153 与TPL/TPRs 的酵母双杂交
将4 μL AD-ZmMYB153 质粒分别与4 μL 的BD-TPL、BD-TPR1、BD-TPR2、BD-TPR3 和BDTPR4 质粒组合,以及4 μL BD-ZmMYB153 质粒分别与4 μL AD-TPL、AD-TPR1、AD-TPR2、ADTPR3 和AD-TPR4 质粒组合,同时设对照组合ADZmMYB153+BD、AD+BD-TPL、AD+BD-TPR1、AD+BD-TPR2、AD+BD-TPR3、AD+BD-TPR4、BD-ZmMYB153+AD、BD+AD-TPL、BD+ADTPR1、BD+AD-TPR2、BD+AD-TPR3、BD+ADTPR4 和BD+AD,将各个组合分别转入酵母细胞。将酵母细胞涂布在-Leu/-Trp 固体培养基上,30 ℃培养2 ~3 d 直至长出酵母克隆。挑取双缺培养基上生长较好的酵母单克隆震荡培养至OD600为0.2,然后将原菌液稀释10 倍和100 倍,各吸取5 μL 置于-Leu/-Trp、-Leu/-Trp/-His 和-Leu/-Trp/-His+3-AT培养基上,30 ℃继续培养2 ~3 d 观察酵母生长情况。
1.6 EAR 突变对ZmMYB153 与TPL/TPRs 互作的影响
利用同样的方法,将ZmMYB153-mEAR 与上述发生互作的TPR2 质粒组合,转化酵母感受态细胞,同时设ZmMYB153 与其互作的TPR2 组合为阳性对照设置以及相对应的阴性对照组合,观察各组合的酵母菌落在-Leu/-Trp、-Leu/-Trp/-His 和-Leu/-Trp/-His+3-AT 培养基上的生长情况。
2 结果与分析
2.1 ZmMYB153 和ZmMYB153-mEAR 酵母双杂交载体的构建
根据图1 的设计, 使用ZmMYB153 及ZmMYB153-mEAR 的特异性上下游引物扩增得到ZmMYB153(1 038 bp)和ZmMYB153-mEAR(1 014 bp) 的基因片段,与入门载体pBM27 连接,获得其入门载体ZmMYB153-pBM27 和ZmMYB153-mEAR-pBM27,并将其分别与目标载体PGBKT7 和PGADT7 进行重组反应,菌落PCR 鉴定均获得了目的条带(图1)。经测序鉴定后获得目的载体ADZmMYB153、BD-ZmMYB153、AD-ZmMYB153-mEAR 和BD-ZmMYB153-mEAR。

图1 ZmMYB153 和ZmMYB153-mEAR 酵母双杂交 载体的构建Fig.1 Vector construction of ZmMYB153 and ZmMYB153-mEAR
2.2 TPL/TPRs 酵母双杂交载体的构建
利用TPL/TPRs 特异性上下游引物扩增得到TPL (1 032 bp)、TPR1(1 029 bp)、TPR2(1 005 bp)、 TPR3(1 005 bp)和TPR4(1 032 bp)的基因片段, 与入门载体pBM27 连接,获得这些基因的入门载体 TPL-pBM27、TPR1-pBM27、TPR2-pBM27、TPR3-pBM27 和TPR4-pBM27。将这些基因的入门载体分别与目标载体PGADT7 和PGBKT7 重组,菌落PCR 鉴定均获得了目的条带(图2)。经测序鉴定后获得目的基因的酵母双杂交载体AD-TPL、BD-TPL、AD-TPR1、BD-TPR1、AD-TPR2、BDTPR2、AD-TPR3、BD-TPR3、AD-TPR4 和BDTPR4。
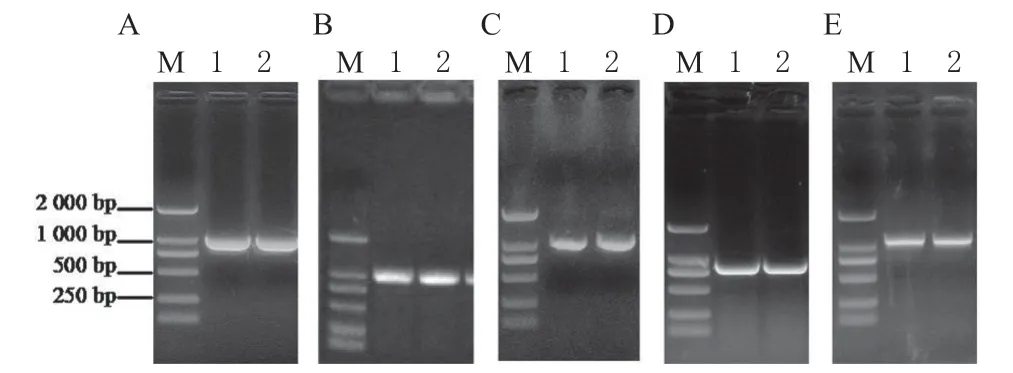
图2 TPL/TPRs 酵母双杂交载体的构建Fig.2 Vector construction of TPL/TPRs
2.3 ZmMYB153 和TPL/TPRs 的自激活活性检测
对ZmMYB153、TPL/TPRs 的自激活活性检测,结果发现,转化了BD-ZmMYB153、BD-TPL、BDTPR1、BD-TPR2、BD-TPR3、BD-TPR4 和 空 载体BD 的酵母均能够在-Trp 培养基上生长良好,转化了BD-TPR2 和BD-TPR4 的酵母均能够在-Trp/-His 和-Trp/-His+x-α-gal 的培养基上生长良好,且在-Trp/-His+x-α-gal 的培养基上显蓝色,说明BDTPR2 和BD-TPR4 有自激活活性(见图3)。
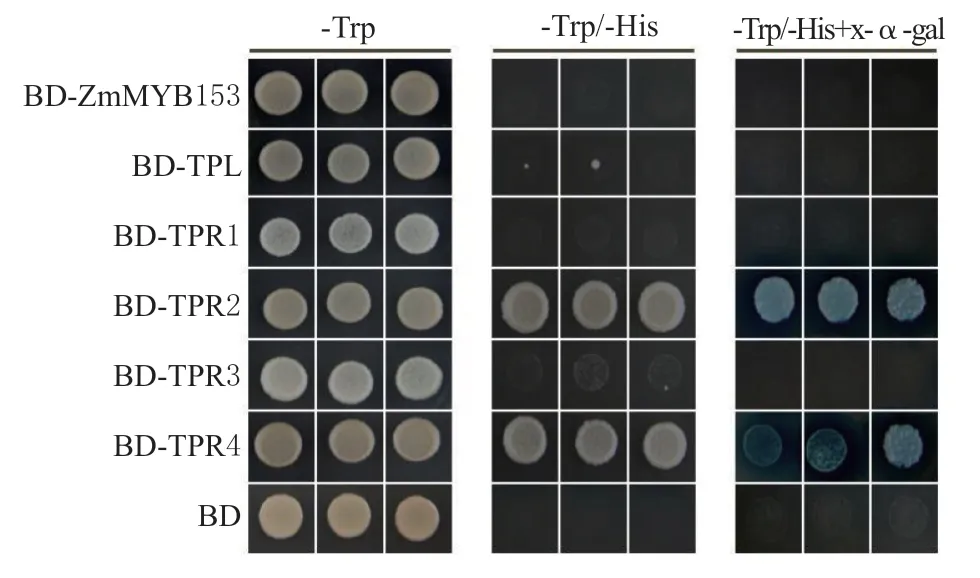
图3 ZmMYB153、TPL/TPRs 的自激活活性检测Fig.3 Self-activation activity of ZmMYB153 and TPL/TPRs
2.4 ZmMYB153 与TPL/TPRs 的酵母双杂交互作鉴定
利用酵母双杂交技术,检测ZmMYB153 与TPL/TPRs 蛋白之间的互作关系,结果发现,共同转化AD-ZmMYB153+BD-TPR2、BD-ZmMYB153+ AD-TPR2 组合的酵母菌落在-Lue/-Trp、-Lue/-Trp/ -His 和-Lue/-Trp/-His+3-AT (10 mmol/L) 培养基上均能正常生长;而共同转化AD-ZmMYB153+BD -AtTPR4 组合的酵母菌落能够在-Leu/-Trp、-Leu/ -Trp/-His 培养基上均能正常生长,不能在-Lue/ -Trp/-His+3-AT (10 mmol/L)培养基上正常生长;其他组合的酵母菌落以及阴性对照组合的酵母菌落只能在-LT 培养基上正常生长,而不能在-Lue/-Trp/-His和-Lue/-Trp/-His+3-AT (10 mmol/L) 培养基上正常生长(图4)。表明ZmMYB153 与AtTPR2 在酵母细胞中能够直接互作。

图4 ZmMYB153 与TPL/TPRs 的酵母双杂交结果Fig.4 Yeast two-hybrid of ZmMYB153 and TPL/TPR
2.5 EAR 突变对ZmMYB153 与TPR2 互作的影响
利用酵母双杂交技术,检测EAR 突变对ZmMYB153 与TPR2 互作的影响,结果发现,与阳性对照相比,试验组合AD-ZmMYB153-mEAR+BDTPR2、BD-ZmMYB153-mEAR+AD-TPR2 的酵母菌落在-Lue/-Trp/-His+3-AT(10 mmol/L)的培养基上均未能生长(见图5)。表明ZmMYB153-mEAR 与AtTPR2 不互作,同时说明EAR 基序是ZmMYB153与AtTPR2 蛋白在酵母中互作的关键位点。
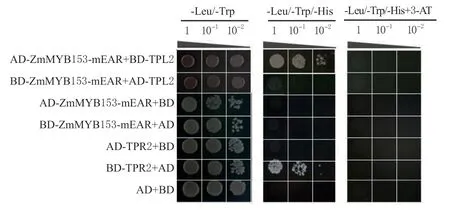
图5 EAR 突变对ZmMYB153 与TPR2 互作的影响Fig.5 Effect of EAR motif mutation on interaction between ZmMYB153 and TPR2
3 结论与讨论
R2R3-MYB 蛋白在植物中起到非常重要的作用,MYB44 属于R2R3-MYB 蛋白家族的第22 亚家族,现已明确AtMYB44 通过调节细胞分裂素和生长素相关基因的表达参与N-3-氧代-己酰-高丝氨酸内酯介导拟南芥的初级根生长[14];AtMYB44基因在植株干旱、低温和高盐等各种非生物胁迫下被活化表达,从而增强植物的抗逆性[9,15];AtMYB44与ABA 受体PYR1-LIKE8(PYL8)的相互作用还介导叶片衰老过程并对外界的刺激和伤害作出反 应[16]。此外,在甘蓝型油菜中发现BnMYB44 可能有助于甘蓝型油菜抵抗干旱和盐胁迫,StMYB44通过抑制马铃薯中PHOSPHATE1 的表达来负调节磷酸盐转运,促进植物吸收无机磷酸盐(Pi)以满足植物各种结构和生理功能对磷的需求[17-18]。
在拟南芥中,AtMYB44 与TPL/TPRs 蛋白家族中的TPR1 和TPR3 有相互作用的关系,参与调控拟南芥种子发育、抵抗PstDC3000、灰葡萄孢和蚜虫等生物胁迫过程以及对干旱、低温和高盐等非生物胁迫的多种过程,其主要机制是LSLSL 型乙烯反应元件结合因子相关的两亲抑制基序(EAR)介导的基因转录[19]。在拟南芥中证明了EAR 阻遏物通过招募染色质重塑因子的模型(通过募集染色质修饰剂实现EAR 介导的抑制模型),促进基因表达的表观遗传调控。生物信息学分析发现AtMYB44 与ZmMYB153 同源,但其与TPL/TPRs 之间的互作关系及其在玉米中的调控机制尚未明确。本研究结果为阐明ZmMYB153 在玉米生长、发育和抵抗生物、非生物胁迫中的功能和调控机制奠定基础。
植物转录辅抑制因子TPL/TPRs 家族蛋白调节多种过程中的基因表达,在水稻中LxLxL 类型EAR基序以疏水键为主要作用结合OsTPR2 的TPD 单体的CTLH 口袋[20-23]。TPL/TPRs 家族蛋白N 末端含有LisH 和CTLH 结构域,而LisH 和CTLH 结构域已被证明能促进蛋白质-蛋白质相互作用,它可能在结合伴侣蛋白中起共同作用[24]。乙酰基转移酶PopP2 通过假定的EAR 基序,可与对茄形青枯菌(Pseudomonas solanacearum)具有抗性的免疫受体RRS1 DNA 结合域结合并对其进行乙酰化,导致RRS1-DNA 结合减少,从而激活植物的免疫 力[25]。此外,EAR 阻遏物的功能可能与磷酸化和泛素化有关[20]。本研究初步确定了ZmMYB153 与TPL/TPRs 之间的相互作用,推测ZmMYB153 通过自身的LSLSL 型EAR 基序招募TPL/TPRs 家族中一些蛋白的LisH 或CTLH 结构域,形成复合体,从而抑制相关基因的表达,进一步参与玉米生长发育以及响应生物和非生物胁迫过程。本试验将对ZmMYB153 调控的靶基因及其调控机制进行深入研究,为阐明ZmMYB153 在玉米生长、发育和抵抗生物、非生物胁迫中的功能和调控机制奠定基础。
