集胞藻酰基载体蛋白基因过量表达对脂肪酸合成的影响
2020-07-28路晓媛钟怀荣夏志洁曹月蕾戴美学
路晓媛,钟怀荣,夏志洁,曹月蕾,陈 高,*,戴美学,*
(1.山东师范大学 生命科学学院,山东 济南 250014;2.山东省农业科学院 生物技术研究中心,山东 济南 250100)
目前,随着人们生活水平的提高,人们对于油脂的需求量也越来越高。通过动植物生产的油脂仍无法满足人们对不饱和脂肪酸的需求。化石燃料的急剧消耗造成环境污染、资源枯竭等问题。目前已有的生物能源如乙醇,虽然能部分替代化石燃料,但需要消耗大量的耕地和水资源[1]。研究发现,微藻油的成分与植物油的成分相似。近年来,微藻产生物柴油引起各国的广泛关注[2]。
蓝藻是地球上出现最早的光合自养原核生物,能进行产氧光合作用,是最重要的原初生产者之一,能适应多种环境[3]。集胞藻PCC6803(Synechocystissp. PCC6803)是一类球形的非固氮型单细胞蓝藻,在淡水中生活,具有生长快、培养条件较简单、不产毒素、细胞的结构较简单、便于分子操作等特点,是理想的蓝藻基因工程的受体,于1996年完成基因组测序[4]。
如何提高微藻中的脂肪酸含量已成为广泛研究的热点[5]。在众多方法中,基因工程手段已被证明是一种非常有效的方法而受到世界各国科学家的青睐,有关微藻脂肪酸代谢相关的基因工程研究仍处在起步阶段[6-10]。DNA芯片分析结果证明,集胞藻PCC6803中许多基因的表达受温度的调控,如脂肪酸脱饱和酶基因desA、desB等在低温下表达量上调,致使膜脂不饱和程度和流动性增加[11]。同时,当微藻在低温胁迫条件下生长时,细胞分裂速率下降,细胞生长变得缓慢,新物质的合成会逐渐停止,但脂肪酸的合成得以持续并积累以作为一种保护机制[12]。在微藻中将基因工程和生化调控两者相结合研究,也许微藻的脂肪酸积累会产生更好的效果。
在微藻脂肪酸代谢途径中,丙酮酸在丙酮酸脱氢酶复合体(pdh)的催化下氧化脱羧形成乙酰辅酶A(acetyl-CoA),乙酰辅酶A在乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACCase)的催化下生成丙二酰辅酶A(malonyl-CoA)。丙二酰辅酶A在丙二酰CoA酰基载体蛋白转移酶催化下,与酰基载体蛋白(acyl carrier protein,ACP)结合,生成丙二酰-ACP(malonyl-ACP)作为脂肪酸延长过程中碳链的供体。在脂肪酸合成酶(Fas)的作用下,malony-ACP经过一系列反应,最终能形成不饱和脂肪酸(PUFAs)(图1)[13]。

图1 集胞藻PCC6803脂肪酸的合成途径Fig.1 Fatty acid synthesis pathway of Synechocystis sp. PCC6803
酰基载体蛋白是一类具有保守丝氨酸残基的小分子质量(9 ku)酸性蛋白,在脂肪酸合成过程中,ACP携带酰基链完成缩合、还原和脱氢等酶促反应。它是不同酰基链长度脂肪酸的acyl-ACP去饱和反应和质体类酰基转移酶作用的辅助因子[14]。目前在集胞藻PCC6803中ACP和脂肪酸合成之间的关系还未有报道。本研究利用同源重组技术在集胞藻PCC6803中对ACP基因(ssl2084)进行过量表达研究,同时选取20 ℃作为低温胁迫条件对获得的突变藻株分别在20 ℃和30 ℃条件下培养。通过气相色谱—质谱联用技术(GC-MS)检测分析脂肪酸的含量及组分,拟分析不同温度对过表达ssl2084突变株脂肪酸合成的影响,探索该基因在脂肪酸代谢途径中的作用。
1 材料与方法
1.1 材料
集胞藻PCC6803藻株、大肠埃希菌DH5α和p5ST1T2(pBluescriptⅡSK+5sT1T2)载体(本实验室保存)。分子生物学工具酶(TaKaRa公司,日本);壮观霉素、抗His标签抗体、羊抗兔血清IgG(Sigma公司,美国),琼脂糖凝胶纯化回收试剂盒、DNA提取试剂盒及质粒提取试剂盒(QIAGEN公司,德国);其他试剂均为分析纯。从Cyanobase数据库获取基因序列(http://genome.microbedb.jp/cyanobase/Synechocystis)并设计PCR引物,由北京鼎国生物公司合成,PCR引物序列见表1。测序工作由山东省农业科学院生物技术中心测序中心完成。集胞藻PCC6803和转基因藻在BG-11培养基中、30 ℃、50 μmol·m-2·s-1连续光照条件下静置培养[15]。

表1 引物列表
1.2 方法
1.2.1 同源重组平台p5S1285UD的构建
同源重组平台p5S1285UD的构建图谱见图2(A)。(1)以集胞藻PCC6803的基因组DNA为模板,以slr1285U-KpnⅠ-F和slr1285U-KpnⅠ-R、slr1285D-SacⅠ-F和slr1285D-SacⅠ-R为引物对,PCR分别得到同源重组上游臂slr1285U和同源重组下游臂slr1285D,电泳后回收目的片段;(2)用KpnⅠ内切酶酶切slr1285U片段,与同样经KpnⅠ内切酶酶切的质粒p5ST1T2用T4连接酶连接,连接产物转化大肠埃希菌DH5α,菌落PCR筛选阳性克隆后,用质粒提取试剂盒制得质粒p5ST1T2-slr1285U(简称p5S1285U);(3)用SacⅠ内切酶酶切的slr1285D基因片段,与同样经SacⅠ内切酶酶切的质粒p5S1285U连接,通过筛选阳性克隆制得质粒p5ST1T2-slr1285UD(简称p5S1285UD),送生物技术中心测序中心进行测序验证。
1.2.2 转集胞藻PCC6803同源重组质粒ssl2084(+)的构建
为了研究酰基载体蛋白(ssl2084,GenBank:CP028094)在集胞藻PCC6803脂肪酸代谢途径中的作用,首先构建了用于ssl2084基因过表达的载体ssl2084(+)。通过同源重组,质粒ssl2084(+)携带的Pcpc560启动子驱动的ssl2084基因表达元件将插入到集胞藻PCC6803的slr1285中性位点,实现该基因过表达。同源重组载体ssl2084(+)的构建图谱见图2-B、C。(1)以集胞藻PCC6803的基因组DNA为模板,以Pcpc560-SalⅠ-F/Pcpc560-R和ssl2084-fPcpc-F/ssl2084-EcoRⅠ-His-R(在3′端加入一个His标签)为引物对,PCR得到分别带有SalⅠ和EcoRⅠ酶切位点的Pcpc560启动子和ssl2084片段。(2)以引物对Pcpc560-SalⅠ-F和ssl2084-EcoRⅠ-His-R将Pcpc560启动子和ssl2084基因片段融合得到Pssl2084片段;(3)用SalⅠ、EcoRⅠ酶切,与经同样酶切的质粒p5S1285UD连接,转化大肠埃希菌DH5α后筛选阳性克隆,制得质粒slr1285UD+Pssl2084。(4)将质粒p5S1285UD+Pssl2084用SmaⅠ单酶切,与经DraⅠ单酶切的壮观霉素抗性片段(Spe)连接,通过筛选阳性克隆,制得质粒p5S1285UD+Pssl2084+spe(简称ssl2084(+)),即完成了转集胞藻PCC6803表达载体的构建。
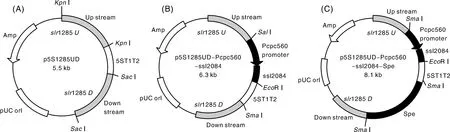
A,将上游臂slr1285U和下游臂slr1285D克隆到p5ST1T2质粒中构成同源重组平台p5S1285UD;B,将启动子Pcpc560与ssl2084基因融合后克隆到p5S1285UD质粒中;C,将壮观霉素抗性片段克隆到B质粒中构成同源重组质粒ssl2084(+)。A,The upstream slr1285U and downstream slr1285D were cloned into the p5ST1T2 plasmid to form homologous recombination platform p5S1285UD; B,The fusion product of the promoter Pcpc560 and the ssl2084 gene was cloned into the p5S1285UD plasmid; C,The spectinomycin-resistant fragment was cloned into the B plasmid to constitute the homologous recombinant plasmid ssl2084(+).图2 同源重组平台p5S1285UD和同源重组质粒ssl2084(+)的构建图谱Fig.2 Construction map of homologous recombination platform p5S1285UD and homologous recombination plasmid ssl2084(+)
1.2.3 集胞藻PCC6803的自然转化及转化子的筛选
集胞藻PCC6803的自然转化参见文献[16],略有改动。离心收集对数生长期的藻细胞(D730=0.6~0.8),用新鲜的BG-11液体培养基洗涤后重悬。在1 mL藻液中加入20 μL同源重组载体ssl2084(+),弱光下温育6 h后将混合液均匀涂在放置有混合纤维酯膜的BG-11平板上。24 h后将混合纤维酯膜放于含终浓度50 μg·mL-1壮观霉素(Spe)的BG-11平板上。在30 ℃、50 μmol·m-2·s-1条件下培养,1~2周左右长出集胞藻转化子。挑取单菌落在含有壮观霉素的BG-11平板上连续继代筛选,最终将转化子于BG-11(Spe,50 μg·mL-1)液体培养基中扩大培养,为下一步分子鉴定做准备。
1.2.4 突变株的DNA水平鉴定
为证明ssl2084基因在集胞藻PCC6803中过表达,在DNA水平和蛋白质水平对突变株进行进一步鉴定。分别以野生型集胞藻PCC6803和ssl2084过表达突变株(以下简称ssl2084(+)突变株)的基因组DNA为模板,用以下引物对进行扩增:Pcpc560-SalI-F和ssl2084-EcoRⅠ-His-R、Pcpc560-SalⅠ-F和T1T2-R、slr1285U-KpnⅠ-F和ssl2084-EcoRⅠ-His-R、Pcpc560-SalⅠ-F和slr1285D-SacⅠ-R、slr1285U-KpnⅠ-F和slr1285D-SacⅠ-R,通过扩增出的DNA片段大小对突变株进行DNA水平的鉴定。
1.2.5 突变株的蛋白质水平鉴定
分别离心收集对数生长期的野生型和突变株藻细胞,用Tris-HCl(40 mmol·L-1,pH 8.0)重悬藻细胞,并加入蛋白酶抑制剂PMSF(0.1 mol·L-1)至终浓度为1 mmol·L-1。藻细胞在冰浴中超声破碎后离心,吸取上清,即得到藻细胞总蛋白[17]。蛋白浓度的测定方法参照文献[18]。根据标准方法[19]进行Western blot,将蛋白质上清经12%的SDS-PAGE胶电泳后恒流转移至PVDF膜上,用5%脱脂奶粉室温封闭1 h,弃封闭液,用一抗(His-tag)室温孵育1 h,TBST洗膜3次,二抗(羊抗兔血清IgG)室温孵育1 h,TBST洗膜3次,TBS洗膜1次后利用ECL化学发光检测试剂显色,用凝胶成像仪(Chemi Doc XRS+,美国)曝光成像。
1.2.6 生长曲线测定
挑取突变株和野生型集胞藻于液体BG-11培养基中培养至对数期,调节初始接种浓度一致,后分别置于30 ℃和20 ℃,在50 μmol·m-2·s-1连续光照条件下培养。每隔24 h取一次样,通过紫外可见分光光度计(Tu-1810,北京)测定D730值,检测藻株在不同温度下的生长情况,实验组和对照组各设置3个平行。
1.2.7 脂质的提取和脂肪酸的组成及含量分析
分别收集在20 ℃和30 ℃培养的集胞藻PCC6803和转基因藻,离心沉淀并经真空冷冻干燥仪(YTP550-4F16A,荷兰)干燥后获得藻粉。准确称取200 mg藻粉,液氮研磨破碎藻细胞后用甲醇—氯仿(体积比2∶1)超声提取,离心分离后,残渣再加甲醇—氯仿提取,离心分离,保留有机相,重复2次;合并有机相提取液转移到分液漏斗中,加入氯仿和1%氯化钠溶液混匀,静置分层,回收下层;加2.5 mL氯仿于原上、中层溶液中再萃取一次,回收下层,重复2次;合并下层液,置于提脂瓶中,50 ℃氮气挥干溶剂至恒重,于天平称量得到总脂含量。将提取的总脂用氯仿溶于10 mL具塞试管中,加入5.0 mL 0.04 mol·L-1氢氧化钾—甲醇溶液混匀,置于60 ℃水浴中皂化1 h,每隔10 min振荡一次。将皂化好的样品取出冷却后加入4.0 mL盐酸—甲醇(体积比1∶9)溶液混匀,再加20.0 μL十九碳酸内标(1.5 mg·mL-1),在60 ℃水浴中甲酯化20 min,期间振荡一次;将甲酯化好的样品冷却后加入饱和食盐水3.0 mL,加入正己烷1.0 mL,充分振荡,静置,取正己烷层进行色谱分析。本文提供的数据是每个样本的3次实验的平均值。
2 结果与分析
2.1 同源重组平台p5S1285UD的构建
以提取的完整性较好,带形清晰且弥散少的集胞藻PCC6803基因组DNA为模板,进行后续PCR扩增实验。slr1285U与slr1285D基因的大小均为1 000 bp,经KpnⅠ内切酶酶切的质粒p5ST1T2大小为3 500 bp,经SacⅠ内切酶酶切的质粒p5S1285U大小为4 500 bp,由电泳图可以看出,片段与理论大小相符,是所需的目的条带(图3)。从大肠埃希菌感受态转化的平板上挑取阳性单克隆菌落,37 ℃,180 r·min-1条件下过夜摇菌,提取的质粒大小与预期相符。上述结果表明,同源重组平台p5S1285UD构建成功。同时,测序结果显示序列均无误,可用于后续实验。
2.2 转集胞藻PCC6803同源重组质粒ssl2084(+)的构建
Pcpc560基因的大小为560 bp,ssl2084基因的大小为260 bp。Pcpc560和ssl2084基因片段进行融合后的片段Pssl2084大小约为820 bp。用SalⅠ、EcoRⅠ对Pssl2084片段与p5S1285UD质粒双酶切、以SmaⅠ对p5S1285UD+Pssl2084的质粒单酶切均切出了相应的载体片段和目的片段(图4)。从大肠埃希菌感受态转化的平板上挑取阳性单克隆菌落,摇菌提取的质粒大小与预期相符。通过测序验证了其正确性,可用于下一步转化野生型集胞藻PCC6803。
2.3 集胞藻PCC6803的自然转化及转化子的筛选
通过自然转化法将同源重组质粒ssl2084(+)导入野生型集胞藻PCC6803中,利用壮观霉素对转化子进行筛选,待阳性转化子出现后,逐步增加平板上的抗生素浓度,进行传代培养,最终得到ssl2084(+)突变株(图5)。
2.4 转化子的PCR鉴定
分别以野生型集胞藻PCC6803和ssl2084(+)突变株的基因组DNA为模板,用以下引物对扩增:Pcpc560-SalⅠ-F和ssl2084-EcoRⅠ-His-R、Pcpc560-SalⅠ-F和T1T2-R、slr1285U-KpnⅠ-F和ssl2084-EcoRⅠ-His-R、Pcpc560-SalⅠ-F和slr1285D-SacⅠ-R,在突变株中扩增出预期的大小分别为0.8、1.3、1.8、4.1 kb的条带,而在野生型中没有扩增出条带。使用slr1285U-KpnⅠ-F和slr1285D-SacⅠ-R鉴定靶向整合,在突变株中扩增预期的5.1 kb片段,并在野生型中扩增2.0 kb片段(图6-B)。以上结果说明在DNA水平上已分离出了ssl2084(+)突变株。

A,Pcpc560与ssl2084基因融合PCR产物;B,p5S1285UD质粒双酶切图;C,p5S1285UD+Pssl2084质粒单酶切图;D,p5S1285UD+Pssl2084质粒和ssl2084(+)质粒电泳图。A,PCR product after fusion of Pcpc560 and ssl2084 gene; B,Double restriction map of p5S1285UD plasmid; C,Single restriction map of p5S1285UD+Pssl2084 plasmid; D,Electrophoresis map of p5S1285UD+Pssl2084 plasmid and ssl2084(+) plasmid.图4 同源重组质粒ssl2084(+)的构建Fig.4 Construction of homologous recombination plasmid ssl2084(+)

A,ssl2084(+)突变株平板单藻落;B,ssl2084(+)突变株在含50 μg·mL-1壮观霉素的BG-11平板上生长;C,ssl2084(+)突变株在含100 μg·mL-1壮观霉素的BG-11平板上生长;D,ssl2084(+)突变株在含150 μg·mL-1壮观霉素的BG-11平板上生长。A,Single colony of ssl2084(+) mutant strain; B,ssl2084(+) mutant grown on BG-11 plate containing 50 μg·mL-1 spectinomycin; C,ssl2084(+) mutant grown on BG-11 plate containing 100 μg·mL-1 spectinomycin; D,ssl2084(+) mutant grown on BG-11 plate containing 150 μg·mL-1 spectinomycin.图5 ssl2084(+)突变株的获得与筛选过程Fig.5 Acquisition and screening process of ssl2084(+) mutant strain
2.5 蛋白水平的鉴定
从集胞藻PCC6803和ssl2084(+)突变株中提取总蛋白,使用His标签抗体进行蛋白免疫印迹检测ssl2084基因的表达。结果显示,在ssl2084(+)突变株中出现一条相对分子质量约9 ku的条带,在野生型中未鉴定出该条带(图7)。说明ssl2084基因已在ssl2084(+)突变株中过量表达。综上所述,我们已成功得到了ssl2084过表达突变株。

A,同源重组质粒构建图谱ssl2084(+);B,ssl2084(+)突变株的PCR鉴定图。A,Construction map of homologous recombination plasmid ssl2084(+); B,PCR identification map of ssl2084(+) mutants.图6 ssl2084(+)突变株的DNA水平鉴定Fig.6 Identification of ssl2084(+) mutant at DNA level

图7 ssl2084(+)突变株的蛋白水平鉴定Fig.7 Identification of ssl2084(+) mutant at protein level
2.6 温度对过表达ssl2084突变株生长速率的影响
为检测过量表达ssl2084基因是否会对藻株的生长产生影响,我们将野生型和ssl2084(+)突变株置于30 ℃条件下培养。通过D730检测,发现ssl2084(+)突变株的生长趋势与野生型集胞藻相似,但与野生型相比,ssl2084(+)突变株的生长状态受到轻微限制(图8-A)。说明过量表达ssl2084基因没有对藻株的生长趋势产生明显的影响。
为检测温度对藻株生长状态的影响,将野生型和ssl2084(+)突变株置于20 ℃条件下培养。

A,30 ℃、50 μmol·m-2·s-1条件下的生长曲线;B,20 ℃、50 μmol·m-2·s-1条件下的生长曲线。A,Growth curves at 30 ℃,50 μmol·m-2·s-1;B,Growth curves at 20 ℃,50 μmol·m-2·s-1.图8 不同温度条件下野生型和ssl2084(+)突变株的生长曲线Fig.8 Growth curves of wild-type and ssl2084(+) mutants under different temperature conditions
ssl2084(+)突变株在第1~5天的生长速率略高于野生型,但之后的生长速率则低于野生型,但并没有出现显著的差异。野生型和ssl2084(+)突变株在20 ℃条件下的生长速率均明显低于30 ℃条件下的生长速率(图8-B)。说明低温对藻株的生长均产生了限制影响,但ssl2084(+)突变株对低温的响应可能比野生型更为敏感。
2.7 温度对过表达ssl2084突变株脂肪酸含量及组分的影响
为了进一步检测温度对ssl2084(+)突变株脂肪酸含量的影响,我们通过GC-MS分析了ssl2084(+)突变株在常温30 ℃和低温20 ℃培养条件下的脂肪酸含量及组分。结果表明,在30 ℃培养条件下,ssl2084(+)突变株产生的总脂肪酸含量(TFA)为(24.41±0.95)mg·g-1,是野生型的1.5倍。同时ssl2084(+)突变株中C12:0、C16:0和C18:0的含量显著增加,分别为1.50、8.74和0.60 mg·g-1,与野生型相比分别增加了54.71%、50.82%和155.86%。ssl2084(+)突变株中C11:0含量为2.10 mg·g-1,与野生型相比降低了124.41%(图9-A)。以上结果表明,在集胞藻PCC6803中过表达ssl2084基因能提高总脂肪酸中的中长链脂肪酸的含量。
在20 ℃培养条件下,ssl2084(+)突变株中总脂肪酸含量为(31.26±1.93)mg·g-1,含量低于相同条件下野生型产生的总脂肪酸。在此条件下C11:0、C12:0、C16:0和C18:0含量与30 ℃培养条件下的趋势一致。在20 ℃培养条件下ssl2084(+)突变株中C12:0、C16:0和C18:0分别达到1.70、11.85和2.31 mg·g-1,与野生型相比分别提高了31.94%、47.35%和39.90%。ssl2084(+)突变株的C11:0含量为6.37 mg·g-1,与野生型相比降低了17.89%(图9-B)。说明ssl2084(+)突变株在低温胁迫条件下,总脂肪酸及C12:0、C16:0和C18:0的含量得到进一步提高。以上结果表明,低温促进了ssl2084(+)突变株中短链脂肪酸向中长链脂肪酸的转化,使集胞藻产生更多的中长链脂肪酸。
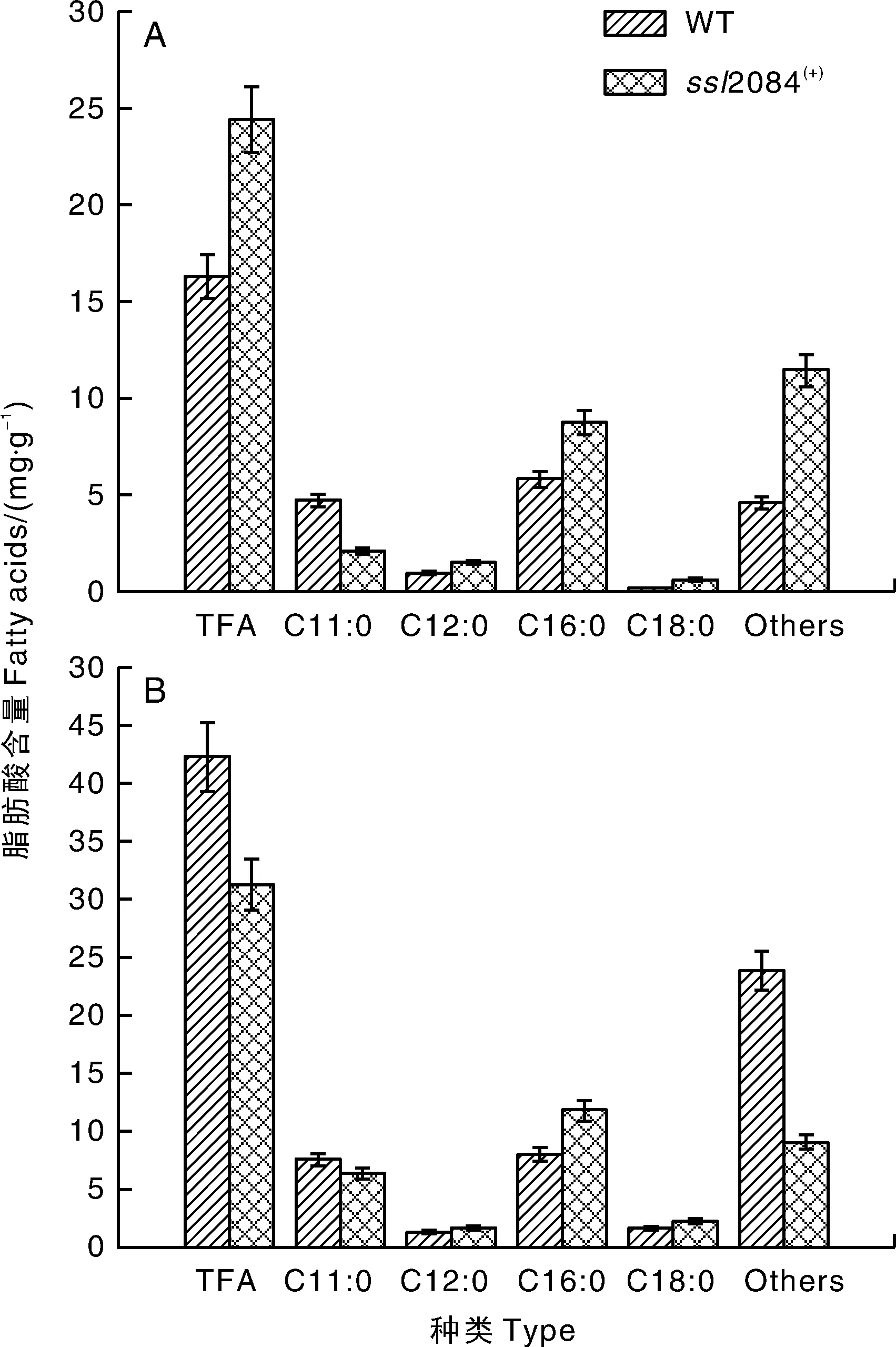
A,30 ℃、50 μmol·m-2·s-1条件下的脂肪酸含量;B,20 ℃、50 μmol·m-2·s-1条件下的脂肪酸含量。A,Fatty acid content at 30 ℃,50 μmol·m-2·s-1; B,Fatty acid content at 20 ℃,50 μmol·m-2·s-1.图9 不同温度条件下野生型和ssl2084(+)突变株的脂肪酸含量Fig.9 Fatty acid content of wild type and ssl2084(+) mutants under different temperature conditions
3 讨论
微藻中脂肪酸代谢是一个重要的代谢途径,酰基载体蛋白位于脂肪酸代谢途径的中心,在脂肪酸链延长和还原循环中,ACP作为一个必要的关键蛋白,能够结合酰基链并将其转运到不同酶的活性位点[20],其能够与脂肪酸代谢途径中各种蛋白包括FabB、FabZ等发生相互作用[21-23]。研究表明,ACP不仅参与脂肪酸合成,还参与脂肪酸的不饱和反应[24-25];ACP能够依靠串联ACP形成的四元结构增强催化效果,提高不饱和脂肪酸的产量[26];将ACP的疏水残基用色氨酸替代可改变细胞内脂质组成,增加细胞内中链脂肪酸的含量[20]。
蓝细菌具有基因组相对简单,基因操作方便及生长快等优点,在基础研究及开发利用领域均有广阔前景。尽管生物体脂肪酸合成途径已相对清楚,但蓝藻脂肪酸合成的调控与积累机制研究基本空白,在集胞藻中还没有有关ACP的报道。集胞藻PCC6803作为蓝细菌的代表物种,是第一个完成基因组测序的光能自养微生物,作为模式生物受到广泛研究。
本研究构建了同源重组质粒ssl2084(+)后在集胞藻PCC6803中转化。通过基因组PCR及Western blot证实ssl2084基因在集胞藻PCC6803中过表达。通过GC-MS测量不同温度对ssl2084基因过表达突变株脂肪酸含量和组分的影响,结果表明,ssl2084(+)突变株在30 ℃时能提高总脂肪酸及C12:0、C16:0和C18:0的含量,同时降低C11:0的含量。推测ssl2084基因的过表达,促进了短链脂肪酸向中长链脂肪酸的转化。当温度降低为20 ℃时,ssl2084(+)突变株中C12:0、C16:0和C18:0的含量进一步提高,说明低温促进了该转化的进一步提高,但该转化和调控机制值得进一步细致的研究。
本研究采用基因工程手段和代谢调控手段相结合的方法有效地提高了集胞藻PCC6803中总脂肪酸和中长链脂肪酸C12:0、C16:0和C18:0的含量,为进一步生产生物柴油和多不饱和脂肪酸提供了基础材料,为微藻脂肪酸积累提供了有价值的参考。
