慢性阻塞性肺疾病合并肺曲霉病危险因素的Meta分析
2020-07-27李迪婧胡良安张丹
李迪婧 胡良安 张丹
摘要:目的 探讨慢性阻塞性肺疾病患者发生肺曲霉病的危险因素,为慢阻肺患者制定临床管理策略提供依据。方法 检索中文数据库中国知网(CNKI)、维普(VIP)、万方,英文数据库PubMed、Embase、Cochrane Library 2000年6月1日~2019年6月1日公开发表的慢性阻塞性肺疾病发生肺曲霉病相关因素的研究文献,参照Wells等制定的文献质量评价量表(NOS)对文献进行质量评价,利用Revman5.3、Stata15软件进行Meta分析。结果 共纳入文献25篇,均为病例对照研究,其中英文8篇,中文17篇,病例组995例、对照组3117例。Meta分析显示:吸烟史、住院天数、入住ICU、机械通气、侵入性操作、使用糖皮质激素、使用抗生素、GOLD Ⅲ~Ⅳ级、糖尿病、真菌定植或既往感染、低蛋白血症、APACHⅡ评分高是慢性阻塞性肺疾病患者发生肺曲霉病的危险因素。结论 慢性阻塞性肺疾病患者發生肺曲霉病是多种危险因素共同作用的结果,与患者的治疗方式、既往病史、合并症等密切相关,但由于客观因素限制,部分结果可能仍存在偏倚,还需进一步研究验证。
关键词:肺疾病;慢性阻塞性;肺曲霉病;危险因素
中图分类号:R563 文献标识码:A DOI:10.3969/j.issn.1006-1959.2020.13.019
文章编号:1006-1959(2020)13-0069-08
Meta-analysis of Risk Factors for Chronic Obstructive Pulmonary
Disease Complicated with Pulmonary Aspergillosis
LI Di-jing,HU Liang-an,ZHANG Dan
(Department of Respiratory and Critical Care Medicine,the First Affiliated Hospital of Chongqing Medical University,
Chongqing 400016,China)
Abstract:Objective To systematically evaluate the risk factors of pulmonary aspergillosis in patients with chronic obstructive pulmonary disease (COPD) and provide the basis for clinical management strategies of COPD patients.Methods SearchingChinese databases(CNKI,VIP and Wangfang) and English databases(PubMed,Embase and Cochrane Library) to collect the case-control studies on the risk factors of pulmonary aspergillosis in COPD from June 1, 2000 to June 1, 2019.According to the Newcastle-Ottawa scale(NOS) developed by Wells and etc, the quality of the documents was assessed. Then meta-analysis was performed with Revman 5.3 and stata15 software.Results A total of 25 articles were included, all of which were case-control studies, including 8 in English and 17 in Chinese, with 995 cases in the case group and 3117 cases in the control group. Meta analysis showed: smoking history, length of hospital stay, stay in ICU, mechanical ventilation, invasive procedures, use of glucocorticoids, use of antibiotics, GOLD Ⅲ~Ⅳ, diabetes, fungal colonization or previous infection, hypoproteinemia, high APACH Ⅱ score it is a risk factor for pulmonary aspergillosis in patients with chronic obstructive pulmonary disease.Conclusion The occurrence of pulmonary aspergillosis in patients with chronic obstructive pulmonary disease is a result of a combination of multiple risk factors, which is closely related to the patient's treatment, past medical history, and comorbidities. However, due to the limitations of objective factors, some results may still be biased need further research and verification.
Key words:Pulmonary disease;Chronic obstructive;Pulmonary aspergillosis;Risk factors
据报道[1,2],慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)患者肺曲霉病(pulmonary aspergillosis,PA)发病率呈逐年升高趋势,COPD已成为PA的第3位易患因素,且COPD合并PA病死率明显高于普通COPD患者,高达50%~100%[3]。COPD患者对曲霉菌易感性的病因复杂,其相关因素的研究尚存在争议。基于此,本研究通过收集2000年6月1日~2019年6月1日国内外公开发表的关于COPD发生PA相关因素的研究文献进行综合评价,探讨COPD患者发生PA的主要危险因素,以期为临床诊治、预防提供理论依据,现报道如下。
1资料与方法
1.1资料来源和检索策略 通过计算机检索中文数据库中国知网(CNKI)、维普(VIP)、万方及英文数据库PubMed、Embase、Cochrane Library和文献追溯等方法,收集2000年6月1日~2019年6月1日国内外公开发表的关于COPD发生PA相关因素的研究文献。检索语种包括中文和英文。采用主题词和关键词相结合的检测方法,中文检索:(“慢性阻塞性肺疾病”OR“肺疾病、慢性阻塞性”)AND(“曲霉菌感染”OR“肺曲霉病”OR“侵袭性肺曲霉病”),英文检索:(“Pulmonary Disease,Chronic Obstructive”OR“COPD”OR“Chronic Obstructive Pulmonary Disease”OR“Chronic Obstructive Airway Disease”OR“Chronic Obstructive Lung Disease”)AND(“Aspergillosis”OR“Invasive Pulmonary Aspergillosis”OR“Pulmonary Aspergillosis”OR”Aspergillosis,Allergic Bronchopulmonary”)。
1.2纳入及排除标准
1.2.1纳入标准 ①国内外发表的关于慢性阻塞性肺疾病合并肺曲霉病危险因素的病例对照研究的原始文献;②文献对慢性阻塞性肺疾病的诊断符合《慢性阻塞性肺疾病诊治指南》的诊断标准;③文献对肺曲霉病的诊断标准基本一致,主要根据临床症状、体征、影像学、微生物学、组织病理学及宿主因素;④文献研究假设和研究方法类似,暴露的定义基本相似;⑤提供优势比(OR)及95%置信区间(CI),或可以通过计算补全;⑥关于某相关因素的研究文献应大于2篇以上。
1.2.2排除标准 ①同一样本重复文献;②无对照文献;③研究方法不准确,数据资料不完整或明显错误文献;④参照Wells等制定的文献质量评价量表(Newcastle-Ottawa scale,NOS)标准,小于5颗星的低质量文献;⑤病例组未区分PA和其他类型的真菌感染。
1.3资料提取 ①纳入研究的一般资料:标题、作者姓名、发表日期、发表期刊、国别、文献质量;②研究特征:研究类型、样本量、受试者特征及相关因素暴露情况。
1.4统计学分析 采用RevMan 5.3软件进行异质性和敏感性分析。①異质性分析:采用Cochranes Q检验和I2定量分析,若P>0.05,I2<50%,可认为多个同类研究具有同质性,则选用固定效应模型进行分析;若P<0.05,I2≥50%,但仅有统计学异质性,而临床上判断各研究间具有一致性需要进行合并时,则选择随机效应模型,对不能进行合并分析的数据进行描述性分析。对连续性资料可采用加权均数差(WMD)或标准化均数差(SMD)进行分析;对分类资料采用OR值。所有分析均需计算其95%CI。②敏感性分析:分别应用随机效应模型与固定效应模型计算进行比较,若研究间存在异质性,排查低质量研究,观察合并效应量的变化,并根据单因素和多因素两种数据类型进行分层分析。③偏倚分析:采用Stata15软件进行发表偏倚分析,合并研究不低于5个,采用线性回归法(EggerS test);合并研究低于5个,采用剪补法或失安全系数法。
2结果
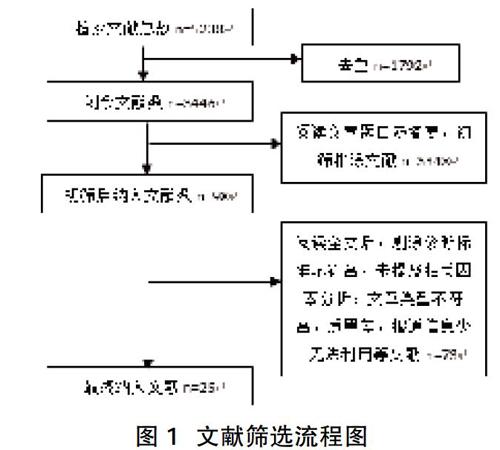
2.1文献筛选结果 检索文献总数5238篇,根据纳入及排除标准最后纳入文献25篇,见图1。
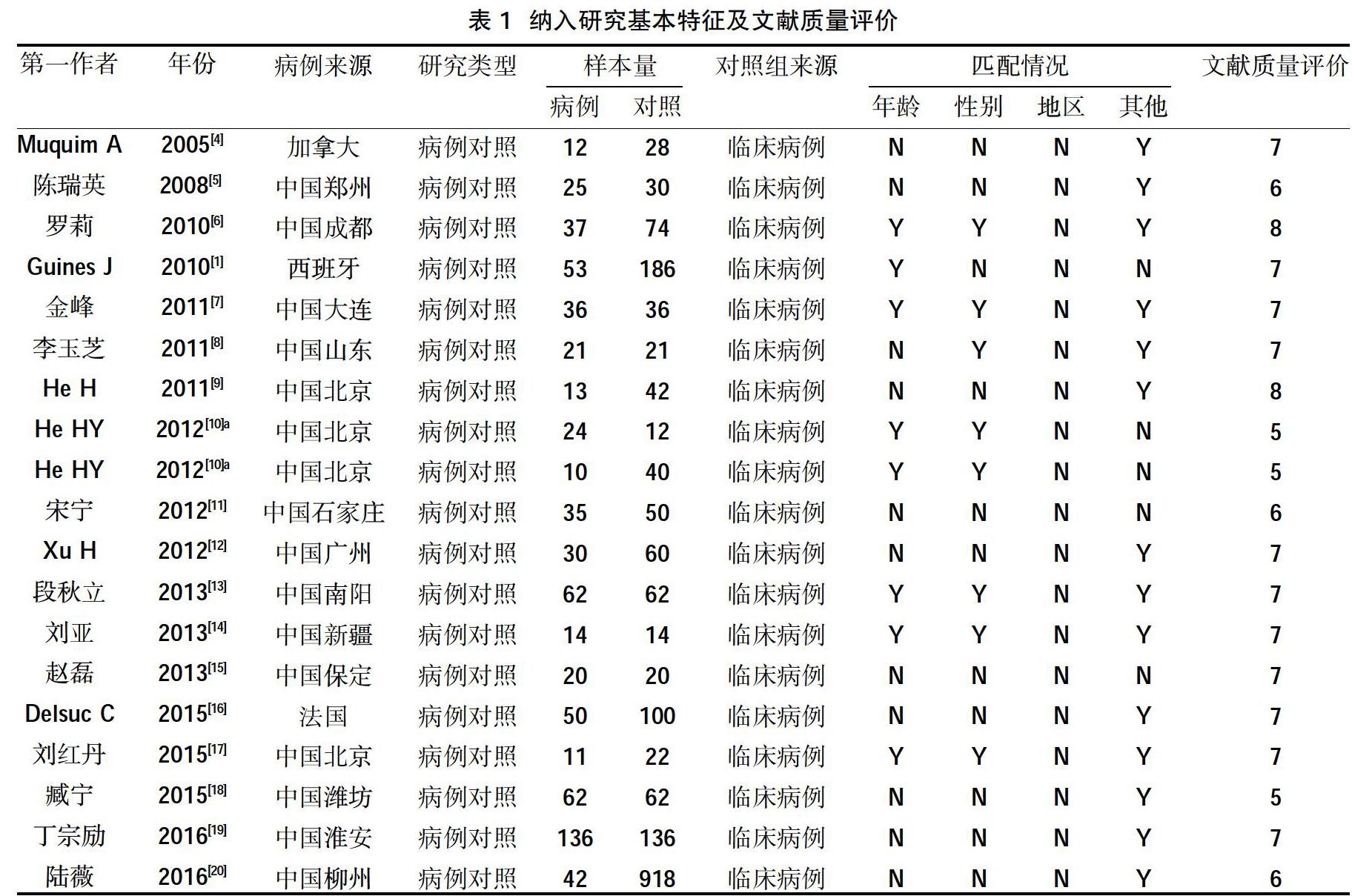
2.2纳入研究基本特征 25篇文献均为病例对照研究,其中英文8篇,中文17篇,累计病例组995例、对照组3117例,对照组来源均为临床病例,文献基本特征见表1。
2.3纳入相关因素及敏感性分析 根据文献内容及可参考的文献数,选择纳入以下相关因素:性别、年龄、吸烟史、烟龄、住院天数、住院次数、急性加重期、入住重症监护室(intensive care unit,ICU)、一秒用力呼气容积占预计值百分比(forced expiratory volume in one second predicted,FEV1%)、GOLDⅢ~Ⅳ级、合并症(呼吸衰竭、糖尿病、心血管疾病、肝肾功能不全、非血液系统肿瘤、低蛋白血症)、真菌定植或既往感染史、使用糖皮质激素类型及剂量、使用抗生素种类及时间、机械通气、侵入性操作、家庭氧疗、急性生理与慢性健康(acute physiology and chronic health evaluation,APACHⅡ)评分、身体质量指数(body mass index,BMI),采用固定效应模型和随机效应模型Meta分析显示,吸烟史、住院天数增加、住院次数≥3次、住院天数>20 d、多次住院、住院次数增加、入住ICU、GOLD Ⅲ~Ⅳ级、呼吸衰竭、糖尿病、心力衰竭、肾功能不全、低蛋白血症、真菌定植或既往感染、使用全身糖皮质激素、使用吸入糖皮质激素、糖皮质激素使用时间增加、糖皮质激素使用天数>2周、糖皮质激素累积剂量增加、糖皮质激素累积剂量>350 mg、糖皮质激素每日剂量增加、糖皮质激素每日剂量≥20 mg、使用抗生素、抗生素种类增加、使用碳青霉烯类抗生素、抗生素使用时间增加、机械通气、机械通气时间增加、侵入性操作、APACHⅡ评分为慢性阻塞性肺疾病患者发生肺曲霉病主要危险因素。对于无显著异质性的因素分别应用固定效应模型和随机效应模型,结果显示前后合并OR值均非常接近;对于存在异质性的因素,先应用随机效应模型计算,然后剔除部分文献后使异质性检验P>0.05,I2<50%,再次进行Meta分析,结果显示FEV1%降低、白蛋白定量、糖皮质激素使用时间>2周、糖皮质激素每日剂量≥20 mg、抗生素种类超过3种等因素剔除前后变化较大,结果稳健性较低,提示可能存在潜在的偏倚因素,见表2。
2.4单因素和多因素分层分析 除机械通气、抗生素使用时间增加、低蛋白血症的单因素和多因素合并OR值比较差异较大,其他因素的两种数据类型得出结果基本一致,见表3。
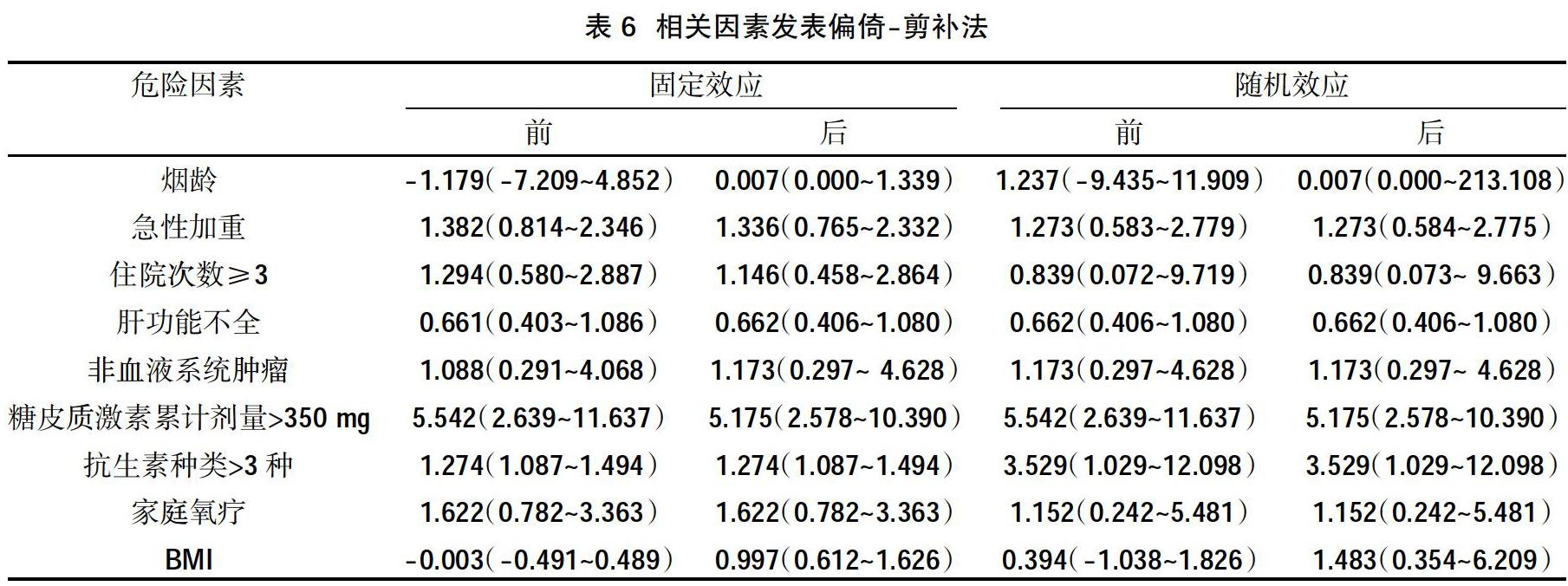
2.5发表偏倚 除低蛋白血症,BMI存在发表偏倚,其余相关因素无明显发表偏倚,见表4~表6。
3讨论
COPD合并PA的发病率逐年升高,国内外众多学者对其流行病学、病因及机制等做了系列研究,但由于各个研究样本量限制以及研究间存在差异,因此仍有部分结论存在争议。目前普遍认为引起COPD发生PA风险增加的原因是多个方面共同作用的,包括COPD患者本身的肺部结构改变和气道功能障碍,糖皮质激素、抗生素的经验性使用,重症患者采用的机械通气,老年患者病程迁延、营养消耗状态、长期缺氧引起免疫力下降,反复住院等[28-33]。但导致COPD患者PA风险增加的糖皮质激素精确剂量和时间及抗生素种类和疗程标准仍不明确,一些合并症、肺功能情况、既往肺部感染史或病原菌定植等因素对COPD患者PA发病率的影响尚未有统一定论。
本Meta分析结果显示,使用全身糖皮质激素、吸入糖皮质激素、糖皮质激素使用时间增加、糖皮质激素使用时间>2周、糖皮质激素累积剂量增加、糖皮质激素累积剂量>350 mg、糖皮质激素每日剂量增加、糖皮质激素每日剂量≥20 mg、使用抗生素、抗生素种类增加、使用碳青霉烯类抗生素、抗生素使用时间增加,多次住院、住院时间长,机械通气等侵入性操作,低蛋白血症为慢性阻塞性肺疾病患者发生肺曲霉病的主要危险因素。除了这些普遍被认同的危险因素,本研究还发现患者一般情况如吸烟史、入住ICU、真菌定植或既往感染、GOLD Ⅲ~Ⅳ级、APACHⅡ评分高,一些合并症如呼吸衰竭、糖尿病、肾功能不全、心力衰竭也会引起风险增加。此外还有一些新提出的观点认为铜绿假单胞菌、流感病毒、巨细胞病毒等参与可能增加风险,但由于涉及文献数不足,本研究未做进一步分析。抗生素尤其是碳青霉烯类抗生素的使用以及抗生素使用疗程的增加与COPD患者PA的发生高度相关,这是由于长期使用广谱抗生素会导致微生物平衡紊乱,有利于曲霉菌等条件致病菌过度生长;同时,广谱抗生素应用后中性粒细胞释放过氧化物酶减少,不能有效破坏真菌菌丝细胞壁,容易继发曲霉菌等真菌感染,建议临床上在药敏结果提示下使用抗生素。随着抗生素种类的增加,风险也有所增加,但抗生素联用种类超过3种这个因素合并OR值无统计学意义,并且异质性达84%,分析原因发现该因素纳入4篇研究,其中Xu H等[12]设计的研究中抗生素种类包含3种,而其他3篇均为超过3种,剔除掉Xu H等[12]的研究后异质性下降至50%,再合并OR值有统计学意义,但相关性不强。
糖皮质激素的使用也有较强的相关性,并且随着使用剂量和时间增加危险性明显增加。研究显示[34],糖皮质激素显著影响免疫效应细胞及细胞因子的分布和功能,选择性抑制辅助性T淋巴细胞1(Th1),Toll样受体(TLR)的表达降低,减弱对曲霉菌的初始天然免疫应答。通过抑制外源性γ-IFN表达和多形核中性粒细胞(PMNs)、肺泡巨噬细胞(PAM)的吞噬功能,导致机体无法吞噬并破坏曲霉菌分生孢子和菌丝。胡艳艳[35]研究表明,激素可能通过真菌中的固醇连接蛋白直接刺激烟曲霉菌生长。COPD合并PA患者中CD4+/CD8+T细胞的数量较少,这间接证实了糖皮质激素的使用[36]。临床上糖皮质激素在COPD患者中的应用很常见,本研究Meta分析显示,COPD患者中无论是稳定期长期吸入用糖皮质激素及其联合制剂,还是急性加重期的全身用糖皮质激素,都与PA的发生相关,但全身用糖皮质激素的相关性更高,约为吸入用糖皮质激素的2倍,这提示或许使用吸入型糖皮质激素的收益风险比更佳。糖皮质激素每日剂量≥20 mg或累积剂量>350 mg都是中危风险因子,提示与其他无明显免疫抑制的患者相比,COPD患者在接受更少剂量的糖皮质激素时也会发生PA,也有研究提出不同的剂量、疗程标准,但文献数不足未进一步分析。糖皮质激素使用时间>2周分析提示有强相关性,但该因素的异质性较高,且经敏感性分析前后合并OR值变化大,考虑可能与研究设计时未对糖皮质激素种类、剂量分类,以及使用时间点不一致有关,如汪群智等[21]的研究规定了使用糖皮质激素超过2周是在90 d内,而其他研究未提及,因此结论可靠性有待商榷。
机械通气及其他侵入性操作也是主要的危险因素,机械通气时间越长,发生PA的可能性也越高。COPD急性加重期常需要呼吸机辅助通气,有创机械通气可损伤上皮粘膜,破坏呼吸道生理屏障,气道纤毛活力下降,从而促进肺部曲霉菌感染形成。住院天数增加和多次住院也会增加感染风险,本研究结果显示,住院时间>20 d是中危因素,这可能由于COPD患者由于病情反复住院导致接触感染源机会的增加,尤其在ICU中病原菌、耐药菌分布更加密集,感染风险也更高。低蛋白血症的相关性提示患者营养状况与PA发病关系密切,COPD患者处于营养消耗状态,血清白蛋白减少,免疫活性物质合成障碍,对曲霉菌易感性增强。在分析白蛋白定量时,存在明显异质性,可能是各个地区医院检测手段、试剂盒等的差异引起的。除血清白蛋白,BMI也在一定程度上反映營养状况,过低时提示营养不良,但BMI在过高时,肾病、糖尿病、心血管及呼吸道疾病的风险会提高。本研究BMI的合并效应值并无统计学意义,但经剪补法补充后,效应值变为有统计学意义,这可能与发表偏倚有关。真菌定植或既往感染也是危险因素之一,尤其是曲霉菌定植的COPD患者中,进展为曲霉菌病的病例比例很高[21,37]。条件致病菌的定植可能是潜在的免疫抑制的标志,并且曲霉菌定植可加重气道反应,在机体内可形成生物膜,抗真菌药物治疗效果欠佳,可在肺内长期存在。
COPD患者肺功能与PA发生的关系目前还没有定论,本研究结果提示,GOLD Ⅲ~Ⅳ级为发病的危险因素,这可能是由于GOLD Ⅲ~Ⅳ级多为晚期患者,机体慢性缺氧,导致免疫力下降。然而FEV1%的Meta分析无统计学意义,但该因素的异质性指数高,这可能与研究纳入的COPD患者未区分急性加重期与稳定期有关,故结论有待进一步验证。吸烟史是COPD公认的危险因素,吸烟人群存在一系列复杂的炎症反应,导致气道粘液纤毛功能障碍,Wu Y等[38]研究证明,吸烟导致肺泡巨噬功能的缺陷,包括TLR2的延迟上调,从而增加宿主曲霉菌病的风险。本研究也提示吸烟与COPD患者PA的发生有关联,而烟龄长短在本次研究中无统计学意义。其他如一些合并症肾功能不全、糖尿病干扰免疫反应,心力衰竭、呼吸衰竭加重全身缺氧情况,以及一般情况衰竭APACHⅡ评分升高,均可导致COPD患者发生PA的风险升高。本研究还对部分因素同时纳入单因素和多因素数据进行分层分析,其中全身用糖皮质激素、使用抗生素、糖尿病、真菌定植或既往感染4种因素分层分析结果基本一致,故可合并分析,增加了样本量,增强了合并结果的可靠性。而机械通气、抗生素使用时间增加、低蛋白血症的分层分析存在较大差异,表明这3种因素可能与其他自变量有交互作用,导致单因素到多因素分析结果的变化,如机械通气患者可能本身病情重,一般情况差而曲霉菌感染风险进一步增加。此外,性别、年龄、急性加重期、肝功能不全、心血管疾病、非血液系统肿瘤,家庭氧疗的合并OR值无统计学意义,但由于纳入研究文献样本量的限制,以及因素间相互作用,其对COPD患者PA发病的影响还不能确定。
临床上COPD患者合并有以上多个危险因素时,应警惕PA的发生并及时干预,尤其是对危险因素的控制,包括抗生素、糖皮质激素的规范使用;机械通气及侵入性操作时动作轻柔;医护人员增强无菌观念;病房环境的清洁,减少交叉污染;予以患者营养指导;监测血氧浓度;对上述并发症积极处理等。另外,多种危险因素都通过破坏免疫系统增加曲霉菌的易感性,故今后COPD合并PA的研究重心或许在免疫学机制层面,包括免疫学检测和免疫治疗等。
本研究通过整合已有分散资料,运用系统分析,扩大每个研究因素的样本量,以提高检验效能,评价各个因素相关性,对部分因素进行了定量分析,并且本研究兼顾单因素数据和多因素两种数据类型,增加了样本量,以期增加结果可靠性。本研究不足之处在于:①仅纳入中英文语种文献,大部分为中文文献,结论推及更适用于中国地区;②原始文献基本上均为回顾性研究,研究设计存在不足,绝大部分未描述无应答率,但本研究严格按照NOS标准评价,排除低质量文献,对于部分自身差异较大的因素,选择以标准化均数差(standard mean difference,SMD)为效应量指标,消除绝对值大小和度量衡对结果的影响,但仍不排除有潜在偏倚存在;③本研究纳入文献均为公开发表,虽然Eggers test、失安全系数法、剪补法等多种检测方法发现绝大部分因素无明显发表偏倚,但可能存在潜在发表偏倚;④部分因素纳入文献较少,异质性大,结果不稳健,对此本研究采用敏感性分析协助明确异质性来源,还有一些相关因素因数据限制未做分析,结论还需要更多大样本、多中心研究驗证。未来进行临床对照研究时可对暴露因素进行更加精准的定义及详细分类,比如对使用某种药物的种类、剂量、疗程、时间范围都应尽可能进行描述;还可选择前瞻性、巢式研究进一步减少偏倚。
综上所述,慢性阻塞性肺疾病患者发生肺曲霉病是多种危险因素共同作用的结果,与患者的治疗方式、既往病史、合并症等密切相关,但由于客观因素限制,部分结果可能仍存在偏倚,还需进一步研究验证。
参考文献:
[1]Guines J,Torres-Narbona M,Gijon P,et al.Pulmonary aspergillosis in patients with chronic obstructive pulmonary diseases:incidence,risk factors,and outcome[J].Clin Microbiol Infect,2010,16(7):870-877.
[2]Kousha M,Tadi R,Soubani AO.Pulmonary aspergillosis:a clinical review[J].Eur Respir Rev,2011,20(121):156-174.
[3]Segal BH,Walsh TJ.Current approaches to diagnosis and treatment of invasive a spergillosis[J].AM J Respir Crit Cars Med,2006,173(7):707-717.
[4]Muquim A,Dial S,Menzies D.Invasive aspergillosis in patients with chronic obstructive pulmonary diseases[J].Can Respir J,2005,12(4):199-204.
[5]陈瑞英,孙培宗,靳建军,等.慢性阻塞性肺疾病患者发生侵袭性肺曲霉病的危险因素分析[J].中国实用医药,2008,3(18):53-55.
[6]罗莉,文富强.慢性阻塞性肺疾病患者并发侵袭性肺曲霉病的影响因素研究[J].四川大学学报(医学版),2010,41(4):720-722.
[7]金锋.COPD继发曲霉菌感染危险因素分析[J].临床肺科杂志,2011,16(11):1705-1706.
[8]李玉芝,王从政,刘美云.慢性阻塞性肺病患者侵袭性肺曲霉菌病危险因素分析[J].山东医药,2011,51(47):93-94.
[9]He H,Ding L,Li F,et al.Clinical features of invasive bronchial-pulmonary aspergillosis in critically ill patients with chronic obstructive respiratory diseases:a prospective study[J].Crit Care,2011,15(1):R5.
[10]He HY,Chang S,Ding L,et al.Significance of Aspergillus spp. isolation from lower respiratory tract samples for the diagnosis and prognosis of invasive pulmonary aspergillosis in chronic obstructive pulmonary disease[J].Chin Med J (Engl),2012,125(17):2973-2978.
[11]宋宁,史金英,李艳肖,等.慢性阻塞性肺病急性加重期合并侵袭性肺曲霉菌病的危险因素分析[J].河北医药,2012,34(1):87-88.
[12]Xu H,Li L,Huang WJ,et al.Invasive pulmonary aspergillosis in patients with chronic obstructive pulmonary disease:a case control study from China[J].Clin Microbiol Infect,2012,18(4):403-408.
[13]段秋立,門琤,冯冬冬.慢性阻塞性肺病合并肺曲霉病的治疗及影响因素分析[J].中国医学工程,2013,21(11):142-143.
[14]刘亚,黄相增.COPD病人并发IPA危险因素分析[D].新疆医科大学,2013.
[15]赵磊,毕丽鑫,王辉.慢性阻塞性肺病合并肺曲霉病的治疗及影响因素分析[J].临床合理用药,2013,6(40):84-85.
[16]Delsuc C,Cottereau A,Frealle E,et al.Putative invasive pulmonary aspergillosis in critically ill patients with chronic obstructive pulmonary disease:a matched cohort study[J].Crit Care,2015(19):421.
[17]刘红丹,贺航咏,孙兵,等.重症慢性阻塞性肺疾病合并侵袭性支气管-肺曲霉菌病的临床特点:巢式病例对照研究[J].国际呼吸杂志,2015(9):676-680.
[18]臧宁,徐爱珍,温明春,等.慢性阻塞性肺疾病急性加重期痰曲霉菌阳性患者临床特征及危险因素分析[J].国际呼吸杂志,2015,35(11):823-826.
[19]丁宗励,陈建辉.运用多元Cox回归模型分析影响慢性阻塞性肺疾病合并侵袭性肺曲霉菌病的危险因素[J].中国医刊,2016,51(11):79-81.
[20]陆薇,梁克诚,卢翠梅,等.COPD合并侵袭性肺曲霉菌病的危险因素及临床特点分析[J].中国临床研究,2016,29(7):892-895.
[21]汪群智,盛美玲,楼亚波.慢性阻塞性肺疾病合并侵袭性肺曲霉病的危险因素及临床特征分析[J].中华临床感染病杂志,2016,9(6):528-532.
[22]杨仁恒.慢性阻塞性肺疾病并侵袭性肺曲霉菌病患者的临床表现及胸部CT表现分析[J].实用心脑肺血管杂志,2016,24(1):105-107.
[23]杜俊凤,任少达,迟玉敏,等.慢性阻塞性肺疾病并发侵袭性肺曲霉菌病的临床特征和危险因素分析[J].中国医学前沿杂志,2017,9(7):132-135.
[24]毛文炜,顾海挺,邵海燕,等.慢性阻塞性肺病急性加重期患者合并侵袭性肺曲霉菌感染的危险因素分析与临床[J].中华医院感染学杂志,2017,27(15):3442-3445.
[25]宋小峰.慢性阻塞性肺病曲霉菌痰培养阳性的多因素分析[D].青岛大学,2017.
[26]Tong X,Cheng A,Xu H,et al.Aspergillus fumigatus during COPD exacerbation:a pair-matched retrospective study[J].BMC Pulm Med,2018,18(1):55.
[27]Molinos-Castro S,Pesqueira-Fontán PM,Rodríguez-Fernández S,et al.Clinical factors associated with pulmonary aspergillosis in patients with chronic obstructive pulmonary disease[J].Enferm Infecc Microbiol Clin,2020,38(1):4-10.
[28]Ader F,Nseir S,Le Berre R,et al.Invasive pulmonary aspergillosis in chronic obstructive pulmonary disease:an emerging fungal pathogen[J].Clin Microbiol Infect,2005,11(6):427-429.
[29]Bulpa PA,Dive AM,Garrino MG,et al.Chronic obstructive pulmonary disease patients with invasive pulmonary aspergillosis:benefits of intensive care[J].Intensive Care Med,2001,27(1):59-67.
[30]Barberán J,Candel FJ,Arribi A.How should we approach Aspergillus in lung secretions of patients with COPD[J].Rev Esp Quimioter,2016;29(4):175-182.
[31]Bao Z,Chen H,Zhou M,et al.Invasive pulmonary aspergillosis in patients with chronic obstructive pulmonary disease:a case report and review of the literature[J].Oncotarget,2017,8(23):38069-38074.
[32]Venanzi-Rullo E,Fortun-Abete J,Nunnari G.Diagnosing invasive pulmonary aspergillosis in COPD patients: more challenging and less rare than before.A review of the literature[J].Infect Dis Trop Med,2016,2(4):E341.
[33]Dutkiiewick R,Hage A.Aspergillus infection in the critically ill[J].Proc Am Thor Soc,2010,7(3):204-209.
[34]张莉芸,李军霞,王婷艳.糖皮质激素对Th1/Th2平衡的影响[J].中华临床免疫和变态反应杂志,2009(1):64-68.
[35]胡艳艳.慢性阻塞性肺疾病与肺曲霉菌感染的研究进展[J].中华肺部疾病杂志(电子版),2014,7(2):88-91.
[36]Liang S,Jiang R,Lu HW,et al.Immunity status of invasive pulmonary aspergillosis patients with structural lung diseases in Chinese adults[J].Thorac Dis,2017,9(2):247-253.
[37]Barberán J,García-Pérez FJ,Villena V,et al.Development of Aspergillosis in a cohort of non-neutropenic,non-transplant patients colonised by Aspergillus spp[J].BMC Infect Dis,2017,17(1):34.
[38]Wu Y,Xu H,Li L,et al.Susceptibility to Aspergillus Infections in Rats with Chronic Obstructive Pulmonary Disease via Deficiency Function of Alveolar Macrophages and Impaired Activation of TLR2[J].Inflammation,2016,39(4):1310-1318.
收稿日期:2020-03-23;修回日期:2020-04-07
編辑/杜帆
作者简介:李迪婧(1994.7-),女,重庆人,硕士研究生,主要从事慢性阻塞性肺疾病研究
通讯作者:胡良安(1963.1-),男,重庆人,硕士,主任医师,主要从事呼吸系统常见病的研究
