复合模板分子印迹聚合物的制备及对黄酮类化合物的吸附性能研究
2020-07-27楚善明苏立强于亭亭靳岩爽
楚善明,苏立强,于亭亭,靳岩爽,韩 爽,王 颖
(1.齐齐哈尔大学化学与化学工程学院,黑龙江齐齐哈尔 161006;2.佳木斯市第一中学,黑龙江佳木斯 154003)
黄酮类化合物是多种常用中药材和天然产物(银杏、槐米、金银花、三七)的有效成分,主要包括槲皮素、橙皮素、木犀草素、芦丁、山奈酚等。因该类化合物具有抗病毒及免疫调节等功能,在医药等领域具有广泛的应用价值。黄酮类化合物的天然提取物[1 - 3]已用于临床。
通过分子印迹技术[4 - 6]制备的分子印迹聚合物(MIPs)对靶向目标具有良好的选择性,已应用于天然活性成分分离、食品工业、色谱分离、环境监测等领域。现有MIPs的制备主要为沉淀聚合、本体聚合、原位聚合、悬浮聚合、表面聚合等方法。回流沉淀聚合法[7 - 9]是在传统沉淀聚合法的基础上发展的一种新型聚合技术,与传统的沉淀聚合法相比,该方法反应时间短、效率更高。以黄酮类化合物分子作为模板制备印迹聚合物,并将其用于天然产物中黄酮类物质的分离提取已见诸报道。孙爽等[10]以凹凸棒为载体,芦丁为模板制备其印迹聚合物,利用其从冬青叶中提取芦丁。丁佳等[11]以羧基化多壁碳纳米管为基质材料,芹菜素为模板制备分子印迹聚合物,使芹菜提取物中芹菜素的浓度得到有效提升。
印迹聚合物的选择吸附性能,使其能从复杂基质中高效提取某一成分,但同时因聚合物的单一吸附性,在对某一成分提取的同时,对天然产物中其它的物质造成了浪费。近年来,复合模板[12 - 14]逐渐出现在人们的视野当中,因其不仅扩大了MIPs结合位点的识别范围,同时又能够对同类化合物表现出良好的亲和力,解决了MIPs在同类物质吸附中的受限问题。本文以槲皮素与橙皮素为复合模板分子,采用回流沉淀法制备复合模板MIPs,对多种黄酮类化合物均表现出较大的吸附容量,为同时分离提取天然产物中黄酮类化合物提供了新方法。
1 实验部分
1.1 仪器与试剂
LPG3400高效液相色谱仪(美国,戴安公司);GT10-2高速冷冻离心机(北京时代北利离心机有限公司);TU-1901紫外/可见分光光度计(北京普析通用仪器有限公司)。
槲皮素、橙皮素、山柰酚、槲皮苷、芹菜素、芦丁、木犀草素、姜黄素、阿魏酸(分析纯,西安小草植物科技有限责任公司);乙二醇二甲基丙烯酸酯(EGDMA)(分析纯,日本东京化成工业株式会社);二乙烯基吡啶(2-VP)、甲基丙烯酸(MAA)、丙烯酰胺(AM)(分析纯,天津科密欧化学试剂开发中心);偶氮二异丁腈(AIBN)(分析纯,天津光复精细化工研究所);乙腈、甲醇、甲酸(分析纯,天津科密欧化学试剂中心)。
1.2 分子印迹聚合物的制备
在100 mL圆底烧瓶中,加入模板分子槲皮素0.0755 g(0.25 mmol),橙皮素0.0756 g(0.25 mmol),功能单体2-VP 0.2103 g(2 mmol),超声溶解于80 mL甲醇中,超声预聚合3 h。加入3.94 g(20 mmol)交联剂EGDMA和0.0200 g 引发剂AIBN,超声10 min,冲N2气脱氧30 min,加入搅拌子,升温至70 ℃,于200 r/min恒温回流热聚合3 h。配制乙酸体积比为10%的乙酸-甲醇溶液,将合成的聚合物索氏提取24 h,以除去聚合物上的模板分子与未反应的功能单体及交联剂。50 ℃真空干燥24 h,即得MIPs。利用上述方法制备非印迹聚合物NIPs,但不加入模板分子。
1.3 MIPs吸附性能研究
1.3.1 静态吸附实验配制溶液浓度(c0)范围在0.00~100.00 μg/mL的槲皮素与橙皮素溶液,分别向各浓度溶液中加入10 mg MIPs,静止12 h。0.45 μm膜过滤,取1 mL的溶液,无水甲醇稀释至3 mL,利用紫外分光光度计测出各溶液的浓度ce,根据吸附前后的模板分子浓度变化,计算出洗脱后MIPs的吸附量,依公式计算MIPs的吸附容量(Q):Q=(c0-ce)×V/m,计算得出MIPs对不同浓度槲皮素与橙皮素的吸附容量。NIPs的吸附容量计算步骤同上。
1.3.2 动态吸附实验取两只100 mL锥形瓶,各放入0.0300 g的MIPs,分别加入配制好的35 mL 100 μg/mL 的槲皮素、橙皮素溶液,再加入15 mL无水甲醇,低频超声10 min。每间隔20 min吸取1 mL上层清液,离心5 min(800 r/min),用0.45 μm滤膜过滤,再利用紫外分光光度计测得对应的浓度ce,计算MIPs的Q。NIPs的Q计算步骤同上。
1.4 样品处理与固相萃取
取银杏叶粉5 g,溶解于300 mL甲醇中,高频超声1 h后,回流提取3次,将3次回流提取的甲醇溶液混合后进行过滤,蒸发浓缩滤液,将浓缩后的滤液以8 000 r/min离心10 min,然后取上清液用甲醇定容至250 mL。取100 mg MIPs制备分子印迹固相萃取(MISPE)柱,依次用3 mL水和5 mL甲醇对MISPE柱进行活化后,将处理后的溶液上样,用5 mL乙腈进行淋洗,再用10 mL体积比为9∶1的甲醇-乙酸溶液对样品进行洗脱,将洗脱液浓缩至1 mL,用高效液相色谱法检测。色谱条件:Hypersil ODS2色谱柱;流动相为甲醇,流速为0.5 mL/min;紫外检测波长:350 nm。
2 结果与讨论
2.1 模板分子的选择
MIPs对目标分析物的靶向识别能力主要取决于微球内部印迹孔穴的结构及结合位点,而模板分子决定了印迹孔穴的空间结构,因此选择合适的两个分子作为复合模板分子,可优化空间结构与作用位点。黄酮类模板与功能单体的结合过程中,主要依靠的是其分子中存在的活性基团羟基与醚键的作用等,槲皮素与橙皮素为中草药中常见的两种黄酮类组分,同时分子中含有多个酚羟基、醚键等,适合印迹。所以,本实验选用槲皮素与橙皮素作为MIPs的复合模板分子。槲皮素和橙皮素的结构式见图1。
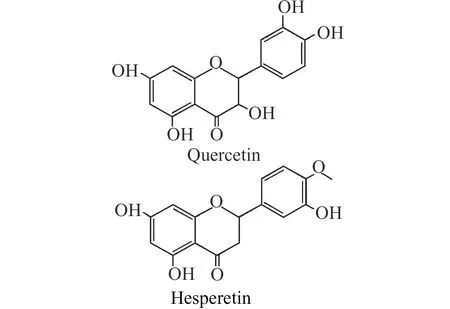
图1 槲皮素与橙皮素结构Fig.1 Structure of quercetin and hesperetin
2.2 MIPs制备时间选择
在回流沉淀聚合反应中,反应速度快,反应时间对结果影响大,为考察制备时间对MIPs形貌的影响,对MIPs制备中不同时刻的微球形貌及粒径范围进行扫描电镜分析,见图2。由图2可见,制备时间对印迹微球粒径和形貌的影响非常明显。当反应进行至1 h时,所生成的MIPs微球表面粗糙,粒径较小,且粒度范围较大;当反应进行至2 h时,印迹微球表面开始变光滑,粒径范围仍较大;当反应进行至3 h时,微球表面更加光滑,粒径变均匀,颗粒明显增大,粒径约为1 μm;反应进行至4 h时,无明显变化,所以选择反应时间3 h。而传统沉淀聚合过程一般需要24 h左右,回流沉淀聚合法在保证了微球形貌和粒径的同时,大大缩短了聚合时间,提升了效率。

图2 不同制备时间的MIPs微球扫描电镜(SEM)图Fig.2 SEM images of MIPs microspheres obtained by different preparation time
2.3 红外光谱研究
为考察分子印迹聚合物是否制备成功,对未洗脱模板分子的印迹聚合物、MIPs和NIPs采用红外光谱法分析,见图3。可以看出,在未洗脱模板分子的红外谱图中,3 280 cm-1处为-OH伸缩振动峰,在1 612、1 513 cm-1处出现模板分子上的苯环骨架的特征吸收峰,在1 726 cm-1处出现了EGDMA的C=O伸缩振动吸收峰,表明聚合物成功制备。而在MIPs红外谱图中,3 430 cm-1的-OH吸收峰与未洗脱模板分子的聚合物相比,发生了明显位移,可能是由于模板分子与功能单体之间存在的氢键作用力所导致的。在MIPs和NIPs的红外谱图中,在1 730、1 453、1 157 cm-1处均出现吸收峰,是由单体2-VP和交联剂EGDMA引起的,且峰形基本一致,说明模板分子已洗脱完全。
2.4 静态吸附容量
采用静态吸附实验对聚合物的吸附性能进行考察,绘制MIPs与NIPs对双模板分子槲皮素与橙皮素的静态等温吸附曲线,见图4。由图4可知,MIPs对两种模板分子槲皮素与橙皮素的吸附容量均明显高于NIPs,原因是MIPs微球含有与槲皮素和橙皮素结构相匹配的印迹孔穴,且孔穴内规则排列着与其结构对应的结合位点;MIPs对槲皮素吸附容量达到了49.82 mg/g,对橙皮素也达到44.34 mg/g。这是由于双模板与功能单体间的多位点协同作用,使微球内部孔穴的结构得到优化,提高了印迹微球的分子识别能力。而NIPs微球内部不存在与其结构相匹配的印迹孔穴,主要依靠物理吸附,对两种模板的吸附容量均较小,且无明显差别。

图3聚合物的红外(IR)光谱图Fig.3 IR spectra of polymer
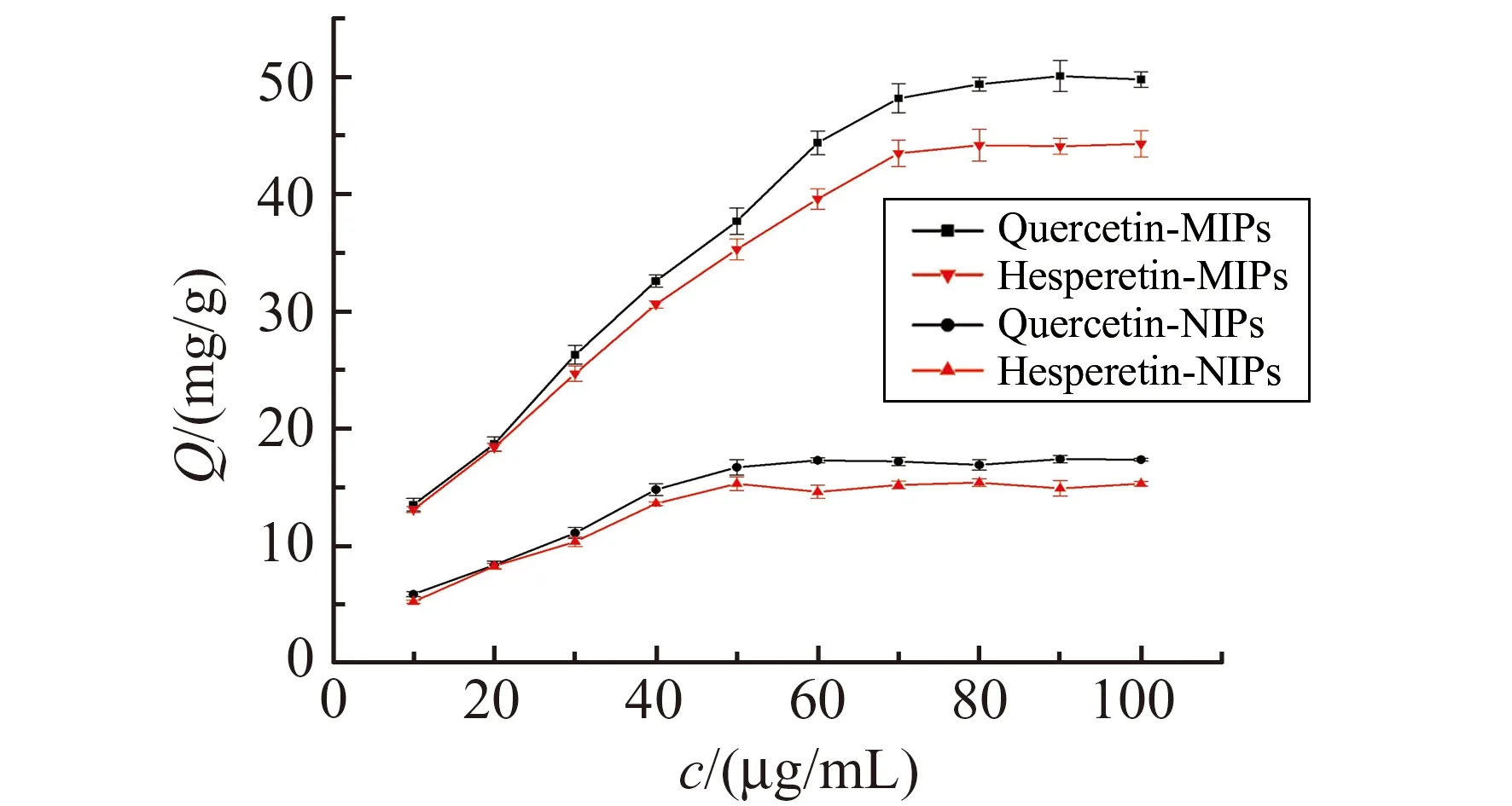
图4 静态吸附等温线Fig.4 Static adsorption isotherm
由图5可知:Scatchard曲线分为两段直线,说明聚合物主要形成两种不同的结合位点,即高亲和位点和低亲和位点。

图5 槲皮素(a)橙皮素(b)的Scatchard分析曲线Fig.5 Scatchard analysis curves of quercetin(a) and hesperetin(b)
2.5 动态吸附性能
利用动态吸附实验对聚合物的动态吸附性能进行考察,绘制MIPs与NIPs对双模板分子槲皮素与橙皮素的动态吸附曲线(图略),在1~100 min之间,MIPs的吸附速率迅速增长,在100~150 min之间,吸附速率变缓,在150 min处达到平衡。这是由于MIPs微球中存在深层与浅层两种印迹孔穴,MIPs初始吸附主要依赖于微球表面浅穴上的识别位点来吸附模板分子,因此吸附速率较快。随着浅穴的吸附量逐渐达到饱和,模板分子开始逐渐以传质扩散的形式进入深穴,受到了聚合物内部的传质阻力,吸附速率减缓。NIPs没有与模板分子匹配的印迹孔穴,吸附速率相对平缓,吸附容量低。由表1可知,MIPs的吸附过程更符合准二级动力学模型,吸附过程主要为化学吸附,NIPs对的吸附过程更符合准一级动力学模型,属于物理吸附。并对其进行准一级与准二级动力学模型拟合,结果见表1。

表1 MIPs及NIPs的准一级和准二级动力学模型参数
2.6 选择性吸附性能
为探究MIPs的特异性识别能力,选择了包括模板分子在内的7种常见黄酮类化合物,以及另外两种天然产物中的非黄酮类药物姜黄素、阿魏酸作为吸附底物。通过平衡吸附实验测定MIPs对9种化合物的平衡吸附容量,计算印迹因子:α(α=QMIPs/QNIPs),结果见表2。
如表2所示,MIPs对模板分子槲皮素与橙皮素的吸附容量最大,分别达到49.82 mg/g、44.34 mg/g,印迹因子α也达到了最高的2.871与2.896。原因是聚合物内部存在与模板分子相匹配的孔穴结构,表现出了对模板分子的特异选择性能;同时,MIPs对其他5种黄酮类物质的吸附容量也较高,在46.65~37.54 mg/g之间,α达到2.665~2.081范围。这是由于复合模板的引入优化了MIPs内部孔穴的空间结构,可使MIPs识别出与模板分子结构类似的其他黄酮类化合物,表现出良好的组选择性;MIPs对姜黄素与阿魏酸两种非黄酮类物质的吸附容量较小,只有15.37 mg/g和18.92 mg/g。这是由于姜黄素、阿魏酸在分子结构上与模板分子具有明显差别,导致其与MIPs内部孔穴不匹配,因此其吸附容量较小;NIPs对9种化合物的吸附容量均较低,没有显著差异。原因是NIPs在制备中没有加入模板分子,微球的内部不存在与其相匹配的印迹孔穴,因此没有选择性。
2.7 黄酮类化合物的提取
2.7.1 MISPE-HPLC方法的建立分别以7种黄酮类化合物(芦丁、槲皮苷、槲皮素、山奈酚、木犀草素、芹菜素、橙皮素)的浓度为横坐标,色谱峰面积为纵坐标,绘制标准曲线,在0.1 ~ 20 mg/L的浓度范围内具有良好的线性关系,相关系数R2范围在0.9993~1之间,以3倍的信噪比计算检测限范围在0.06~0.44 μg/L之间。
2.7.2 实际样品分析以MIPs为固相萃取填料制备MISPE柱,对银杏叶中黄酮类化合物进行分离富集后,经HPLC分析,结果见图6。由图可知,样品经MISPE柱分离富集后,有效去除了基质的干扰。并且,使用过的MIPSPE柱经处理后,重复使用10次,黄酮类化合物回收率仍在90%以上,说明MIPs材料比较稳定,再生性能良好。

图6 银杏叶样品色谱图Fig.6 Chromatograms of Ginkgo biloba sample1:Rutin;2:Quercitrin;3:Quercetin;4:Luteolin;5:Apigenin;6:Kaempferol;7:Hesperitin.
2.7.3 加标回收实验对银杏叶样品中的7种黄酮类化合物进行3水平加标回收实验,结果见表3,回收率在94.85%~98.30%范围内,相对标准偏差(RSD)≤1.8%。
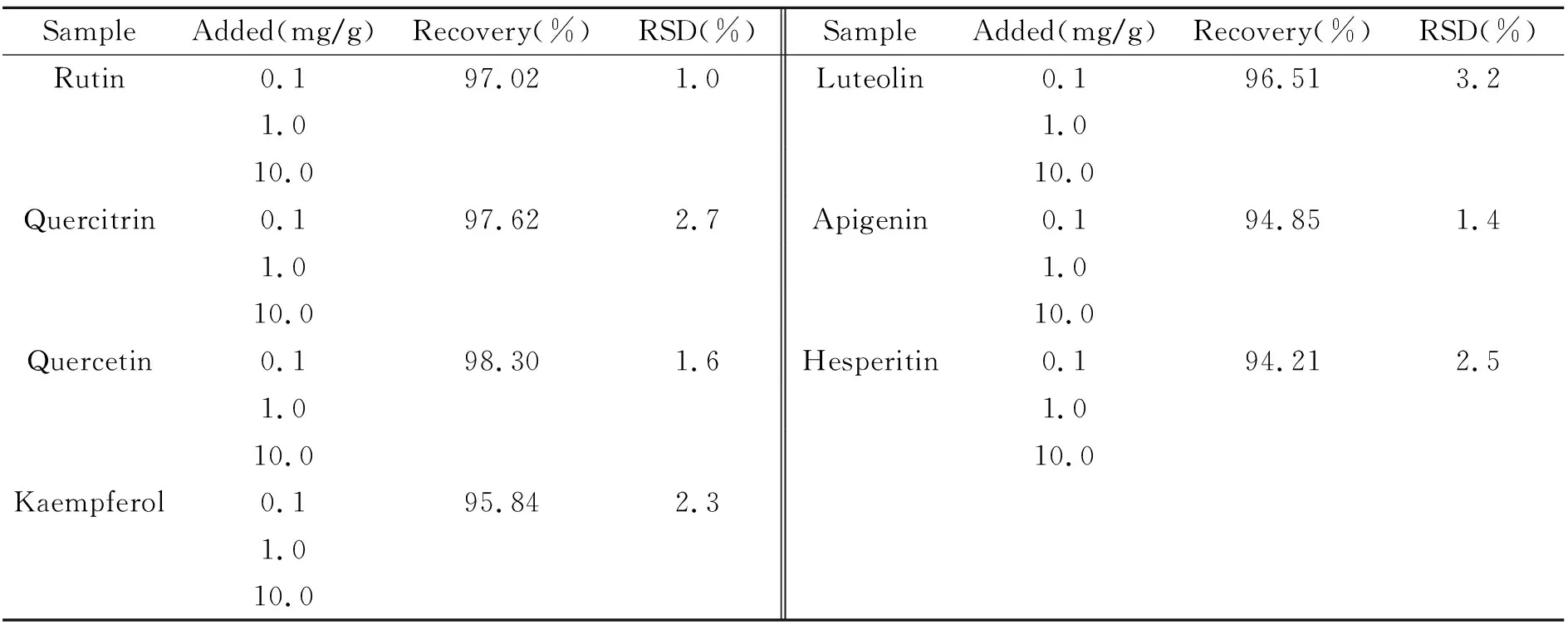
表3 银杏叶样品中黄酮类化合物加标回收实验
3 结论
采用回流沉淀聚合法,以槲皮素和橙皮素作为复合模板,制备了对黄酮类化合物具有组选择性能的MIPs。扫描电镜分析确定了反应的最佳时间为3 h。吸附实验表明,MIPs对黄酮类化合物均具有较高的吸附容量,其范围介于46.65~37.54 mg/g之间。以复合模板MIPs作为固相萃取吸附剂对银杏叶中7种黄酮类物质进行分离富集,能有效去除基质杂质,达到分离提纯的目的,且MIPs重现性较好。同时证明此MIPs有望在天然产物中黄酮类化合物的分离纯化,以及工业上制备对黄酮类化合物具有特异吸附性能材料方面得到进一步的应用。
