盐酸浸出钛铁矿制人造金红石的技术研究
2020-07-27杨显猴周高明刘祥海张祖超
杨显猴,唐 勇,周高明,刘祥海,王 梁,张祖超
(宜宾天原集团股份有限公司,四川 宜宾 644004)
随着氯化法钛白工艺的快速发展,对原料的需求日益增长[1],其中天然金红石品质高,对其不断开发利用于氯化法钛白生产,致使日渐枯竭[2],因此,作为天然金红石的优质替代品,人造金红石的开发和利用已成为国内外相关科研机构及相关企业研究的热点,越来越多的研究者对其进行了更深入、更广泛的研究。
目前人造金红石成熟的制备方法主要有电热法[3]、还原锈蚀法[4]、酸浸法[5]。其中,酸浸法具有浸出速度快、除杂能力强等优点而被广泛应用以及研究[6]。而对于盐酸法浸出钛铁矿这一领域的研究,在酸浸前,一般需对钛铁矿进行预处理。目前主要采用“强还原”、“强氧化-弱还原” 以及“ 强氧化-强还原” 预处理方式[7]对钛铁矿进行改性,使其形成多孔物相结构,并且其铁元素主要物相为以Fe2+形式存在的FeTiO3,以利于酸浸除杂[8]。然而在这三类预处理方式中,都存在高耗能问题。因此,通过低能耗预处理得到钛铁矿,再浸出制备人造金红石是值得研究的。
本实验将钛铁矿先采用“弱氧化-弱还原”的预处理方式对其进行改性,得到的改性钛铁矿其主要矿相为赤铁矿、金红石、钛铁矿,然后通过研究常压浸出或加压浸出该“弱氧化-弱还原”改性钛铁矿,发现采用加压浸出“弱氧化-弱还原”改性钛铁矿工艺可制备可氯化人造金红石。该方法目前研究较少、耗能低且高效,具有研究意义。
1 实验部分
1.1 实验原料
本实验所采用原料为莫桑比克钛铁矿,其化学组成如表1所示。其粒度范围分布见表2所示。

表1 原料钛铁矿化学成分组成 /%

表2 原料钛铁矿粒度分布
1.2 分析仪器
采用X射线荧光光谱仪( XRF,荷兰PANalytical公司生产的Axiosmax型,功率 4.0 kW,最大激发电压60 kV,最大电流 133 mA,Rh靶X射线)对固相颗粒的化学成分进行表征;采用X射线衍射仪(XRD,荷兰PANalytical 公司生产的Empyrean型,Cu Kα靶射线,管压40 kV,管流40 mA),在2θ=10°~100°间扫描对其物相组成测定分析。
1.3 实验方法
1.3.1预处理实验
将500 g钛铁矿送入流化床,在空气气氛下700 ℃氧化20 min,然后在氢气气氛下580 ℃还原20 min,得到“弱氧化-弱还原”改性钛铁矿。
1.3.2常压浸出实验
称取“弱氧化-弱还原”改性钛铁矿50 g放置在装有磁石的三口烧瓶中,并以矿酸比(m/m)1∶3加入一定浓度的盐酸溶液,然后将三口烧瓶放在调温磁力搅拌器中进行加热搅拌,升温至105 ℃,恒温反应一定时间,待反应时间结束对其进行过滤洗涤,随后在120 ℃下干燥4 h、然后在850 ℃下煅烧1 h,最后冷却至常温。
1.3.3加压浸出实验
称取“弱氧化-弱还原”改性钛铁矿50 g放置在高压反应釜中,并以一定矿酸比加入一定质量浓度盐酸,再将反应釜放入盐浴炉中,设置搅拌速率为7 r/min,升温至150 ℃并持续反应6小时,待反应结束后对其过滤洗涤、随后在120 ℃下干燥4 h、然后在850 ℃下煅烧1 h,最后冷却至常温。
2 实验结果与讨论
2.1 改性钛铁矿物相与成分分析
根据Qingshan Zhu 等人[9]研究结果表明:在钛铁矿600-800 ℃弱氧化后,会形成以赤铁矿、金红石、钛铁矿为主要相的矿物,且矿物盐酸浸出速率:赤铁矿(Fe3+)>钛铁矿(Fe2+)>>假板钛矿(Fe3+)。本研究将钛铁矿先经700 ℃弱氧化,使钛铁矿形成以赤铁矿、金红石、钛铁矿为主要相的矿物,然后再经过580 ℃弱还原,使其中的赤铁矿、金红石部分还原为钛铁矿,但其主要物相仍然为赤铁矿、金红石、钛铁矿。在含有部分赤铁矿条件下,使其有利于后续盐酸浸出,提高浸出效率。如图1所示,在经过“弱氧化-弱还原”改性的钛铁矿,主要物相为钛铁矿、赤铁矿、金红石,其赤铁矿含量为20.6%,含量较高,即以赤铁矿物相存在的Fe3+含量为14.42%。该改性钛铁矿化学组成成分见表3所示。由此可知,以赤铁矿物相存在的的Fe3+含量占TFe含量的41.8%。

图1 钛铁矿经700 ℃弱氧化、580 ℃弱还原后的XRD图

表3 改性钛铁矿的化学成分组成 /%
2.2 改性钛铁矿的常压浸出实验
利用该改性钛铁矿,本实验首先通过常压低浓度盐酸浸出实验,在固定矿酸比为1∶3,酸浸温度为105 ℃的条件下,研究了低浓度盐酸不同浓度与酸浸时间对其酸浸效果的影响。由图2可知,酸浸时间相同(6~10 h),人造金红石中的TiO2含量随着盐酸浓度(18%~22%)提高而增大;同样地,盐酸浓度相同时(18%~22%),人造金红石中的TiO2含量随着酸浸时间(6~10 h)增大而增大,但均不能获得TiO2含量>88%的人造金红石。因此,在此条件下,常压浸出“弱氧化-弱还原”改性钛铁矿是不可行的,分析其原因可能为:相对于以赤铁矿利于浸出的程度,改性钛铁矿形成的孔洞小且数量少,成为了制约浸出速率的主要因素。

图2 常压浸出时间、盐酸浓度对人造金红石TiO2含量的影响
2.3 改性钛铁矿的加压浸出实验
随后,本实验通过加压低浓度盐酸浸出实验,在固定矿酸比为1∶3、酸浸温度为150 ℃以及酸浸时间为6 h的条件下,研究了盐酸浓度与酸浸时间对“弱氧化-弱还原”性钛铁矿酸浸效果的影响。在盐酸浓度18%~22%时,由图3可知,制备的人造金红石TiO2含量随着盐酸浓度提高而增大,其含量均大于88%,其中盐酸浓度为22%时,TiO2含量为92.37%。
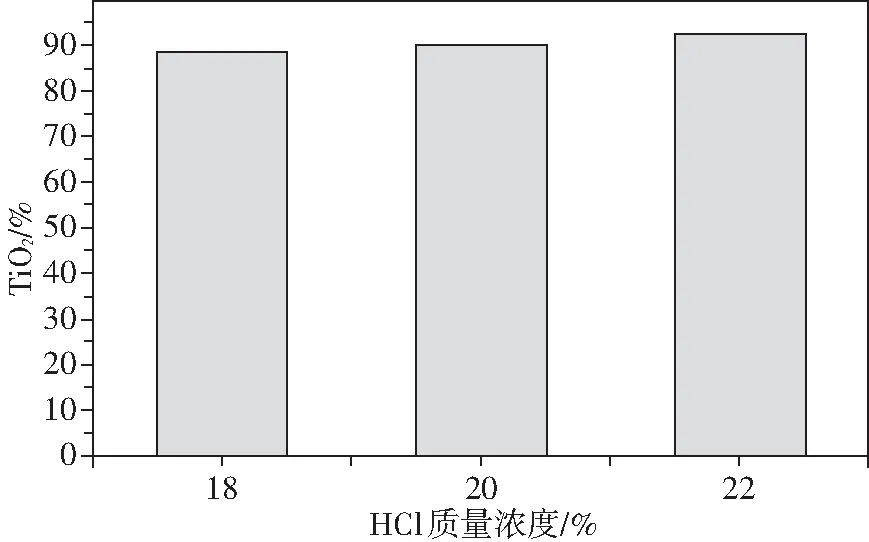
图3 盐酸浓度对人造金红石TiO2含量的影响
由图4可知,制备的人造金红石杂质全铁元素(TFe)的含量均低于5%。其中,盐酸浓度为22%时,其含量为1.55%。由此可知,制备的人造金红石中TiO2与杂质TFe含量满足可氯化制钛白粉要求的原料指标。

图4 盐酸浓度对人造金红石TFe含量的影响
众所周知,浸出前后TiO2的回收率、杂质浸出率也是评价浸出效果的重要指标,因此对其进行了研究。由图5可知,人造金红石的总浸出质量以及对应的总浸出率随盐酸浓度(18%~22%)提高而增大。
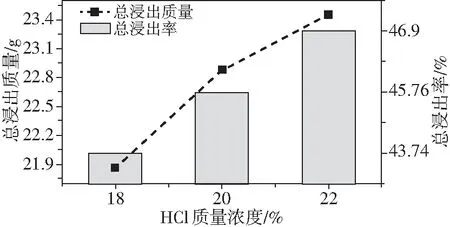
图5 盐酸浓度对人造金红石总浸出质量与总浸出率的影响
根据公式(1)计算得到人造金红石TiO2的回收率,根据公式(2)计算得到改性钛铁矿TFe浸出率。其中,η1与η2分别为人造金红石TiO2的回收率、改性钛铁矿TFe的浸出率,m1与m2分别为原料改性钛铁矿浸出前、浸出后的质量,x1与x2分别为改性钛铁矿浸出前、浸出后TFe的百分含量。
(1)
(2)
由图6可知,TiO2回收率达到92%以上。由图7可知,TFe浸出率达到90%以上,其中浸出盐酸浓度为20%~22%时,TFe浸出率达到95%以上,可知改性钛铁矿中除了钛铁矿中的铁元素杂质被有效除去,改性钛铁矿中的赤铁矿中的Fe3+(占TFe含量的41.8%)也被有效的除去,其原因为以赤铁矿物相存在的Fe3+浸出速率远大于以假板钛矿物相存在的Fe3+的浸出速率,且浸出速率也高于以钛铁矿物相存在的Fe2+。

图6 盐酸浓度对人造金红石中TiO2回收率的影响
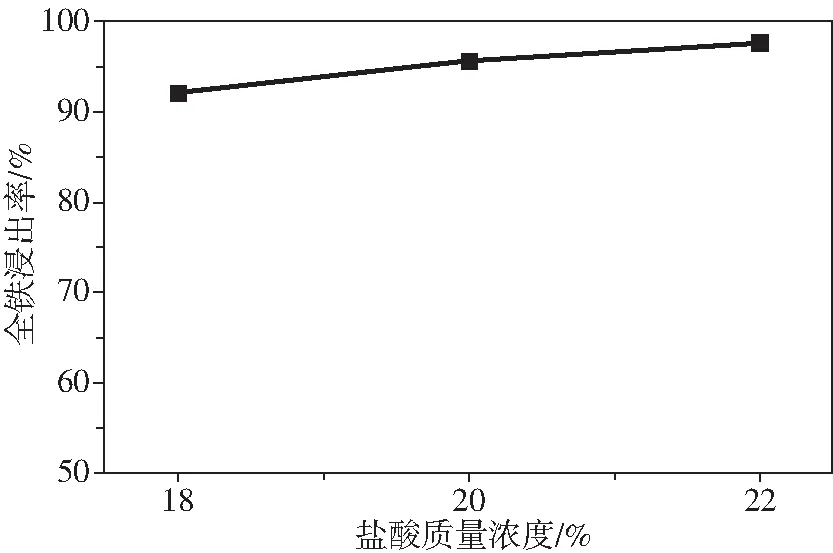
图7 盐酸浓度对改性钛铁矿中TFe浸出率的影响
最后,对产品人造金红石的粉化率也进行了研究,结果如图8所示。由图8可知,浸出后的人造金红石的粒径分布与浸出前的改性钛铁矿的粒径分布基本一致,可知改性钛铁矿在浸出后无明显粉化。因此,采用浸出温度为155 ℃、浸出时间为6 h、酸矿比为3∶1、盐酸浓度为22%时,可制备得到TiO2为92.37%、TFe为1.55%,品位合格且浸出前后无明显粉化的人造金红石。
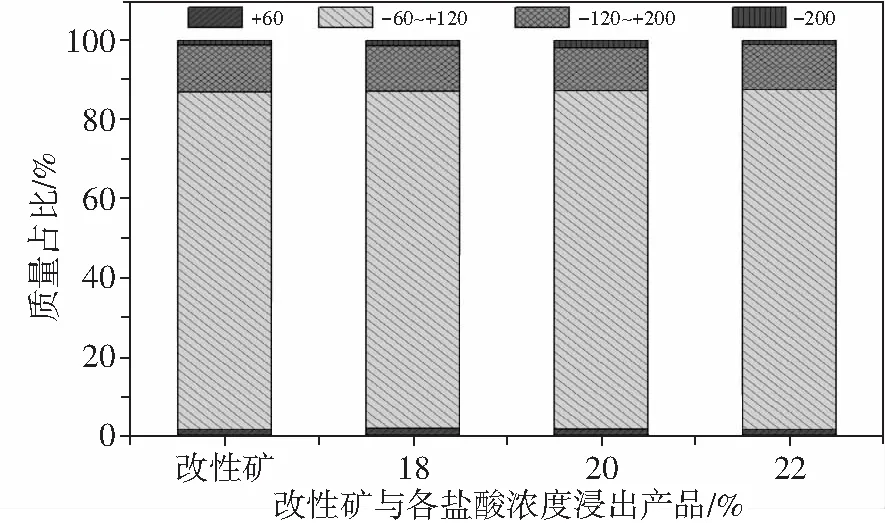
图8 改性钛铁矿浸出前后的粒度分布
3 结论
(1)通过在700 ℃氧化、580 ℃还原低耗能预处理方式改性后,得到的钛铁矿主要物相为钛铁矿、赤铁矿、金红石、镁铁矿。
(2)对“弱氧化-弱还原”改性得到的钛铁矿进行低浓度盐酸常压浸出实验,发现低浓度盐酸常压浸出效果不佳,其主要原因可能为:相对于以赤铁矿利于浸出的程度,改性钛精矿形成的孔洞小且少,成为了制约浸出速率的主要因素。
(3)采用低浓度盐酸加压浸出“弱氧化-弱还原”改性得到的钛铁矿,可以得到优质的可氯化人造金红石,其铁元素被有效浸出的主要原因为:钛铁矿中的铁元素有近40%是以赤铁矿物相形式存在,有利于浸出。当氧化温度为700 ℃、还原温度为580 ℃、浸出温度为155 ℃、浸出时间为6h、酸矿比为3∶1、盐酸浓度为22%时,可制备得到TiO2为92.37%、TFe为1.55%,且浸出前后无明显粉化的人造金红石。该工艺低耗能且简单,值得进一步研究。
