氨基吡啶氢化反应中不同贵金属催化剂协同作用的影响
2020-07-27王昭文李岳锋万克柔
张 磊,王昭文,李岳锋,万克柔,王 慧*
(1.西安凯立新材料股份有限公司,陕西 西安 710201;2.陕西省贵金属催化剂工程研究中心,陕西 西安 710201)
随着人类文明的进步,对作为人类身体健康的药物提出了更高、更新的要求。而近年来含杂环、含手性药物的成功合成预示着这类药物将在今后人类开发农药、医药方面将占有越来越重要的地位[1-2]。其中含氮杂环化合物与生命科学、材料科学有着十分密切的关系,有关含氮杂环化合物的研究成果不断改变着人们的日常生活,天然和合成的含氮杂环化合物在许多商业领域都有重要和广泛的应用。因此开发一种快速而有效合成含氮杂环化合物的方法是有机化学和药物化学的一个重要课题,因为含氮杂环化合物常有潜在的生物活性,也使这类化合物成为当今医药研发领域的热点。吡啶类化合物作为含氮杂环化合物的代表性物质,对于它的研究也愈来愈多。从结构与性质上分析,吡啶环和苯环是生物电子等排体,与苯环有着相似的结构和性质,都具有芳香性环的特点,但由于吡啶环是一个缺π电子体系,环碳原子的π电子是流向N原子的,环上的N原子有很强的吸电子作用使得整个环被钝化[1-3]。因此在合成药物中,如何将吡啶环快速有效的氢化也成为近年来大家研究的一个热点。对于氮杂环类化合物的催化氢化反应,主要有均相催化和多相催化这两类,其中以多相催化为主[4]。所用的多相催化剂中,用Ni作为催化剂的文献及专利报道的最多,为减少环境污染,降低工业生产成本和提高催化剂的性能,人们开始大量研究贵金属催化剂对于吡啶类化合物氢化的影响。碳载贵金属催化剂以其绿色环保、选择性好、催化效率高等优点一直备受科研工作者和化工企业的关注,但是如何在催化剂的制备过程中有效调节其选择性,提高催化效率一直是人们关注的焦点。影响负载贵金属催化剂性能的因素众多,至今尚难以在分子水平设计催化剂活性中心的微观结构。现在人们研究负载型贵金属催化剂性能的主要因素:催化剂的制备方法及其条件、载体种类、载体的预处理方法、金属负载量等。催化剂的催化活性组分在自然界中含量较少,价格昂贵。因此,提高催化剂的使用效率显得尤为重要。催化剂的效率除了和活性组分的种类相关外,还与活性组分的比表面积、孔隙率、微观及宏观构造等多种因素有关。而固体催化剂只在材料表面发挥催化作用,要制备高效率的催化剂,降低成本,就要使昂贵的活性组分充分的实现分散化,使单位质量的比表面积尽可能大。但是,高度分散的贵金属纳米颗粒非常不稳定,在反应过程中粒子容易发生团聚。因此除了选择合适的活性炭作为载体,调节吸附和还原的条件,人们了解到相对于单金属催化剂,在某些方面双金属催化剂的加氢活性更高,且选择性更好。这是由于双金属之间较强的协同作用,即双金属通过电子效应降低金属的结合能,使其更易被还原;通过空间作用使彼此得到分散,提高催化剂的分散度,同时可以降低金属-氢的键能,使氢更易溢出参与反应。因而双金属催化剂能在更温和的条件下对较难加氢的底物进行加氢,达到较为理想的结果,这一现象称为金属之间的“协同作用”[5-7]。
在本文中我们主要讨论了在不同溶剂、不同温度和不同压力的条件下,钯、钌、铑等贵金属分别负载在活性炭和氧化铝载体上的催化活性,通过调整反应温度和反应压力找到了在不同溶剂的条件下最佳的催化剂以及反应条件。
1 实验部分
1.1 催化剂制备
碳载催化剂:称取活性炭10倍质量的去离子水,倒入活性炭中,搅拌均匀。将相应活性组分(PdCl2、RuCl3、RhCl3)溶于稀盐酸溶液中,滴加到活性炭浆液中(金属负载量为5%),滴加60 min,继续稳定120 min,使用5%NaOH溶液调节碳浆pH值=8.0,继续稳定30 min,配制新鲜NaBH4溶液还原,过滤,洗涤至无氯离子,即得相应碳载催化剂。
氧化铝负载催化剂:称取氧化铝载体,称取相应活性组分(PdCl2、RuCl3、RhCl3)溶于稀盐酸溶液中,等体积浸渍24 h,150℃烘干24 h,配制新鲜NaBH4溶液还原,过滤,洗涤至无氯离子,即得相应氧化铝负载催化剂。
1.2 催化剂评价
催化剂评价条件为:氨基吡啶:15 g,乙醇/H2O:80 mL,催化剂:1.0 g,H2压力和温度见表1,反应时间见表1,反应转速:900 r/min,上述评价反应于250 mL智能高压反应釜中进行,加氢产物采用AgilentGC-7890A气象色谱仪分析。
2 结果与讨论
2.1 H2O体系中加氢的影响
氨基吡啶加氢制备氨基哌啶的路线如下所示:
杂环氢化一般需要在高温高压下进行,例如在水做溶剂的条件下,往往需要在150℃,5 MPa下进行加氢,且反应时间都较长。表1是不同催化剂,不同加氢条件下相应的催化氢化转化率。
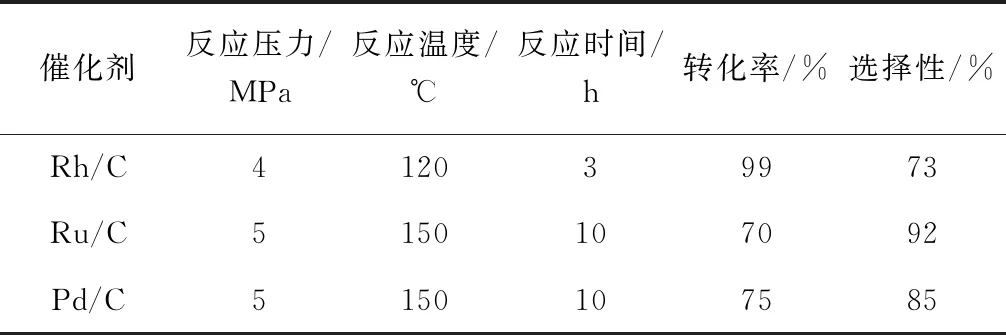
表1 水体系下不同催化剂的氢化效果
由表1可见,在水做溶剂的条件下,Rh/C的加氢活性最高,在反应压力为4 MPa,反应温度为120℃的条件下就可以达到99%的原料转化率,而且反应时间仅仅为3 h,但是产品氨基哌啶的选择性较差。Ru/C和Pd/C选择性较好,但是在更高的反应条件下原料的转化率仍然较低。考虑到反应条件比较苛刻,本反应尝试了粉末氧化铝负载的贵金属催化剂,并且在双金属协同作用下,筛选出了活性和选择性均较好的催化剂。
由表2可见,在以粉末氧化铝做载体所制备的相应催化剂中,除Ru/Al2O3以外,其余两种催化剂的催化活性均不及相应碳载催化剂活性高。但是,将Pd和Ru两种贵金属通过简单组合的方式所制备的双金属Pd-Ru/Al2O3催化剂却表现出优异的催化活性和高加氢选择性,而我们通常认为在杂环加氢中活性较高的贵金属Rh,无论是其自身还是与其它贵金属Ru和Pd的组合对于提高其活性和选择性均效果不佳。Pd-Ru/Al2O3双金属催化剂相对于单独的Pd/Al2O3和Ru/Al2O3催化剂,其活性均有明显提高,而选择性和Ru/Al2O3催化剂相比也没有明显的降低。这说明双金属之间的协同作用对于3-氨基吡啶的加氢反应的催化起了很大的促进作用。大量的研究表明这可能是因为双金属之间较强的协同作用,即双金属通过电子效可以降低金属-氢的键能,使氢更易溢出参与反应。因而双金属催化剂能在更温和的条件下对较难加氢的底物进行加氢,达到较为理想的结果。
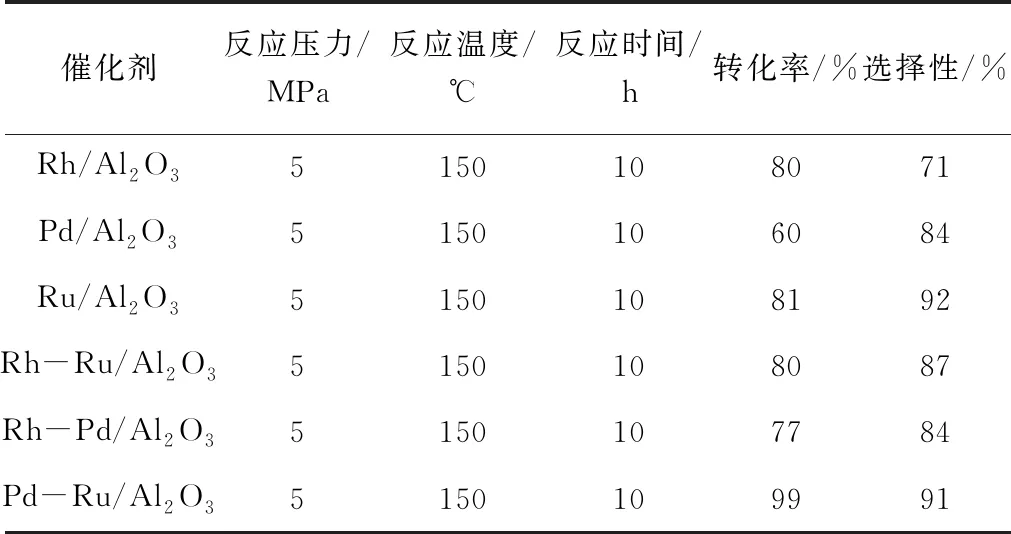
表2 氧化铝负载催化剂的氢化效果
2.2 乙醇体系中加氢的影响
在考察了水体系中贵金属催化剂的协同作用后,我们将反应溶剂换成乙醇,继续考察在乙醇体系中是否也存在此类效果。
由表3可见,我们发现原来在水体系中反应良好的Pd-Ru/Al2O3在乙醇体系中却失去了作用。我们分析可能是因为水的离子性要好于乙醇,在无水乙醇中3-氨基吡啶更加的难以离子化,从而使加氢反应难以进行。我们尝试了Ru/C对反应的影响,实验结果显示仍然有40%的原料没有转化掉。Rh/C的催化活性虽然高于Ru/C,但是在10 h内原料仍有剩余。于是,通过共同浸渍的方法我们制备了Rh-Ru/C催化剂,但是在具体反应中,其活性与Rh/C相似,甚至活性还有所降低。但是通过分别制备Ru/C和Rh/C,并将其共同投入到氨基吡啶的加氢反应中却表现出较好的活性和选择性。分析原因,可能实在共浸渍的过程中Ru和Rh由于电子效应而存在竞争吸附的情况,此时的协同作用却起到了不好的影响,但是当把单独制备的Ru/C和Rh/C催化剂共同投入到反应中时,也可以起到正向的协同作用,这说明金属间的协同催化作用并不一定是要制备合金催化剂,只是简单的机械混合在催化加氢反应中也有可能起到较好的催化效果。
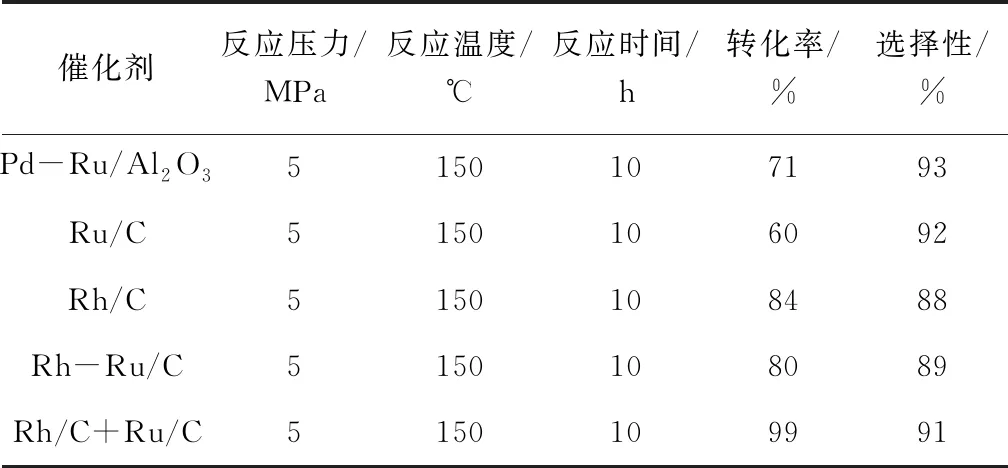
表3 乙醇体系中不同催化剂的氢化效果
3 结论
本文分别研究了在水体系和无水乙醇体系中单金属和双金属催化剂对3-氨基吡啶加氢3-氨基哌啶的影响。发现,在水体系中,Pd-Ru/Al2O3合金催化剂的催化效果要明显优于相应的单金属催化剂,而Rh/C催化剂的催化活性虽然很高,但是选择性略差。在无水乙醇体系中,通过共浸渍制备的合金催化剂并没有起到正向的协同作用,反而是通过催化剂之间的物理混合就可以有效的提高反应效率,这一简单的操作方法也为多金属协同催化提供了新的思路。
