中美经贸协议下的药品专利期限补偿制度研究
2020-07-27邱福恩
邱福恩
(武汉大学国际法研究所,武汉430072)
引言
美国东部时间2020年1月15日,中美双方在美国华盛顿签署《中华人民共和国政府和美利坚合众国政府经济贸易协议》[1](以下简称“中美经贸协议”),其中第1.12条“专利有效期的延长”第二款第(二)项规定了药品专利期限补偿制度:“对于在中国获批上市的新药产品及其制造和使用方法的专利,应专利权人的请求,中国应对新药产品专利、其获批使用方法或制造方法的专利有效期或专利权有效期提供调整,以补偿由该产品首次在中国商用的上市审批程序给专利权人造成的专利有效期的不合理缩减。任何此种调整都应在同等的限制和例外条件下,授予原专利中适用于获批产品及使用方法的对产品、其使用方法或制造方法的专利主张的全部专有权。中国可限制这种调整至最多不超过5年,且自在中国上市批准日起专利总有效期不超过14年。”如何落实中美经贸协定这一义务,建立中国的药品专利期限补偿制度,是当前的一项重要课题。
一、药品专利期限补偿制度简介
药品专利期限补偿制度,是指为了补偿药品上市审批过程所占用的有效专利保护期,延长该创新药相关专利保护期的制度。美国于1984年通过Hatch-Waxman法案,在全球首次建立了药品专利期限补偿制度,此后日本和欧洲等创新药产业发达的国家和地区也相继建立了类似制度。除此以外,澳大利亚、新加坡、韩国、加拿大等国家也根据与美国、欧盟签订的国际条约或根据自身需求,建立了药品专利期限补偿制度。
中国药品专利期限补偿制度也早已提上议事日程。2017年10月8日,中共中央办公厅和国务院办公厅联合印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(以下简称《意见》)第(十七)项就规定了“开展药品专利期限补偿制度试点”,要求“选择部分新药开展试点,对因临床试验和审评审批延误上市的时间,给予适当专利期限补偿”。2019年1月4日,全国人大法工委公开征求意见的《专利法修正案(草案)》也规定了专利期限补偿条款。
中美经贸协议的规定,意味着建立药品专利期限补偿制度成为了中国的国际义务。也就是说,建立药品专利期限补偿制度已成为了必然,而且设计的具体制度需要符合协议规定。然而,中美经贸协议相关规定相对原则,在具体制度的移植和构建中,仍然还存在根据国内产业发展需求进行调整的空间。为此,探寻药品专利期限补偿制度的理论基础与主要国家和地区的实践经验,并在此基础上构建符合中国实际的具体规则,是落实中美经贸协议的必然选择。
二、药品专利期限补偿制度理论基础
药品专利期限补偿制度在专利20年保护期的基础上,对符合条件的专利权给予一定时间的保护期限延长①与美国和日本的专利期限补偿制度不同,欧盟通过补充保护证书(Supplementary Protection Certificates,SPC)在药品基础专利保护期限届满后对相关药品提供保护。从法律上来说,SPC并不是基础专利保护期的延长,而是特别的知识产权类型。但在效果以及相关条件设置上,SPC与专利期限补偿类似,因此在本文中一并分析,并统称为“药品专利期限补偿制度”。。一般认为,这一制度的目的主要在于补偿专利权人因获得药品上市许可所占用期限,激励医药产业创新。
(一)专利保护期限“补偿”说之质疑
“补偿”说认为,建立药品专利期限补偿制度的目的在于对药品上市审批程序所占用的有效专利保护期限进行补偿。与其他不需要上市行政审批的产品相比,药品上市审批所需要的临床试验、行政审批占用了大量的专利权有效保护期限,使得药品专利的有效期要大大缩短,因此需要对这些被占用的期限进行补偿[2]。需要补偿的期限主要分为两部分:一是因临床试验所占用的专利保护期;二是行政审批程序所占用的时间。“补偿”说也明确规定在中美经贸协议之中。根据协议,调整药品专利保护期限的目的是“补偿由该产品首次在中国商用的上市审批程序给专利权人造成的专利有效期的不合理缩减”。
“补偿”说建立在专利有效保护期被“不合理缩减”基础之上。这一理论成立的前提在于药品专利有效期确实存在被“缩减”的现象,且这种“缩减”是“不合理”的。
“补偿”说认为被“缩减”的药品专利有效期指的是从专利授权至药品获得上市许可之间这段时间的专利保护期。产生这一现象的根源在于专利授权条件与药品上市许可条件之间的巨大差异。根据主要国家的专利法规定,药品专利申请只需要满足新颖性、创造性、实用性以及充分公开等专利性要求即可获得授权。实践中,为证明符合专利性要求,申请人往往只需要在申请文件中记载分子和细胞层面的试验结果即可,而不需要记载临床试验数据,甚至连动物试验数据都不是必需。而药品上市许可则不同,审查的是药品有效性和安全性,需要申请人提交符合要求的包括临床试验在内的大量试验数据。因此新药开发的一般流程是:首先,设计、合成大量新化合物,对这些化合物医药用途进行初步分析筛查,并对有初步证据证明具有“效果”的化合物申请专利;其次,对初步筛选得到的化合物逐步进行更加深入的动物试验、临床试验;最后,证明符合安全性、有效性等要求的药品获得上市许可。
从理论上来说,为缩短药品上市许可所占用的有效专利保护期,申请人可以推迟专利申请时间。专利申请时间越接近获得上市许可的时间,则药品在获得上市许可后的专利保护期限越长。然而,在实践中几乎没有制药企业会采取这种策略。这是因为,当前主要国家和地区的专利制度均采取“先申请制”,在医药产业竞争极其激励的情况下,如果申请人推迟专利申请时间,很有可能被竞争对手抢先申请专利或公开相关方案,从而导致前期研发投入付诸东流。药品开发是一个高投入、低成功率的过程,进入临床试验的化合物中,最终仅有十分之一左右能获得上市许可[3]。为此,药物开发者在开发出具有潜在医药用途的新化合物后,为了确保后续研发投资的安全性,必然会选择尽快提交专利申请。专利申请实际上成为了“圈地”行为,而进一步投资开发药物则相当于在已“圈定的土地上”进行进一步开发利用。
专利制度本质上是一种排他权,体现在他人未经权利人许可不得实施其专利技术,这与权利人是否实施该专利技术并不存在直接关系。显然,药品专利获得授权后,就已经为权利人提供了独占权保护,而不存在所谓被“占用”的期间。换言之,药品获得上市许可之前的这段专利保护期已经发挥了独占权作用,给权利人提供切实的保护和利益。这种利益主要体现在,专利权人通过专利“圈地”,能够有效阻止竞争对手进入,确保后续大规模研发投资的安全性。在专利保护已发挥作用、未被“占用”的情况下,也就不存在所谓的专利保护期限“缩减”,更不存在“不合理缩减”。因此,专利期限“补偿”说缺乏足够的法理和事实基础。
(二)医药产业创新“激励”说之辨析
“激励”说立足于通过给予药品专利权人更长时间的市场独占期,激励更多的市场主体投入医药领域创新。“激励”说与“补偿”说存在一定关联,但与“补偿”说不同的是,“激励”说并不关注药品获得上市许可前的专利保护期是否被“不合理占用”,而是立足于药品获得上市许可后专利保护期限不足以给予创新者足够的激励。例如,欧洲议会1992年颁布的“补充保护证书条例”[4](Supplementary Protection Certificates,简称SPCs)前言中指出,因专利申请日与药品上市日之间的期限间隔,导致药品获得上市许可后剩余的专利保护期不足以帮助权利人收回研发成本;这使得医药创新缺乏足够的保护,并可能导致欧洲的医药研发中心转移到提供了更强创新保护的其他国家。
“激励”说成立的前提是药品获批上市后在剩余的市场独占期内不足以获得足够的利润回报,因此必须要通过补偿专利保护期限来延长市场独占期。然而,无论是个案分析,还是行业分析,都表明即便没有专利期限补偿制度,大多数情况下药品上市后剩余专利保护期也足以使创新者获得足够的利润。例如,对美国2006年1月1日至2015年12月31日新上市的十个抗癌药物研发成本和利润进行分析发现,这些药品在批准上市后的中位数4.0年(范围是0.8年至8.8年间),总销售收入达到670亿美元,而总研发投入则为72亿美元(计入机会成本则为91亿美元)[5]。对吉利德公司的索非布韦、诺华公司的伊马替尼和罗氏公司的曲妥珠单抗进行个案分析也发现,这几个药物在批准上市后3年内的销售收入就已超过研发成本,而此时距基础专利保护期届满仍有10年以上[6]。从行业统计数据来看,制药企业的平均净利润率高于其他行业[2],也没有给予“特殊照顾”的必要。
给予新药更长的市场独占期虽然能为制药企业带来更高的利润,但从统计数据情况来看,这也并没有对医药产业创新带来更多的激励。表1[7]统计了1989年至2018年30年间全球新上市创新化学或生物实体药物数量及其来源国家或地区分布。如表1所示,这30年间全球新上市创新药数量并未明显增长,甚至在1999-2013年这15年期间,还出现下降趋势。考虑到作为全球医药创新中心的美国、欧洲和日本分别于1984年、1992年和1987年建立了药品专利期限补偿制度,这一统计数据并未显示出专利期限补偿制度对创新药产业的激励效果。从国家和地区角度来看,欧洲医药公司在1989-1993年期间新上市创新药占到了全球近二分之一,但在20年后的2014-2018年期间则下滑至四分之一。日本也与欧盟类似,尽管其早在1987年就建立了药品专利期限补偿制度,但在全球创新药产业中的地位仍下降明显。1989-1993年的5年间,日本医药公司新上市创新药占到了全球近三分之一,但在2014-2018年期间则下降至八分之一。反观美国公司,则在这30年期间无论是创新药数量还是全球占比,均呈现明显的增长趋势。
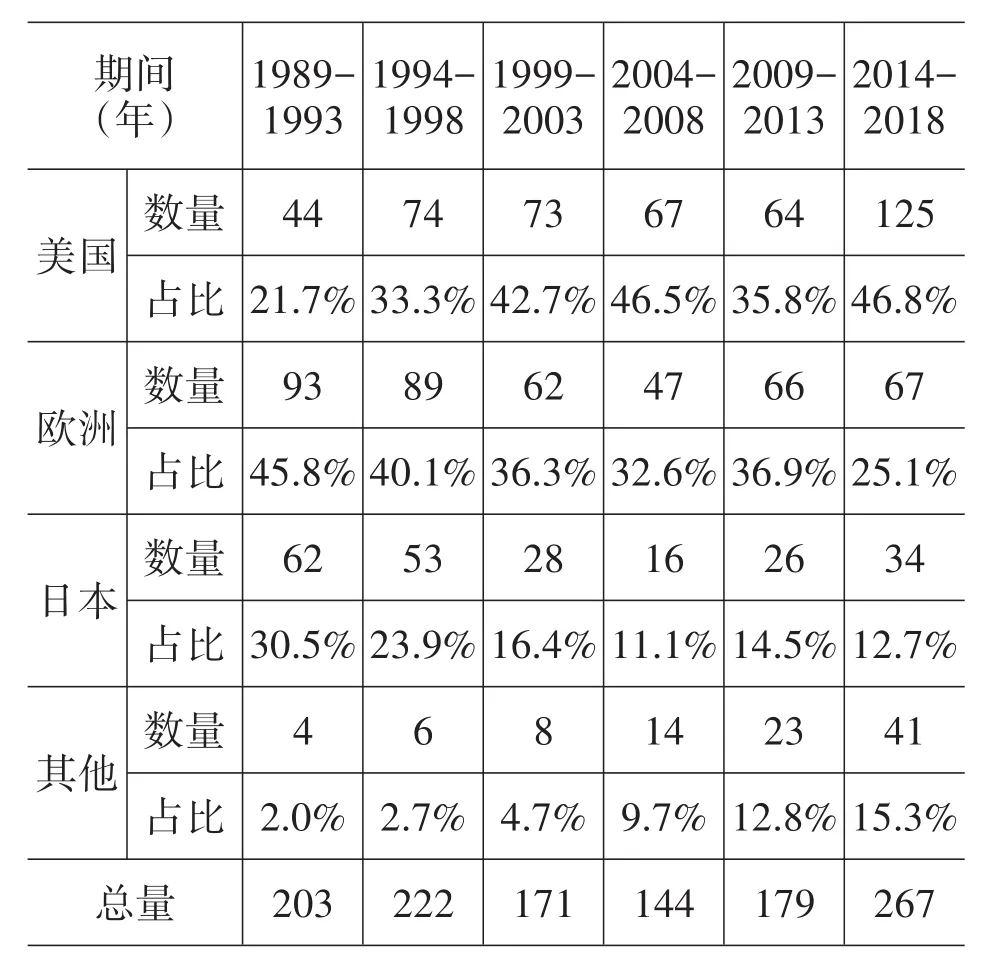
表1主要国家/地区医药公司上市的创新化学或生物实体药物数量及其占比
除美国、日本和欧洲外,韩国、澳大利亚、新加坡等国家也建立了药品专利期限补偿制度,但这些国家并未因此而促进了医药创新产业发展。例如,韩国尽管早在1987年就引入了药品专利保护延期制度,但其医药创新产业并未取得太大的发展,过去30年间,韩国医药公司获批上市的新药仅有33个[8]。因此,药品专利期限补偿制度的创新“激励”说也缺乏必要的实证支撑。
(三)小结与建议
从全球来看,自美国1984年Hatch-Waxman法案起,药品专利期限补偿制度已有近40年历史,但关于这一制度必要性的争议一直存在。
医药企业游说各国立法机关建立这一制度的主要理由在于,其专利保护期限被药品上市许可所需试验及行政审批所“不合理占用”。但是,作为一项排他性权利,药品专利自授权之日其就能够有效地禁止他人未经权利人许可实施其专利,从而确保了专利权人后续研发投资的安全性,因此不存在对专利保护期限的任何“不合理占用”。立法机关在为这一制度寻求正当性支持时,主要基于“激励创新”的目的,认为给予专利药更长的市场独占期能够吸引更多的投资进入医药创新行业,从而激励研发出更多的新药。然而,药品专利期限补偿的“激励创新”作用并没有得到实证数据的支撑。
在中美签订经贸协议之前,中国已将这一制度的建立提上了议事日程。但是,中国主动引入这一制度的目的主要在于促进药品进口。2018年4月12日,国务院常务会提出,“对在中国与境外同步申请上市的创新药给予最长5年的专利保护期限补偿”,其目的就在于“鼓励创新药进口”[9]。《专利法修正案(草案)》公开征求意见稿也将“在中国境内与境外同步申请上市”作为条件之一,延续了国务院常务会的精神。然而,中美经贸协议签订并生效后,直接将“在中国境内与境外同步申请上市”作为专利期限补偿条件可能与协议规定不一致,通过建立药品专利期限补偿制度促进创新药进口的目的也难以实现。
但另一方面,药品专利期限补偿制度必然会延长专利药市场独占期,延缓仿制药上市时间,推迟药品价格“专利悬崖”的到来,影响药品可及性和公共健康问题的解决。此种情况下,中国引入专利期限补偿制度,应以落实协议最低义务为主,而不宜规定超出协议义务的制度。
三、中美经贸协议下的药品专利期限补偿规定
中美经贸协议规定虽然相对原则,但对药品专利期限补偿制度适用的实体条件作出了明确规定。分析这一规定下具体条件及相关实施方式,是落实中美协议义务、制定中国药品专利期限补偿制度的基础。
(一)专利期限补偿条件
根据中美经贸协议,专利期限补偿制度适用于在中国获批上市新药的产品及其制造和使用方法专利。这从药品和专利类型两个方面规定了专利期限补偿制度适用范围的最低要求。
1.可获得期限补偿的药品
中美经贸协议规定,专利期限补偿制度适用于在中国获批上市“新药”的相关专利。从技术角度,新药可进一步细分为新活性成分、活性成分新组合、新适应症、新剂型以及新用法、用量等不同类型。为此,确定制度适用范围的首要前提是确定“新药”的范围。中美经贸协议未对“新药”进行定义,需要由国内法作出规定,这也是协议所提供的“灵活度”之一。从国外实践来看,针对哪些类型的创新药提供专利期限补偿,不同国家和地区的做法并不完全一致。
在美国,能够获得专利期限补偿的药品是“首次获得批准上市或使用的药品”[10]。由于是否属于相同的药品取决于药品所包含的活性成分[11],因此,这一条件又可转换为:相关药品所包含的活性成分为首次获得批准上市或使用。换言之,只要药品所包含的活性成分此前已获得批准上市,则针对该药品所作任何改进均不能获得专利期限补偿。对于包含两个及以上活性成分的药品而言,获得药品期限补偿的条件是其中必须要包含至少一个首次获得批准上市的活性成分。由于活性化合物可呈现为酸、盐、酯等不同的形式,还可具有不同的异构型。因此,实践中对“新活性成分”判断的主要争议问题是,同一化学部分(chemical moiety)的不同形式是否属于相同活性成分。在Glaxo Operations UK Ltd.v.Quigg一案[12]中,美国联邦巡回上诉法院指出,尽管头孢呋辛(Cefuroxime)的盐已获得批准上市,但头孢呋辛酯(Cefuroxime Axetil)尚未批准上市,因此,头孢呋辛酯相关专利仍然能获得专利期限补偿。在此判例基础上,美国专利商标局《专利审查程序手册》规定,同一化学部分的盐和酯形式应当被认为是不同的活性成分,即便它们可用于治疗相同的疾病;因此,如果药品所包含的活性成分本身或其盐(或酯)尚未批准上市,则该药品相关专利可获得期限补偿[13]。
在欧盟,获得补充保护证书(Supplementary Protection Certificates,简称SPC)的条件之一是,申请SPC的药品所包含的活性成分是在其成员国及冰岛、挪威、列支敦士登和瑞士首次批准上市。这一规定与美国类似,也就是说对于新适应症、剂型、用法和用量等方面的改进,不能获得SPC。由于SPC由欧盟成员国给予,实践中,不同国家对于活性成分的理解并不完全相同。以英国为例,通常将活性成分解释为包含任何紧密关联的衍生物,尤其是盐和酯,除非能够证明该衍生物是新的活性成分[14]。
与美国、欧盟不同,日本并不要求作为专利期限补偿基础的药品所包含的活性成分为首次批准上市。也就是说,对于已上市药品在适应症、剂型、用法、用量等方面进行改进后的改良型新药,也可以作为获得专利期限补偿的基础。显然,在可获得专利期限补偿的药品条件上,日本比美国和欧盟更为宽松。
2.可获得期限补偿的专利
一个药品可以有多个不同专利的保护,例如化合物专利、组合物专利、使用方法专利、制备方法专利、中间体专利、剂型专利等。根据中美经贸协议,中国将来建立的药品专利期限补偿制度至少要适用于产品专利、产品制造方法和使用方法专利。但中美经贸协议没有规定对于同一药品在符合其他条件的情况下,是否应当同时给予多个专利期限补偿,还是可以仅给予一项专利期限补偿。此外,专利保护范围与药品之间的关系,即如何判断一个专利是否属于“新药的”专利,也是各国药品专利期限补偿制度实践中的一个重点和难点,但对此中美经贸协议未做规定。
在美国,可获得专利期限补偿的专利是请求保护获批上市药品的产品、治疗用途或制备方法专利,但一个药品只能选择一个专利进行补偿,一个专利也只能补偿一次。对于专利与药品之间的关系问题,美国专利商标局《专利审查程序手册》规定,药品的产品专利是指其保护范围涵盖上市药品本身的专利。其中,药品是指活性成分以及包含该特定活性成分的组合物。其他产品专利,例如代谢物专利,虽然制造、使用和销售相关药品也可能构成侵犯其专利权,但由于药品本身未落入其保护范围而不能获得期限补偿[15]。在Hoechst-Roussel Pharmaceuticals,Inc.诉Lehman一案[16]中,联邦巡回上述法院维持USPTO的决定,认为由于请求人批准上市的药品为盐酸盐酸他克林(tacrine hydrochloride),而其请求获得期限补偿的专利保护的是代谢产物1-羟基-他克林(1-hydroxy tacrine),因此不能获得期限补偿。在该判决中,法院进一步指出,“保护范围”的判断并不等同于“是否侵犯专利权”的判断,专利侵权涉及直接侵权、间接侵权等情况,而且还可能需要考虑等同侵权原则的适用。但遗憾的是,联邦巡回上诉法院并未明确回答“请求保护的范围”是否包含通过等同原则所确定的范围这一问题。
在欧盟,根据SPC条例,SPC所依赖的基础专利应当是保护药品本身、药品制备方法或治疗用途的专利。一个药品只能基于一个基础专利获得SPC;但在符合其他条件的情况下,两个以上的药品可以基于同一个基础专利分别获得SPC。与美国类似,欧盟SPC制度面临的一个重要问题是,如何确定批准上市的药品是否受到基础专利的保护。针对这一问题,不同国家在实践中形成了两种不同的方法:“侵权测试法”和“披露测试法”。例如,对于以保护活性成分A的专利作为基础,请求获得保护A+B的SPC的申请,这两种测试法将得出完全不同的结论。适用侵权测试法,由于制造、使用和销售药品A+B必然会侵犯活性成分A的专利权,因此,将得出应当给予保护A+B的SPC的结论。而适用披露测试法,则会认为,只有活性成分A的专利中明确披露了A+B这一组合,才能给予保护A+B的SPC[17]。对于这一争议,欧盟法院(CJEU)在Medeva案[18]中给出了结论。CJEU在判决中指出,确定某一药品是否受到基础专利保护时,应当判断该药品活性成分是否在权利要求中有明确规定,而不是判断生产、销售、使用该药品是否会侵犯基础专利的专利权。此后,在Eli Lilly案中[19],CJEU进一步明确,活性成分受到权利要求的保护,并不要求必须在权利要求中通过结构式的方式明确规定该活性成分,在功能限定的情况下,如果阅读说明书后能够确定权利要求的范围涵盖了该活性成分,也不排除授予SPC。
日本判断专利是否符合获得期限补偿条件的标准是,相关药品行政审批程序是否为实施该专利所必须。就专利类型而言,除了明确排除的制备药品所需的中间体、催化剂以及生产设备专利外,其他类型的专利只要符合前述标准,均可获得期限补偿。与美国、欧盟不同,在日本,基于同一个药品可获得保护期限补偿的专利数量不受限制,且同一个专利也可获得多次补偿,只要满足专利法规定的补偿条件即可。根据日本特许厅《专利审查指南》规定,如果经过行政审批上市的药品包含了相关专利任何权利要求的所有技术特征,则该专利可以获得期限补偿。也就是说,对于专利与药品之间的关系,日本审查实践采取的也是“落入保护范围”的标准,且排除了“等同原则”的适用。
3.小结与建议
从医药创新最为发达的美国、欧洲和日本的制度情况来看,美国和欧盟均对药品专利期限补偿设置了较为严格的条件。在药品方面,美国和欧盟均规定只有包含首次批准上市活性成分的药品,才能够获得专利期限补偿;而在专利类型方面,美国和欧盟也较为一致,规定只有保护药品的产品、治疗用途或制备方法专利才能获得补偿,且一个药品只能选择一个专利进行补偿。与美国和欧盟相比,日本药品专利期限补偿的条件则相对宽松:既没有对作为期限补偿基础的药品类型作出规定,也没有限定可获得期限补偿的专利类型,而仅是从反面排除了中间体、催化剂以及生产设备专利获得专利期限补偿的资格;而且,基于同一药品可以使多个专利获得期限补偿,一个专利也可获得多次补偿。案例分析也表明,如果进行有效地、持续地专利布局,理论上在日本可以获得比欧美更长的药品专利保护期[20]。
然而,更加宽松的药品专利期限补偿条件并未进一步促进日本医药创新产业的发展。虽然日本从上世纪80年代以来一直是继美国、欧洲之后的第三大创新药来源地,但其无论是创新药绝对数量还是全球占比,均呈现下降趋势(见表1)。即便是在日本国内市场中,日资企业所占市场份额也不断被欧美等外资企业所“蚕食”,外资医药企业所占市场比例逐年增高,从1988年的22.7%[21]增长至2013年的41.5%[22]。
如前文所述,药品专利期限补偿制度在激励医药产业创新中的作用并没有得到实证支撑,但过长的专利保护期将影响药品可及性却是不争的事实。在这种情况下,中国在落实中美经贸协议时,需要对可获得补偿期限的药品和专利类型作出严格的限制。对于专利类型,中美经贸协议已作出了明确规定,包括产品专利、产品制造方法和使用方法专利。尽管如此,中国仍然可在国内法中进一步明确一个药品只能获得一个专利的期限补偿,而且一个专利也仅能获得一次期限补偿。同时,对于专利保护范围和药品之间的关系,也可以借鉴国外经验,采取“落入保护范围”的标准,并明确排除“等同侵权”“间接侵权”等原则的适用。
而对于期限补偿制度适用的药品类型,中美经贸协议仅规定为“新药”,留给中国国内法规定的空间较大。根据2020年3月国家市场监督管理总局发布的《药品注册管理办法》(市场监管总局令第27号),化学新药和生物新药均包括创新药和改良型新药两大类。2019年1月公开征求意见的《专利法修正案(草案)》规定药品专利期限补偿制度的适用对象是“在中国境内与境外同步申请上市的创新药品发明专利”。虽然“在中国境内与境外同步申请上市”的要求与中美经贸协议可能存在冲突,但中国仍然可以对“创新药品”作出严格限定,规定为仅包括新活性成分药品,而不包括对已知活动成分改变盐、酸、酯等形式后的药品,也不包括已知活性成分的异构型、晶型等,更不包括剂型、剂量等的改良型新药。
(二)补偿期限的计算
中美经贸协议没有规定药品专利期限补偿的计算方式,而仅规定“中国可限制这种调整至最多不超过5年,且自在中国上市批准日起专利总有效期不超过14年”。这意味着,中国可以根据自身需求设计合适的计算方式。
1.主要国家和地区的规定
与在法律中为基础专利规定固定保护期限不同,美国、欧盟和日本等建立了药品专利期限补偿制度的国家和地区均通过一定的计算方式来确定给予补偿的期限,以实现制度的公平。但不同国家和地区在具体计算方式上也存在很大的差异。
美国药品专利期限补偿时长取决于试验阶段和审批阶段所耗时长。试验阶段是指从临床研究申请(INDA)被批准到提交新药申请(NDA)之间的时间间隔。审批阶段是指提交新药申请(NDA)到通过FDA审批获得上市批准的时间间隔。为计算期限补偿时长,首先需要分别减去试验阶段和审批阶段中申请人的未尽责时间,然后将试验阶段时长的0.5倍与审批阶段时长相加,得到补偿期限。也就是说,专利期限补偿PTE=(试验阶段 -未尽责时间)×50%+(审批阶段-未尽责时间)。由此计算得到的补偿期限还受到两个最长期限的限制:一是补偿期限最长不超过5年;二是从药品获得FDA批准之日起计算,专利原剩余保护期限加上补偿期限的总保护期限不得超过14年。
欧盟SPC期限等于专利申请日和首次在欧盟国家或冰岛、挪威、列支敦士登、瑞士首次批准上市日之间的时间间隔期减去5年,但最长不得超过5年。
日本药品专利期限补偿期间包括临床试验和上市审批两个阶段所花费的时间。具体来说,是从药品专利获得日本特许厅授权之日或从对该药品进行临床研究之日(以两者较晚者为准)到药品上市获得药品审批部门批准之日的时间间隔,但最长不得超过5年。
2.小结与建议
美日欧的补偿期限计算方式上虽存在区别,但从本质上来说都体现了“补偿”理论,即对药品上市审批过程所占期限进行补偿。
日本和美国计算方式较为相似,其主要区别在于,对于临床试验所占用的时间,日本全部给予补偿,而美国则仅补偿一半。而欧盟计算方式则是相当于认可了5年时间的“合理”占用期限,只有在超过这一期限内仍未获得上市的,才能就所超出期限获得补偿。从三个国家和地区的比较来看,美国期限补偿计算方式最为严格,欧洲次之,日本则最为宽松。
关于补偿期限的计算,《专利法修正案(草案)》公开征求意见稿规定了最长不超过5年,且药品上市后有效专利保护期不超过14年的补偿期限,这与中美经贸协议规定相一致,但也未规定具体计算方式。由于补偿期限计算方式较为复杂,且涉及药品管理法中有关药品临床试验和行政审批等程序,相关具体计算方式和程序由相关下位的《专利法实施细则》《专利审查指南》等行政法规、规章作出规定不失为更为妥当和理性的方案。在具体计算方式上,尽管美国规定的计算方式与欧盟和日本相比更为复杂,但却相对更为合理。尤其是,在计算时不仅将药品上市申请人未尽责时间扣除不予补偿,而且对于临床试验所占用时间也仅补偿一半,也即由公众和专利权人各自承担一半的临床试验时间,在制度设计上更为公平,值得中国借鉴。
(三)补偿期内的专利效力和保护范围
中美经贸协议规定,专利期限补偿期内,应当“授予原专利中适用于获批产品及使用方法的对产品、其使用方法或制造方法的专利主张的全部专有权”。该规定明确了补偿期限内的专利效力和保护范围。
就效力而言,协议规定补偿期限内的专利具有原专利权的全部专有权。中国专利法规定,专利所赋予的专有权包括禁止他人未经许可为生产经营目的制造、使用、许诺销售、销售、进口其专利产品,或者使用其专利方法以及使用、许诺销售、销售、进口依照该专利方法直接获得的产品。根据中美经贸协议规定,补偿期限内的专利也享有所有的这些专有权。
同时,中美经贸协议也对补偿期限内的专利保护范围作出了限制,即“适用于获批产品及使用方法的对产品、其使用方法或制造方法”。一般来说,作为期限补偿基础的专利权保护的是一个较大范围,其不仅涵盖批准上市的药品本身,还可能涵盖其他并列技术方案,例如与上市药品类似的化合物、组合物、用途或制备方法等。但补偿期限内的保护范围则在此基础上进行了限缩。具体而言,专利期限补偿的基础有两个:一是对上市药品提供保护的有效基础专利保护范围;二是上市药品及其用途。补偿期内的专利保护范围也以这两者为基础,即在基础专利权利要求保护范围内,限缩至获批上市药品及其用途所限定的特定技术方案。美国、欧盟和日本专利期限补偿制度均体现了这一原则。
1.主要国家和地区的规定
根据美国专利法,可以获得期限补偿的专利包括产品专利、使用方法专利和制备方法。对于产品专利,补偿期内的保护范围仅限于上市药品被批准上市的用途;对于使用方法专利,补偿期内的保护范围仅限于受专利保护且上市药品获批的用途;而对于产品制备方法专利,补偿期内的保护范围仅限于制备获批上市产品的方法。在Merck Co.,Inc.诉Kessler一案[23]中,联邦巡回上诉法院在判决中指出,“补偿期内的专利保护不会延伸至受该专利保护的所有产品,而仅延及作为补偿基础的产品”。
欧盟SPC条例规定,SPC赋予权利人与原专利权相同的权利,但其权利范围受限于获批上市的药品及该药品在SPC保护届满前批准上市的用途。也就是说,SPC保护范围一方面受到基础专利的限制,另一方面又受到所批准上市的产品及其用途的限制。
与美国和欧盟类似,日本也将补偿期内专利保护范围限定至用于特定用途的药品。日本《专利法》第六十八条之二规定,“专利权保护期限已延长的(包括根据第六十七条之二第五款规定视为延长的),该专利权的效力不及于以下行为以外的行为:针对作为办理延长登记理由的、第六十七条第二款政令规定的处分对象物(如果处分中规定了使用该物的特定用途,则为用于该用途的物)实施专利发明”。
2.国外实践中的主要争议问题
药品专利期限补偿制度建立以来,美国、欧盟和日本均在侵权司法判例中,对补偿期内的专利保护范围作出了进一步解释。从相关案例情况来看,关于补偿期内权利保护范围主要存在以下两个方面的争议:一是在基础专利保护活性成分化合物的情况下,补偿期权利保护范围是否延及上市药品活性成分的衍生物,例如其他形式的盐或酯等;二是在基础专利保护活性成分化合物或包含活性成分的组合物的情况下,补偿期内的权利保护范围是否延及在上市药品基础上增加其他活性或非活性成分形成的组合物。对于上述两个问题,美国、日本和欧盟在司法实践中的处理方法并不完全相同。
对于第一个争议问题,美国和欧盟均在判例中认为,补偿期内的专利权保护范围不仅仅限于原研药使用的化合物本身,而是延及活性成分其他形式的简单衍生物,日本则尚未出现类似案例。
美国法院就这一争议问题作出解释的案例是“Pfizer Inc.诉 Dr.Reddy's Laboratories,Ltd.”案[24]。在该案件中,Pfizer是美国4,572,909号专利的权利人,该专利保护的是二氢吡啶及其酸加成盐,其中包括通用名为氨氯地平的化合物及该化合物的盐。Pfizer公司基于获得FDA许可上市的以氨氯地平苯磺酸盐作为活性成分的抗高血压、抗局部缺血药物Norvasc,获得了专利期限补偿。在基础专利保护期届满进入补偿期限后,Dr.Reddy’s向美国FDA申请活性成分为氨氯地平马来酸盐的药品上市,其适应症与Pfizer获批上市的药物适应症相同。Pfizer认为Dr.Reddy’s侵犯了其专利权,而Dr.Reddy’s则认为,在补偿期内,4,572,909号专利保护范围仅限于Pfizer注册上市的氨氯地平苯磺酸盐,而不包括氨氯地平马来酸盐。对此,联邦巡回上诉法院认为,补偿期内的专利权应当覆盖活性成分化合物及其可药用盐和酯。具体到本案,FDA批准Pfizer上市氨氯地平苯磺酸盐,但其活性成分为氨氯地平,因此,补偿期内的4,572,909号专利保护范围包括氨氯地平及其任何盐或酯,而不限于氨氯地平苯磺酸盐。为此,Dr.Reddy’s侵犯了Pfizer延期保护的专利权。
欧盟则由CJEU通过Farmitalia一案[25]对该问题进行了明确。在该案件的判决中,CJEU指出,如果药品上市许可中所涉特定形式的化合物受原基础专利保护,则基于该上市药品的SPC保护范围也延及包含该化合物其他形式的药品,只要这些其他形式的化合物也受原专利保护。法院指出,如果SPC仅保护上市药品中包含的特定形式的化合物,则在基础专利到期后,竞争者将能够利用该化合物的其他形式(例如其他盐)作为活性成分获得上市许可,这与SPC制度的设立初衷相违背。
对于前述第二个争议问题,美国没有相关判例,而欧盟和日本的做法也存在区别。欧盟在案例中表明,这种情况下是否侵权的判断标准仍然适用于“全面覆盖”原则,即在受SPC保护的产品基础上增加其他成分,仍然属于侵权行为;日本则不再适用“全面覆盖”原则,而是代之以“相同”或“实质相同”原则,并在“实质相同”的判断中,将用成分、含量、用法、用量、效能、效果等均作为考虑因素。
在Novartis诉Actavis一案[26]中,CJEU确立了这样一个原则:如果针对用于X用途的药品A授予了SPC,只要其基础专利的权利人有权禁止包含A+B的药品上市,则SPC权利人也有权禁止用于X用途的包含A+B的药物上市。在该案件中,原告Novartis于1997年基于基础专利EP(UK)0 443 983和仅包含活性成分缬沙坦的药物代文(Diovan,用于治疗高血压)获得了SPC。在基础专利EP(UK)0 443 983保护期限届满后、SPC保护期限届满前,Actavis表明其将生产销售用于治疗高血压的缬沙坦与氢氯噻嗪复合制剂(称之为“复代文”)。为此,Novartis向法院起诉Actavis侵犯其SPC。CJEU在判决中指出,如果由某一活性成分组成的药品受到原基础专利的保护,并且专利权人可基于该基础专利权禁止他人上市包含该活性成分及一种或多种其他活性成分的药品上市,则基于该药品授予的SPC也应该能够禁止他人上市与该药品具有相同用途的包含该活性成分的其他药品。
日本知识产权高等法院则在首个涉及侵犯补偿期内专利权的案件判决中[27],明确了判断是否侵犯补偿期内专利权的两个原则:一是补偿期内的专利保护范围不仅受到原专利权利要求中相关技术特征的限制,而且还受到作为获得期限补偿基础的获批上市药品成分、含量、用法、用量、效能、效果等限制;二是落入专利保护范围的判断不再适用“全面覆盖”和“等同侵权”原则,而是代之以“相同”和“实质相同”原则②日本知识产权高等法院在判决还给出了实质相同的一些实例,包括:如果专利保护的是新活性成分,而仿制药基于惯用技术手段在原研药的基础上添加或替换了除活性成分以外的其他成分,则其与原研药实施相同;如果专利保护的是已知活性成分的组合物,而仿制药基于惯用技术手段在原研药的基础上添加或替换了部分成分,并且两种产品的技术特征和效果就专利而言是相同的,则两者实质相同;如果原研药与仿制药的区别对于“含量”、“用法”或“剂量”没有影响,则两者实质相同;如果原研药与仿制药的“含量”存在区别,但只要就“用法”和“剂量”而言可视为是相同的,则两者实质相同。。该案原告Debiopharm International SA拥有名称为“药学上稳定的奥沙利铂制备物”的专利(JP-B-3547755)。其独立权利要求1请求保护“肠胃外给药的药学上稳定的奥沙利铂制备物,包含奥沙利铂水溶液……”。基于获批上市的药物“ELPLAT静脉输注液”,原告获得了专利期限补偿。被告Towa医药公司在补偿保护期内生产并销售了ELPLAT的仿制药,该仿制药与原告生产的原研药在活性成分、用途、给药途径等方面均完全相同,其区别仅在于在原研药成分(奥沙利铂和水)之外增加了非活性成分浓缩甘油。原告认为被告侵犯了其延期保护后的专利权。知识产权高等法院在二审判决中指出,原研药与仿制药产品之间的区别在于是否包含了甘油,根据涉案专利说明书及申请人相关陈述,这一区别不能认为是非显著性的,本案中的被控侵权仿制药与原研药不实质相同。因此,法院认为被控侵权仿制药未落入补偿期内JP-B-3547755专利的保护范围。
3.小结与建议
补偿期内的专利保护范围问题是药品专利期限补偿制度的一个重要问题。从国外主要国家和地区实践情况来看,均对补偿期内的保护范围作出了限制,其目的在于平衡权利人和公众之间的利益。从立法上来看,美国、日本和欧盟在该问题上的规定较为一致,均规定补偿期内的专利保护范围限于上市药品相关技术方案。
从司法实践来看,围绕补偿期内专利侵权判定原则,不同国家和地区的做法存在较大区别。从美国和欧盟相关实践来看,补偿期内专利侵权判定标准与普通专利类似,不仅适用“全面覆盖”原则,甚至在一定程度上还能适用“等同原则”;而日本则采取与普通专利相比更为严格的标准,不再适用“全面覆盖”和“等同侵权”原则,而是代之以“相同”和“实质相同”原则。如前文所述,日本在期限补偿条件和计算方式上相较于美国和欧盟更为宽松。日本在延期后专利保护范围确定中采取相对严格的标准,可视为是在制度整体设计上的一种平衡。
关于补偿期限内的专利保护范围,《专利法修正案(草案)》公开征求意见稿没有作出规定。根据现行专利法第五十九条规定,发明专利权的保护范围以其权利要求的内容为准,说明书及附图可以用于解释权利要求的内容。如果不在专利法中对药品专利补偿期限内的保护范围作出限制,将直接适用该条规定,导致补偿期内的专利保护范围与基础专利一致,赋予了专利权人远超过与其所作贡献的权利范围,造成权利人和社会公众利益的失衡。为此,在落实中美经贸协议时,有必要在专利法中对补偿期限内的专利保护范围作出明确的限制性规定,即将其限制在仅适用于获批上市药品及其用途。
(四)补偿期内专利权的限制与例外
中美经贸协议还规定,补偿期内的专利权具有与其他专利权“同等的限制和例外条件”。而这在跨太平洋伙伴关系协定(TPP)和美墨加协定的专利期限补偿条款中均没有类似规定。
中美经贸协议作出这一规定的背景是,欧洲议会和欧洲理事会于2019年5月通过了第2019/933号欧盟条例,在第469/2009号欧盟条例第5条“SPC效力”基础上增加了“出口生产豁免”和“贮存豁免”的例外规定。具体而言,“出口生产豁免”是指,在SPC保护期限内,如果生产受保护的活性药物成分或者包含该活性成分的药品是为了出口至第三国的话,则该生产行为不构成侵权;“贮存豁免”则是指在不超过SPC保护期限届满之前的6个月内,如果生产受保护的活性药物成分或者包含该活性成分的药品是为了贮存并为SPC期限届满后立即进入欧盟市场做准备的话,则该生产行为不构成侵权[28]。也就是说,与基础专利权相比,第2019/933号欧盟条例为SPC规定了额外的限制和例外。这些限制与例外有利于欧盟仿制药产业的发展,尤其是有利于欧盟仿制药的出口,但这将直接影响到专利权人的利益。
为了堵住这一“漏洞”,避免中国借鉴欧盟最新的SPC修改对补偿期内的专利权规定额外的限制与例外,中美经贸协议明确规定补偿期内专利权的限制与例外应当与基础专利相一致。
根据中国现行专利法规定,专利权的限制与例外主要包括第六十九条规定的“不视为侵犯专利权”例外,以及第六章规定的“专利实施的强制许可”。在中美经贸协议就补偿期内专利权的限制与例外作出了明确规定的情况下,中国制定药品专利期限补偿制度时,虽没有增加限制与例外的灵活空间,但也仍有必要通过立法重申补偿期内的专利权同样适用专利法中有关例外与限制的规定。
四、结论与建议
作为一项专利制度,药品专利期限补偿制度的目的主要是通过补偿专利期的“不合理占用”,延长专利药市场独占期,从而实现激励医药产业创新的目的。然而,从国外制度实践情况来看,药品专利期限补偿的“激励创新”作用并没有实证数据的支撑。但专利期限延长导致专利药市场独占期过长,将会对中国药品可及性带来不利影响。在此种情况下,中国建立药品专利期限补偿制度时,建议以落实协议最低义务为原则,不宜制定超出协议义务的制度。
中美经贸协议对专利期限补偿条件、补偿期限、补偿期限内专利权范围及限制与例外等基本问题作出了规定。从国外制度比较来看,美国、欧盟和日本的药品专利期限补偿制度均从这几个方面对药品专利期限补偿进行了限制,但在具体制度设计及实践上存在一定区别。中国在落实中美经贸协议义务,建立药品专利期限补偿制度时,需要在借鉴国外经验基础上,通过《专利法》及其下位行政法规、部门规章的修改,制定出一套完整的制度。
