寻常型银屑病患者体内半乳糖凝集素家族蛋白表达研究
2020-07-27程庆王晓华杨斌
程庆, 王晓华, 杨斌
(南方医科大学皮肤病医院实验研究中心, 广东 广州 510091)
银屑病是一种慢性炎症性、增生性皮肤病,临床表现以红斑、鳞屑为主,具有顽固性和复发性的特点,引起皮损部位疼痛、瘙痒、出血等不适,干扰患者的日常生活[1]。银屑病在世界范围内自然人群中发病率占1%~3%,2008年流行病学调查显示我国患病率为0.47%,且发病率、患病率均有逐年升高的趋势[2]。银屑病发病机理比较复杂,目前认为其是由T细胞介导的自身免疫疾病,多种细胞(包括树突状细胞、Th17、Tc17、中性粒细胞和角质形成细胞等)参与银屑病发病过程[3],但详细机理仍待进一步阐明。虽然银屑病的治疗方案很多,但因其易复发、不能治愈,目前仍缺乏对所有银屑病患者治疗均有效的药物[4],因此寻找新的治疗靶标意义重大。
半乳糖凝集素(galectin,Gal)家族是一类与含β-半乳糖苷残基的多聚糖具有很高亲和力的内源性凝集素家族。迄今为止,已有15个半乳糖凝集素家族成员被发现,它们均具有高度保守的糖识别结构域,可表达于细胞质、细胞核、细胞膜或细胞外基质[5],参与细胞的生长分化、细胞间的粘附、细胞信号转导及细胞凋亡等多种细胞活动[6-7]。目前Gal-1、Gal-3、Gal-7、Gal-9的研究较多,其中Gal-1可抑制免疫反应[7-8]、调节创面修复[9],Gal-3参与调节皮肤肿瘤[10]、创面愈合[11],Gal-7在皮肤中主要表达于复层扁平上皮[5, 12],调节角质形成细胞的凋亡、增殖和迁移,影响皮肤屏障功能[13],Gal-9大量表达于正常免疫系统,具有免疫调节作用[14]。
现今国内关于Gal-1、Gal-3、Gal-7、Gal-9在银屑病中的研究报道较少,故本文通过对4种半乳糖凝集素家族成员在寻常型银屑病(psoriasis vulgaris, PV)患者体内表达的研究,为探究银屑病发病机理、开发新的治疗药物提供思路。
1 资料与方法
1.1 病例资料
纳入2017年1月-2017年9月来我院皮肤科就诊,明确诊断为PV的30例病例,均符合《中国银屑病临床诊疗指南(2018简版)》诊断标准[15]。排除标准:近1年内接受过系统性生物制剂治疗;近1个月内接受过紫外线光疗、光化学治疗或系统性银屑病治疗;近2周内接受过局部银屑病治疗;妊娠期、哺乳期妇女。30例PV患者中男18例,女12例;年龄23~74岁,平均(49.63±15.57)岁; 银屑病面积和严重程度指数评分5.70~34.30分,平均(16.02±6.96)分;病程0.33~30年,平均(11.91±8.86)年。纳入同期来自体检中心的30例健康对照。其中男14例,女16例;年龄26~73岁,平均(45.20±14.40)岁。两组年龄(t=1.14,P=0.257)和性别(2=1.07,P=0.301)相比均无统计学差异。研究获得受试者的知情同意并经本院伦理委员会审批通过。
1.2 主要试剂和仪器
Gal-1 ELISA试剂盒、Gal-7 ELISA试剂盒(RayBio),Gal-3 ELISA试剂盒(联科生物),Gal-9 ELISA试剂盒(Elabscience),兔抗人Gal-1、Gal-3、Gal-7一抗(Abcam),兔抗人Gal-9一抗(ImmunoWay),抗原修复液(康为世纪),抗体稀释液(广州深达生物制品技术有限公司),Poly-HRP羊抗鼠/兔二抗试剂(洛孚生物科技),DAB染色液(广州深达生物制品技术有限公司)。显微镜(日本Olympus),酶标仪(美国Thermo)。
1.3 方法
1.3.1 样本收集 于清晨采集PV患者和健康对照的空腹静脉血,置于非抗凝采血管中室温静置30 min后,3 000 rpm离心15 min分离血清,-20 ℃保存。采集其中15例PV患者的皮损组织和10例健康对照重睑术、色素痣切除术中正常皮肤组织,经常规固定、脱水、石蜡包埋后制成蜡块,-20 ℃保存。
1.3.2 ELISA检测血清中Gal-1、Gal-3、Gal-7、Gal-9水平 分别按照Gal-1、Gal-3、Gal-7、Gal-9 ELISA试剂盒说明书操作,采用酶标仪检测450 nm处OD值,由标准品拟合曲线方程计算待测血清样本中Gal-1、Gal-3、Gal-7、Gal-9的浓度。根据试剂盒说明书,血清中Gal-1、Gal-3、Gal-7、Gal-9的检测下限分别为4.1 ng/mL、2.46 pg/mL、20 pg/mL、4.69 pg/mL,批内与批间变异系数均小于10%、12%。
1.3.3 免疫组化检测皮肤组织中Gal-1、Gal-3、Gal-7、Gal-9的表达及细胞定位 将皮肤标本石蜡块切片至3 μm厚,置70 ℃的烘箱中2 h;依次置于组织脱蜡液、95%酒精中脱蜡,流水冲洗后进行抗原修复;3%H2O2进行阻断后分别滴加Gal-1(1∶800)、Gal-3(1∶8 000)、Gal-7(1∶8 000)、Gal-9(1∶300)一抗;放置在孵育盒内4 ℃冰箱中过夜孵育约12 h;PBS冲洗后滴加Poly-HRP羊抗鼠/兔二抗,37 ℃孵育30 min;PBS冲洗,DAB显色,苏木素复染、封片。光学显微镜下分别取3个视野,200倍放大下拍照。采用Image-Pro Plus 6.0对免疫组化片进行平均光密度(mean optical density,MOD)值分析。
1.3.4 统计学处理 采用SPSS软件处理,数据以均值±标准差形式表示,PV患者与正常对照组血清与皮肤组织中Gal-1、Gal-3、Gal-7、Gal-9的表达差异采用t检验,采用Pearson相关系数评价血清中Gal-1与PASI评分的相关性。P<0.05为差异具有统计学意义。
2 结果
2.1 两组血清中Gal-1、Gal-3、Gal-7、Gal-9水平比较
ELISA检测结果表明,与正常对照相比,PV患者血清中Gal-1明显增高,差异有统计学意义(P<0.05),而Gal-3、Gal-7、Gal-9无明显变化(P值均>0.05),详见表1。进一步分析发现,PV患者血清中Gal-1水平与PASI评分呈正相关(r=0.37,P=0.049),详见图1。
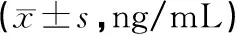
表1 血清中半乳糖凝集素的浓度测定Tab.1 Determination of the concentration of galectins
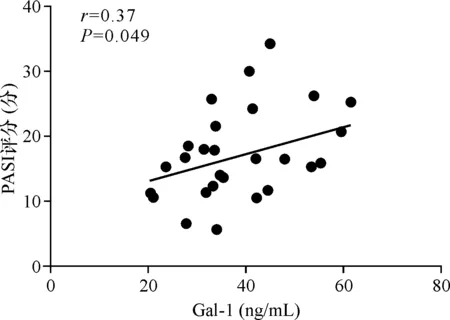
图1 PV患者血清中Gal-1水平与PASI评分正相关Fig.1 Serum level of Gal-1 in PV patients was positively correlated with PASI score.
2.2 皮肤组织中Gal-1、Gal-3、Gal-7、Gal-9的表达及细胞定位
免疫组化检测结果显示,正常皮肤与PV患者皮损组织中,Gal-1均主要表达于真皮血管内皮细胞,表皮中仅有少量细胞表达,可定位在细胞核和细胞浆,但PV皮损真皮乳头层大量细胞高表达Gal-1。正常皮肤的表、真皮与PV皮损真皮中均有较多细胞强表达Gal-3,但PV皮损表皮的大量颗粒层角质细胞弱表达Gal-3,角质层角化不全,基底层的角质形成细胞中Gal-3表达较低。正常皮肤和PV皮损中,Gal-7均主要表达于表皮角质形成细胞,可定位于细胞核和细胞浆,但PV皮损中角质层角化不全的角质形成细胞Gal-7阴性。Gal-9主要表达于表皮角质形成细胞,可定位于细胞核和细胞浆,正常皮肤中表皮大量细胞为强阳性表达,而PV皮损表皮中大量细胞为弱阳性表达,Munro微脓肿处中性粒细胞可见较强表达。详见图2。
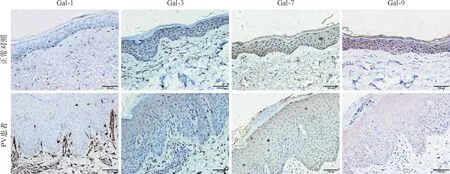
图2 免疫组化检测PV皮损与正常皮肤组织中Gal-1、Gal-3、Gal-7、Gal-9(200×)Fig.2 Immunohistochemical staining of Gal-1, Gal-3, Gal-7, Gal-9 in psoriatic lesions and normal skin (200×).
2.3 MOD分析
采用MOD半定量分析免疫组化片中Gal的表达,发现PV皮损中真皮处Gal-1表达(0.030±0.043)明显高于正常皮肤(0.011±0.002),t=3.34,P=0.003;皮损表皮处Gal-3表达(0.016±0.001)明显低于正常皮肤(0.060±0.018),t=-2.85,P=0.009;皮损表皮处Gal-7表达(0.090±0.011)明显高于正常皮肤(0.049±0.009),t=2.58,P=0.017;皮损表皮处Gal-9表达(0.011±0.002)明显低于正常皮肤(0.049±0.007),t=-6.16,P<0.001。详见图3。
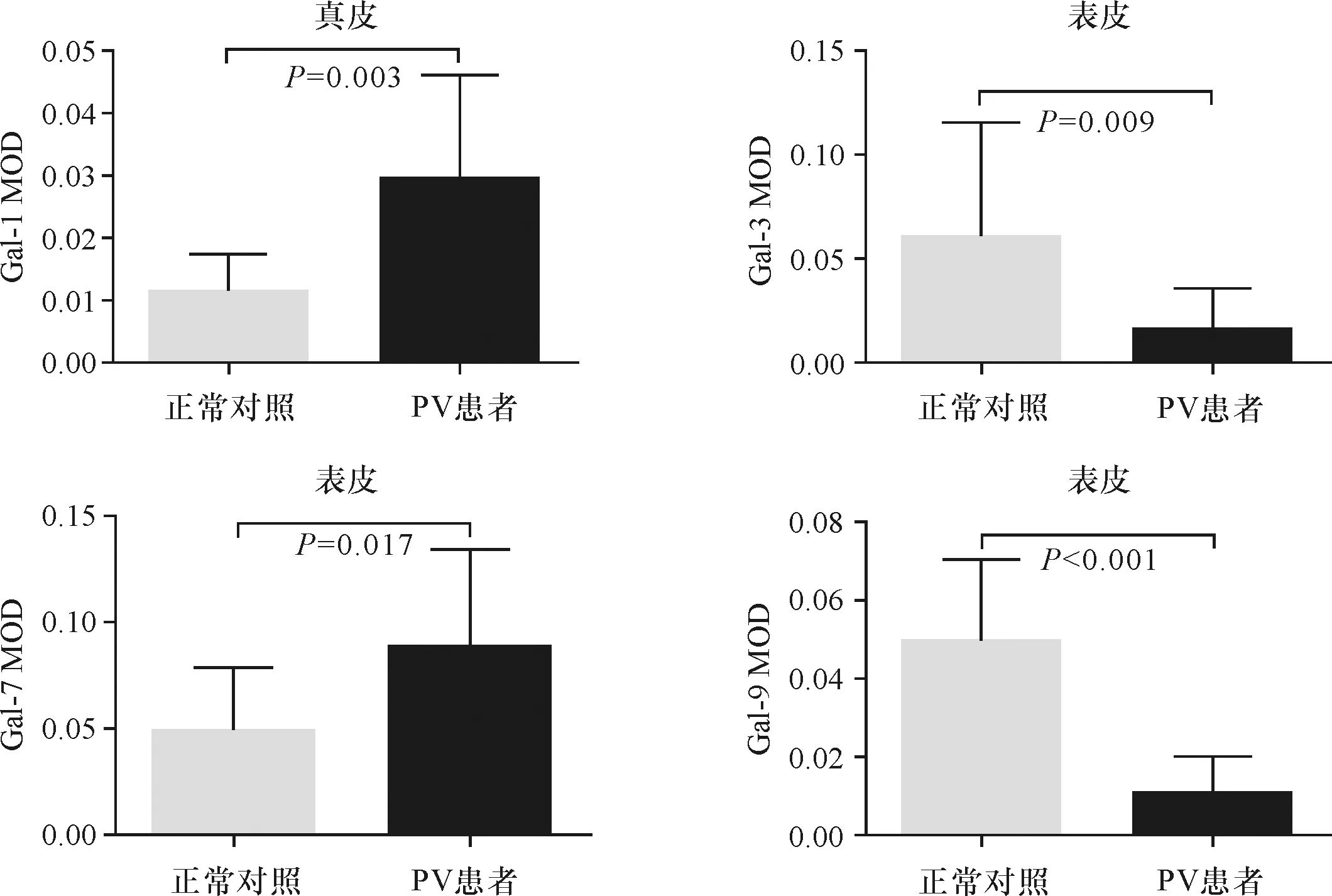
图3 PV皮损与正常皮肤组织中Gal-1、Gal-3、Gal-7、Gal-9的MOD半定量分析Fig.3 The MOD of Gal-1, Gal-3, Gal-7, Gal-9 in psoriatic lesions and normal skin.
3 讨论
PV的病理特征主要为角质形成细胞异常增殖、炎症细胞浸润和血管增生[1]。早期报道发现,Gal-1可通过与 T 细胞表面分子 CD45 结合,转导细胞凋亡信号,发挥免疫抑制作用[16]。Th1、Th17异常活化介导PV的发生发展,已有研究表明,Gal-1在PV皮损的表皮朗格汉斯细胞及真皮树突状细胞中表达下调,可能加重PV皮损处Th1/Th17炎症反应[8],但不同细胞表达的Gal-1可发挥不同的功能,例如:敲低Gal-1的表达可明显降低视网膜新生血管形成[17],皮肤T细胞淋巴瘤中的恶性T细胞分泌Gal-1可促进角质形成细胞增殖、抑制分化[18]。本研究发现,PV皮损处真皮中Gal-1表达上调,且主要定位于真皮乳头层;PV患者血清中Gal-1水平亦明显高于正常对照,且与PASI评分呈明显正相关,推测Gal-1可能促进真皮乳头层血管增生,促进角质形成细胞增殖、抑制分化,加重PV病情。
Gal-3在皮肤中分布广泛,可表达于皮肤树突状细胞、巨噬细胞、 T 细胞、角质形成细胞、肥大细胞、毛囊、皮脂腺和汗腺,黑色素细胞和成纤维细胞[12],可参与肿瘤免疫抑制[19]、创面愈合[20]及系统性红斑狼疮的发病过程[21]。PV中Gal-3研究较少,Kotwica等[22]比较102例PV患者与65例健康对照血清中Gal-3的水平,发现PV患者血清中Gal-3浓度明显高于健康对照,与PV并发左心室收缩功能下降有关。本研究发现PV患者血清中Gal-3的平均水平稍高于正常对照,但无明显差异,可能与样本量有关。Shi等[23]发现,PV皮损表皮中Gal-3表达明显低于正常皮肤与非皮损皮肤,且具有特异性,在其他PV样皮炎,如神经性皮炎、慢性湿疹等皮损处未发现上述现象;体内实验敲除Gal-3,可导致咪喹莫特诱导PV样小鼠模型中PV表型加重,表皮增厚、中性粒细胞浸润增加;体外试验敲低HaCaT细胞中Gal-3表达,可抑制角质形成细胞分化与迁移、促进细胞凋亡及抗菌肽、趋化因子配体的分泌,表明PV皮损处表皮中Gal-3表达下调可通过影响角质形成细胞功能、促进中性粒细胞浸润,加重PV病情。本研究同样发现PV皮损表皮中Gal-3表达明显下调。
Gal-7在皮肤中主要表达于复层扁平上皮,调节角质形成细胞的凋亡、增殖和迁移,影响皮肤屏障功能。角质形成细胞的过度增殖是PV的典型病理特征之一。Mehul等[24]采用胶带粘贴获取表皮角质层提取蛋白,发现PV皮损角质层中Gal-7含量明显高于正常对照。有研究发现,在增殖的皮肤基底层角质形成细胞上,Gal-7表达低于基底上层的角质形成细胞;体外机制研究发现JNK1-miR-203-p63通路介导Gal-7促进角质形成细胞的分化、抑制增殖的过程[25]。比较Gal-7敲除小鼠与野生小鼠皮肤结构与细胞分化,发现敲除Gal-7不影响皮肤的增殖,以及基底层、棘层、颗粒层的分化和细胞间连接,但在UVB照射及外伤刺激下,Gal-7敲除小鼠表现出强烈的应激增殖反应[26]。 由上可知,Gal-7对角质形成细胞功能的影响比较复杂。本研究同样发现,Gal-7主要表达于皮肤表皮角质形成细胞,且PV皮损表皮处Gal-7的表达明显高于正常皮肤。但Gal-7在PV皮损表皮中过表达是否影响PV的发生发展还需进一步研究。
以往研究对Gal-9的免疫调节功能的报道较多,如Gal-9作为T细胞Ig和粘蛋白结构域分子Tim3的配基,可与Th1细胞表面的Tim-3结合,诱导钙离子内流和Th1细胞死亡[27];可通过促进IgM-BCR与CD45、CD22的共定位,抑制B细胞的活化[28];是嗜酸性粒细胞的趋化因子,可驱化嗜酸性粒细胞的局部浸润[14]。但Gal-9对角质形成细胞的影响研究较少。Igawa等[29]发现健康对照皮肤表皮中Gal-9高表达,体外细胞实验中IFN-γ可抑制角质形成细胞中Gal-9的表达,而PV皮损中INF-γ上调[30]。本研究发现PV皮损表皮处Gal-9的表达明显低于正常皮肤,故推测表皮处Gal-9的表达下调可能与过量的IFN-γ有关。但Gal-9的表达下调是否影响免疫细胞的功能,从而影响PV发病,尚需进一步研究。
综上所述,Gal-1、Gal-3、Gal-7、Gal-9在PV皮损局部的细胞定位及表达变化各不相同;PV患者血清中Gal-1水平升高且与PASI评分相关,PV皮损真皮处Gal-1的表达明显上调,提示Gal-1可能影响PV的发病过程;PV皮损表皮中Gal-3表达下调,可能通过影响角质形成细胞功能、促进中性粒细胞浸润,加重PV;PV皮损表皮中Gal-7上调、Gal-9下调,但是否通过影响角质形成细胞、免疫细胞功能介导PV的发病,还需深入研究。
