有机溶剂中尼龙布固定化木瓜蛋白酶动力学性能研究
2020-07-25刘艳霖
朱 睿,刘艳霖
(深圳信息职业技术学院 交通与环境学院,广东深圳 518000)
酶不仅在水溶液里而且在有机溶剂中也具有催化活性,这已经成为一个公认的事实。在有机介质中进行酶催化已经成为生物技术领域的一个主要研究方向,受到国内外学术界和工业界的广泛关注和重视。在有机溶剂中,酶能催化在水里不能进行的化学反应,其稳定性显著提高,与在水里相比,酶的活性和各种专一性不仅会发生变化,而且还能通过改变反应介质(而不是通过改造酶本身)来进行调节和控制。同时,由于疏水性反应物溶解度的增加,产物和酶的分离提纯便利,由水引起的副反应受到抑制,以及微生物对反应器的污染减少,使酶作为催化剂在工业应用上的价值大大提高。要充分利用这些优越性,就必须对非水酶学的基本理论进行深入研究,如酶的蛋白质结构、酶的催化机理、溶剂和水与酶的相互作用及其对酶催化的动力学和热力学方面的影响,以及酶结构与功能之间的相互关系。近年来,非水酶学的基本理论研究已经取得了重大突破。
在有机溶剂中可直接使用酶粉作催化剂,但是效果并不太好。一方面天然酶在有机溶剂中容易变形而失活;另一方面酶粉在有机溶剂中分散性差,容易聚结成团。从工程应用的角度看,过去在水溶液中发展和使用的酶固定化方法是有机介质中保护酶免遭变形、变性的最有前途的方法。尼龙布价格低廉、固定化操作简便、酶活力回收高,并在非水介质中能对酶形成良好的保护作用,是固定酶的优良载体。利用共价键结合法制备的尼龙固定化木瓜蛋白酶,在有机溶剂中具有良好的稳定性和较高使用效率,适合用于非水酶的实验开展动力学性能研究。
1 实验材料与方法
1.1 实验材料
木瓜蛋白酶(papain,PA)结晶纯酶和酪蛋白为Sigma公司产品;尼龙布(100目);其他试剂为国产分析纯。
1.2 试剂
(1)木瓜蛋白酶精酶。
(2)尼龙布(3cm×3cm)
(3)甲醇溶液(含18.6%CaC12和18.6%水)。
(4)3.5mo1/L HCl。
(5)5%戊二醛(以25%戊二醛和0.1mol/L pH为7.2的磷酸氢二钠-磷酸二氢钠缓冲液配制)。
(6)0.1mol/L pH为7.2 磷酸氢二钠-磷酸二氢钠缓冲液。
(7)0.5mo1/L NaCl(用0.1mol/L pH为7.2磷酸氢二钠-磷酸二氢钠缓冲液配制)。
(8)激活剂(0.1mol/L pH为7.2磷酸氢二钠-磷酸二氢钠缓冲液,内含36mmol/L半胱氨酸和0.6mmol/L EDTA)。
(9)1%酪蛋白溶液(用0.1mol/L pH为7.2磷酸氢二钠-磷酸二氢钠缓冲液配制)。
(10)200g/L三氯乙酸(TCA)溶液。
1.3 实验设备
SHA-B型恒温振荡器,JJ-1精密电动搅拌器,HWS24型电热恒温水浴锅,752紫外光栅分光光度计,PHSJ-4A精密pH计,AB204-N万分之一精密电子天平。
1.4 实验方法
1.4.1 固定方法
(1)每组取5块尼龙布(3cm×3cm)洗净,晾干。用含18.6%CaC12和18.6%水的甲醇溶液在50℃下保温10s左右,并轻轻搅拌至尼龙布发黏,取出用水冲去污物,用吸水纸吸干。
(2)尼龙布用3.5mo1/L HCl在室温水解45min,用蒸馏水洗至pH中性。
(3)尼龙布用5%戊二醛在室温下浸泡偶联20min。
(4)取出尼龙布,用0.1mol/L pH为7.2磷酸缓冲液反复洗去多余的戊二醛,吸干,立即用酶液在4℃下固定3.5h(酶液用量是每块布为1mL)。
(5)从酶液中取出尼龙布,用0.5mo1/L NaCl(用0.1mol/L pH为7.2磷酸缓冲液配制)洗去多余的酶蛋白,即得尼龙布固定化木瓜蛋白酶。
1.4.2 酶活力测定方法
取上述尼龙布固定化酶一块,加入0.25mL激活剂(0.1mol/L pH 7.2磷酸缓冲液内含36mmol/L半胱氨酸,0.6mmol/L EDTA)和2.5mL 预设浓度的有机溶剂(用0.1mol/L pH 7.2磷酸缓冲液稀释),于37℃下预热10min,加入预设浓度的酪蛋白溶液0.5mL(用1%酪蛋白与0.1mol/L pH 7.2磷酸缓冲液配制),37℃下恒温水浴振荡反应10min(可溶性有机溶剂如:二甲基亚砜、1,4-二氧六环、甲醇、乙腈、乙醇、丙醇、四氢呋喃,恒温水浴振荡反应,160次/min;不溶性有机溶剂如:乙酸乙酯、丁醇、戊醇、己醇、苯、甲苯、环己烷、十二醇,水浴高速搅拌反应,250r/min),然后加入1.0mL 200g/L三氯乙酸溶液终止酶反应。对照管先加入200g/L三氯乙酸溶液,后加酪蛋白溶液,其他与测定管相同。过滤,取其上清液于波长275nm处测定消光值。在上述条件下,反应体系每增加1个吸光值为一个酶活力单位(U);所以木瓜蛋白酶反应速度(v)为:U/(mL·min)。其操作过程,如表1所示:

表1 酶活测定操作步骤
2 结果与分析
2.1 缓冲液中的IPN动力学曲线
采用Lineweaver-Burk作图法,如图1所示,在没有有机溶剂存在的条件下,IPN的米氏常数Km为1.335g/L,最大反应速度(vmax)为0.022U/(mL·min)。

图1 缓冲液中的IPN动力曲线
2.2 不同浓度乙醇IPN动力曲线
采用Lineweaver-Burk作图法,如图2所示,在10%和20%的乙醇溶液中,IPN的米氏常数Km分别为4.520g/L和15.851g/L,最大反应速度(vmax)分别为0.059U/mL·min和0.197U/(mL·min)。在10%和20%的乙醇溶液中,Km分别为0%乙醇的3.38倍和11.87倍,Km上升,表明乙醇浓度升高时,酶对底物的亲和力下降。此时vmax分别为0%乙醇中的2.68倍与8.95倍,处于上升的趋势。

图2 不同浓度的乙醇IPN动力曲线
2.3 不同浓度甲醇IPN动力曲线
采用Lineweaver-Burk作图法,如图3所示,在10%和20%的甲醇溶液中,IPN的米氏常数Km分别为2.32g/L和3.98g/L,最大反应速度(vmax)分别为0.019U/(mL·min)和0.036U/(mL·min)。在10%和20%的甲醇溶液中,Km分别为0%甲醇的1.72倍和2.98倍,Km上升,表明甲醇浓度升高时,酶对底物的亲和力下降。此时vmax分别为0%甲醇中的0.86倍与1.63倍,处于上升的趋势。

图3 不同浓度的甲醇IPN动力曲线
2.4 不同浓度1,4-二氧六环IPN动力曲线
采用Lineweaver-Burk作图法,如图4所示,在10%和20%的1,4-二氧六环溶液中,IPN的米氏常数Km分别为3.63g/L和3.99g/L,最大反应速度(vmax)分别为0.035U/(mL·min)和0.044U/(mL·min)。在10%和20%的1,4-二氧六环溶液中,Km分别为0%1,4-二氧六环的2.71倍和2.99倍,Km上升,表明1,4-二氧六环浓度升高时,酶对底物的亲和力下降。此时vmax分别为0%1,4-二氧六环中的1.59倍与2倍,处于上升的趋势。
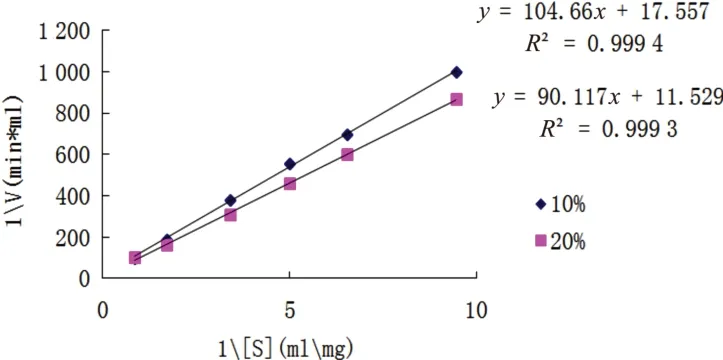
图4 不同浓度的1,4-二氧六环IPN动力曲线
2.5 不同浓度四氢呋喃IPN动力曲线
采用Lineweaver-Burk作图法,如图5所示,在10%和20%的四氢呋喃溶液中,IPN的米氏常数Km分别为3.17g/L和8.64g/L,最大反应速度(vmax)分别为0.030U/(mL·min)和0.052U/(mL·min)。在10%和20%的四氢呋喃溶液中,Km分别为0%四氢呋喃的2.37倍和6.47倍,Km上升,表明四氢呋喃浓度升高时,酶对底物的亲和力下降。此时vmax分别为0%四氢呋喃中的1.36倍与2.36倍,处于上升的趋势。
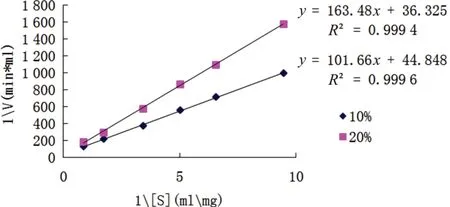
图5 不同浓度四氢呋喃IPN动力曲线
2.6 不同浓度二甲基亚砜IPN动力曲线
采用Lineweaver-Burk作图法,如图6所示,在10%和20%的二甲基亚砜溶液中,IPN的米氏常数Km分别为3.89g/L和4.02g/L,最大反应速度(vmax)分别为0.056U/(mL·min)和0.057U/(mL·min)。在10%和20%的二甲基亚砜溶液中,Km分别为0%二甲基亚砜的2.91倍和3.01倍,Km上升,表明二甲基亚砜浓度升高时,酶对底物的亲和力下降。此时vmax分别为0%二甲基亚砜中的2.55倍与2.56倍,处于上升的趋势。
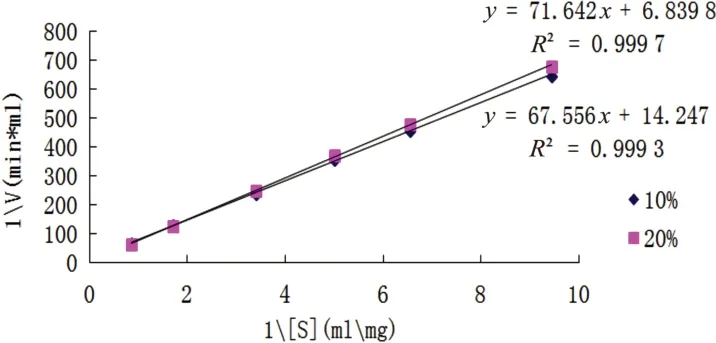
图6 不同浓度二甲基亚砜IPN动力曲线
2.7 不同浓度正丙醇IPN动力曲线
采用Lineweaver-Burk作图法,如图7所示,在10%和20%的正丙醇溶液中,IPN的米氏常数Km分别为11.76g/L和2.00g/L,最大反应速度(vmax)分别为0.166U/(mL·min)和0.022U/(mL·min)。在10%和20%的正丙醇溶液中,Km分别为0%正丙醇的8.80倍和1.49倍,Km值下降,表明正丙醇浓度升高时,酶对底物的亲和力上升。此时vmax分别为0%正丙醇中的7.55倍与1倍,处于下降的趋势。

图7 不同浓度正丙醇IPN动力曲线
2.8 不同浓度乙腈IPN动力曲线
采用Lineweaver-Burk作图法,如图8所示,在10%和20%的乙腈溶液中,IPN的米氏常数Km分别为13.51g/L和1.40g/L,最大反应速度(vmax)分别为0.108U/(mL·min)和0.022U/(mL·min)。在10%和20%的乙腈溶液中,Km分别为0%乙腈的10.12倍和1.04倍,Km下降,表明乙腈浓度升高时,酶对底物的亲和力上升。此时vmax分别为0%乙腈中的4.90倍与1倍,处于下降的趋势。

图8 不同浓度乙腈IPN动力曲线
2.9 不同浓度乙酸乙酯IPN动力曲线
采用Lineweaver-Burk作图法,如图9所示,在10%和20%的乙酸乙酯溶液中,IPN的米氏常数Km分别为2.18g/L和0.76g/L,最大反应速度(vmax)分别为0.021U/(mL·min)和0.014U(mL·min)。在10%和20%的乙酸乙酯溶液中,Km值分别为0%乙酸乙酯的1.63倍和56.92%,Km下降,表明乙酸乙酯浓度升高时,酶对底物的亲和力上升。此时vmax分别为0%乙酸乙酯中的95.45%与63.63%,处于下降的趋势。
2.1 0 不同浓度丁醇IPN动力曲线
采用Lineweaver-Burk作图法,如图10所示,在10%和20%的丁醇溶液中,IPN的米氏常数Km分别为1.22g/L和0.51g/L,最大反应速度(vmax)分别为0.018U/(mL·min)和0.009U/(mL·min)。在10%和20%的丁醇溶液中,Km分别为0%丁醇的91.38%和38.20%,Km下降,表明丁醇浓度升高时,酶对底物的亲和力上升。此时vmax分别为0%丁醇中的81.81%与40.9%,处于下降的趋势。

图9 不同浓度乙酸乙酯IPN动力曲线
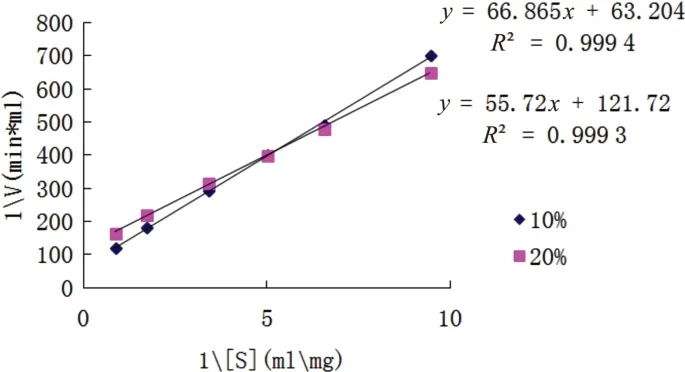
图10 不同浓度丁醇IPN动力曲线
2.1 1 不同浓度戊醇IPN动力曲线
采用Lineweaver-Burk作图法,如图11所示,在10%和20%的戊醇溶液中,IPN的米氏常数Km分别为1.609g/L和1.03g/L,最大反应速度(vmax)分别为0.020U/(mL·min)和0.009U/(mL·min)。在10%和20%的戊醇溶液中,Km分别为0%戊醇的1.21倍和77.15%,Km下降,表明戊醇浓度升高时,酶对底物的亲和力上升。此时vmax分别为0%戊醇中的90.90%与40.9%,处于下降的趋势。

图11 不同浓度戊醇IPN动力曲线
2.1 2 不同浓度己醇IPN动力曲线
采用Lineweaver-Burk作图法,如图12所示,在10%和20%的己醇溶液中,IPN的米氏常数Km分别为2.46g/L和0.54g/L,最大反应速度(vmax)分别为0.024U/(mL·min)和0.01U/(mL·min)。在10%和20%的己醇溶液中,Km分别为0%乙醇的1.84倍和40.45%,Km下降,表明己醇浓度升高时,酶对底物的亲和力上升。此时vmax分别为0%己醇中的1.09倍与45.45%,处于下降的趋势。

图12 不同浓度己醇IPN动力曲线
2.1 3 不同浓度环己环IPN动力曲线
采用Lineweaver-Burk作图法,如图13所示,在10%和20%的环己环溶液中,IPN的米氏常数Km分别为4.35g/L和12.19g/L,最大反应速度(vmax)分别为0.020U/(mL·min)和0.058U/(mL·min)。在10%和20%的环己环溶液中,Km分别为0%环己环的3.25倍和9.13倍,Km上升,表明环己环浓度升高时,酶对底物的亲和力下降。此时vmax分别为0%环己环中的90.90%与2.63倍,处于上升的趋势。

图13 不同浓度环己环IPN动力曲线
2.1 4 不同浓度苯IPN动力曲线
采用Lineweaver-Burk作图法,如图14所示,在10%和20%的苯溶液中,IPN的米氏常数Km分别为5.75g/L和1.93g/L,最大反应速度(vmax)分别为0.048U/(mL·min)和0.017U/(mL·min)。在10%和20%的苯溶液中,Km分别为0%苯的4.31倍和1.44倍,Km下降,表明己醇浓度升高时,酶对底物的亲和力上升。此时vmax分别为0%苯中的2.18倍与77.27%,处于下降的趋势。
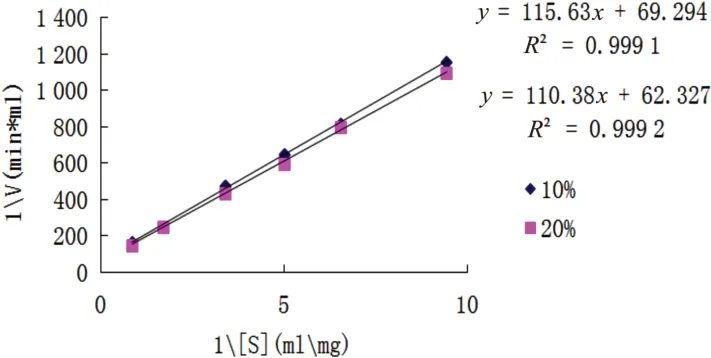
图14 不同浓度苯IPN动力曲线图
2.1 5 不同浓度正十二醇IPN动力曲线
采用Lineweaver-Burk作图法,如图15所示,在10%和20%的正十二醇溶液中,IPN的米氏常数Km分别为3.39g/L和1.42g/L,最大反应速度(vmax)分别为0.042U/(mL·min)和0.024U(mL·min)。在10%和20%的正十二醇溶液中,Km分别为0%正十二醇的2.53倍和1.06倍,Km下降,表明正十二醇浓度升高时,酶对底物的亲和力上升。此时vmax分别为0%正十二醇中的1.90倍与1.09倍,处于下降的趋势。
3 结语
实验中大部分的有机溶剂对酶与底物的结合能力都有很大的削弱作用,其中20%乙酸乙酯、10%和20%的丁醇、20%的戊醇对酶与底物的结合有促进作用,都比在无有机溶剂存在的情况下高。
从以上十四种溶剂综合考虑,可以把这十四种溶剂分为两大组别。其中己醇、甲醇、1,4-二氧六环、四氢呋喃、二甲基亚砜、环己烷的Km与vmax随着有机溶剂浓度的上升(10%-20%)而上升,表明在这些溶剂中,浓度从10%上升到20%,酶与底物的结合力下降,而最大反应速度却上升;正丙醇、乙腈、乙酸乙酯、丁醇、戊醇、己醇、苯、正十二醇的Km与vmax随着有机溶剂浓度的上升(10%~20%)而下降,表明在这些溶剂中,浓度从10%上升到20%,酶与底物的结合力上升,而最大反应速度却下降。
