线粒体靶向肽SS31及RIP抑制剂Necrostatin-1 (Nec-1)对H2O2诱导的氧化应激损伤ARPE-19细胞的保护作用△
2020-07-24许雲陈泽君权卓娅张瑞雪何蓓蕾何媛
许雲 陈泽君 权卓娅 张瑞雪 何蓓蕾 何媛
老年性黄斑变性(AMD)是老年人视力丧失的主要原因,在亚洲发展中国家中,40岁以上人群AMD的患病率约为7%[1]。研究表明,氧化应激损伤会导致大量活性氧自由基(reactive oxygen species,ROS)在视网膜组织堆积,引起视网膜色素上皮(retinal pigment epithelial,RPE)层吞噬功能障碍最终导致RPE细胞死亡[2-3]。体外实验研究证实,H2O2诱导的氧化应激损伤会引起RPE细胞一系列结构和功能改变,最终导致凋亡[4]。然而,最近研究发现,程序性坏死是RPE细胞在氧化应激情况下死亡的主要机制[5-6]。线粒体靶向肽SS31(H-D-Arg-Dmt-Lys-Phe-NH2)是一种新型线粒体靶向小分子短肽,具有内在抗氧化活性。它具有多种药理作用,包括抗炎、抗氧化应激[7-9]、神经保护[10-11]及抗凋亡等[12-13]。程序性坏死参与氧化应激会引起RPE细胞损伤,SS31能否通过对抗氧化应激引起的ARPE-19细胞程序性坏死发挥视网膜保护作用,目前尚未见相关报道。本研究探讨线粒体靶向肽SS31 及RIP抑制剂Necrostatin-1 (Nec-1)对H2O2诱导的ARPE-19细胞氧化应激损伤的保护作用。
1 材料与方法
1.1 主要试剂ARPE-19细胞由中山大学实验动物中心提供;SS31(上海强耀生物科技有限公司),抗RIP3抗体、Nec-1、MTT、H2O2(美国Sigma 公司),胰蛋白酶、DMEM培养基(美国Gibco 公司),胎牛血清(杭州四季青生物工程材料研究所),Annexin V/PI 试剂盒(江苏凯基公司),JC-1荧光探针、双氯荧光素(上海翊圣生物科技有限公司)。
1.2 方法
1.2.1 细胞培养和分组将 ARPE-19细胞放入含体积分数10% 胎牛血清的DMEM培养基中,置于含体积分数5% CO2、37 ℃ 细胞培养箱内培养,当细胞生长融合到80%时,用2.5 g·L-1EDTA-胰蛋白酶进行消化,传代,继续培养,直至细胞生长、融合至80%~90%再次传代。取增殖旺盛、状态良好的细胞用于实验研究。
根据前期对H2O2作用细胞半数致死量浓度筛选,选择400 μmol·L-1H2O2作为氧化应激损伤浓度;根据MTT结果筛选出1 μmol·L-1SS31、40 μmol·L-1Nec-1作为实验最佳浓度。将细胞分为6组:(1)对照组:用DMEM培养基处理细胞24 h;(2)SS31+Nec-1组:用1 μmol·L-1SS31预处理细胞2 h,更换培养液并加入40 μmol·L-1Nec-1共处理细胞24 h;(3)H2O2组:用400 μmol·L-1H2O2处理细胞24 h;(4)SS31+H2O2组:用1 μmol·L-1SS31预处理细胞2 h,吸出后加入400 μmol·L-1H2O2作用24 h;(5)SS31+Nec-1+ H2O2组:用1 μmol·L-1SS31预处理细胞2 h,吸出后再用40 μmol·L-1Nec-1与400 μmol·L-1H2O2共处理细胞24 h;(6)Nec-1+H2O2组:40 μmol·L-1Nec-1与400 μmol·L-1H2O2共处理细胞24 h。
1.2.2 MTT测定细胞存活率当ARPE-19细胞生长、融合到80%时,用EDTA-胰蛋白酶消化制成细胞悬液,将ARPE-19细胞接种于96孔板,每孔200 μL,置于含体积分数5% CO2恒温培养箱孵育过夜,按1.2.1实验分组处理细胞后,每孔加入20 μL MTT溶液,置于细胞培养箱孵育4 h。弃上清,每孔加入150 μL的DMSO,振荡器上微振10 min,用酶标仪在490 nm波长处测各孔吸光度值,计算细胞存活率,每组设5个复孔。
1.2.3 双氯荧光素染色测定细胞ROS水平将细胞接种于6孔板中,每孔200×103个细胞,待细胞贴壁后加药处理,弃培养液,PBS洗涤细胞1次,加入用无血清培养基11000稀释的双氯荧光素探针,置于细胞培养箱孵育20 min,弃培养基后用无血清的培养基洗涤细胞3次,置于荧光显微镜下观察并拍照。
1.2.4 JC-1染色测定线粒体膜电位将细胞接种于6孔板内,每孔200×103个细胞,待细胞贴壁后加药处理,弃培养液,PBS洗涤细胞1次,用胰蛋白酶消化收集各组细胞,离心,弃上清,将配制好的JC-1染色工作液加入各管,吹打混匀,37 ℃避光孵育20 min。孵育结束后离心,弃上清,用JC-1染色缓冲液洗涤细胞2遍,每管加300 μL PBS重悬细胞,放入流式细胞仪进行检测。
1.2.5 AnnexinV/PI双染色检测细胞PI阳性率取出培养完毕的细胞,PBS漂洗2遍,用不含EDTA的胰蛋白酶消化,吹打混匀成单细胞悬液,将细胞悬液移至2 mL EP管内,1000 r·min-1离心 5 min,弃上清;预冷PBS洗涤2次,轻轻混匀,离心后弃上清,然后每组EP管加入500 μL的结合缓冲液悬浮沉淀细胞,再加入5 μL FITC染色液和5 μL PI染色液,混匀,避光室温孵育15 min,放入流式细胞仪进行检测。
1.2.6 Western blot 检测RIP3蛋白表达水平将ARPE-19细胞接种于6孔板,当细胞生长、融合到80%时,按1.2.1实验组处理细胞后,用预冷的 PBS冲洗3次,加入裂解液,4 ℃静置30 min,12 000 r·min-1离心20 min,吸取上清液,采用BCA法进行蛋白定量。总蛋白经十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离后,转移到PVDF 膜上。用50 g·L-1脱脂奶粉封闭60 min,随后加入抗 RIP3抗体(11000),4 ℃ 摇床孵育过夜,然后用TBST 洗5次,每次7 min,与相应的 2抗(14000)在室温下共孵育1 h,用TBST洗5次,每次7 min。将 PVDF 膜用ECL化学发光试剂显影后进行拍照并保存,以 β-actin为内参,使用Image Lab软件对其进行灰度扫描分析,计算各样本条带与内参条带的灰度值比值。
1.3 统计学分析所有实验数据均用SPSS 18.0软件进行统计学分析,以均值±标准差表示,组间比较采用单因素方差分析,检验水准:α=0.05。
2 结果
2.1 各组APRE-19细胞存活率情况和形态变化与对照组相比,H2O2组细胞存活率明显降低,差异有统计学意义(P< 0.05);与H2O2组相比,SS31+H2O2组、Nec-1 + H2O2组细胞存活率均升高,差异均有统计学意义(均为P<0.05);见表1。在倒置相差显微镜下观察各组APRE-19细胞形态变化:对照组细胞生长良好,H2O2组细胞形态皱缩,细胞间隙明显增大,且细胞数目明显减少,SS31+ H2O2组、Nec-1+ H2O2组细胞形态较 H2O2组明显好转,死亡细胞数目明显减少(图1)。
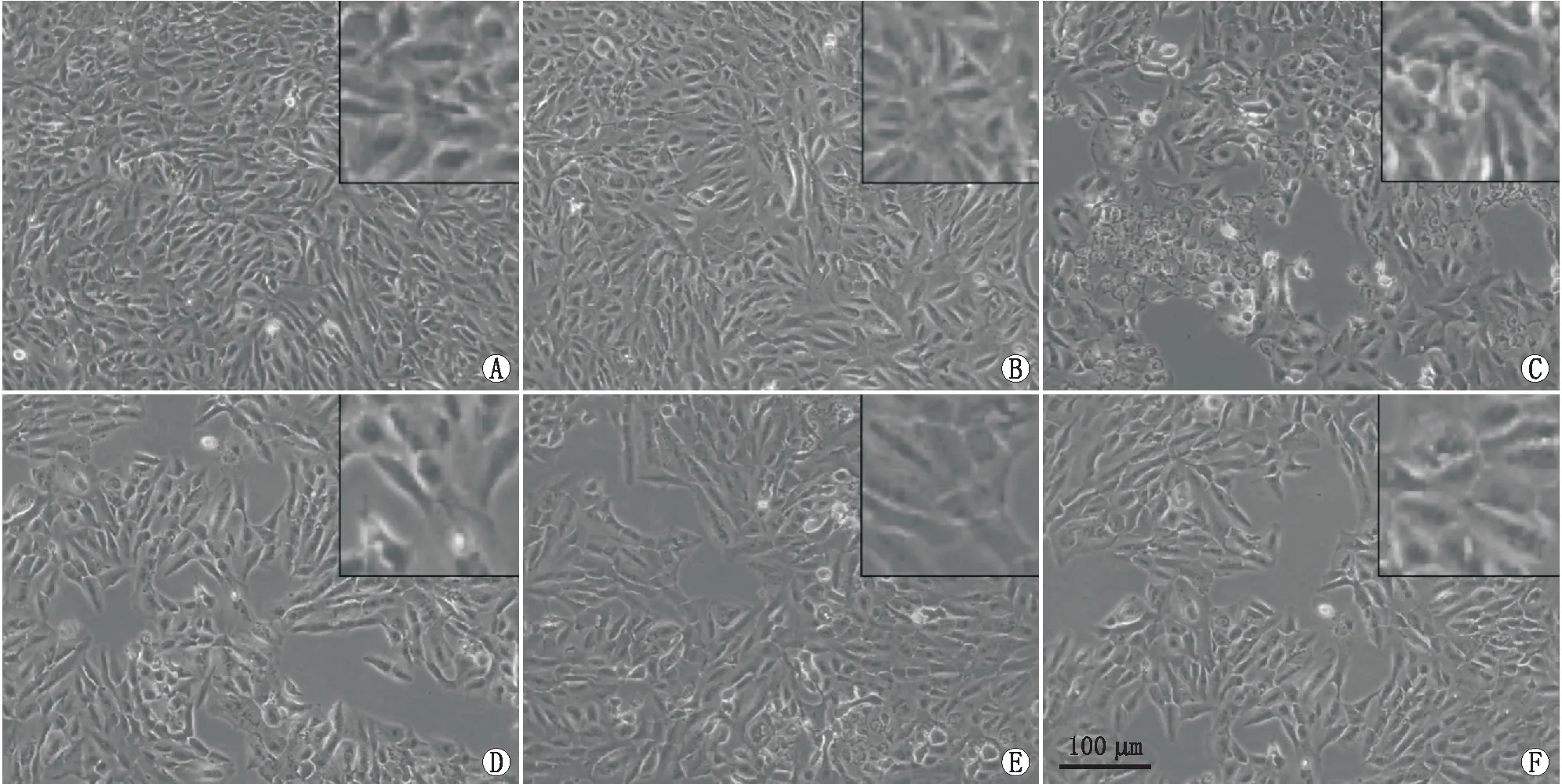
图1 倒置相差显微镜下各组APRE-19细胞形态变化 A:对照组;B:SS31+Nec-1 组;C:H2O2 组;D:SS31+H2O2 组;E:SS31+Nec-1+H2O2 组;F:Nec-1+H2O2 组(×400)
2.2 荧光显微镜下双氯荧光素染色结果荧光显微镜下双氯荧光素染色结果显示:对照组ARPE-19细胞内仅见微弱绿色荧光;与对照组相比,H2O2组绿色荧光明显增强,细胞内ROS含量明显增多;与H2O2组相比,SS31+H2O2组、Nec-1+H2O2组绿色荧光明显减弱,细胞内ROS含量明显减少(图2)。说明SS31和Nec-1能抑制H2O2引起的ARPE-19细胞氧化应激反应。
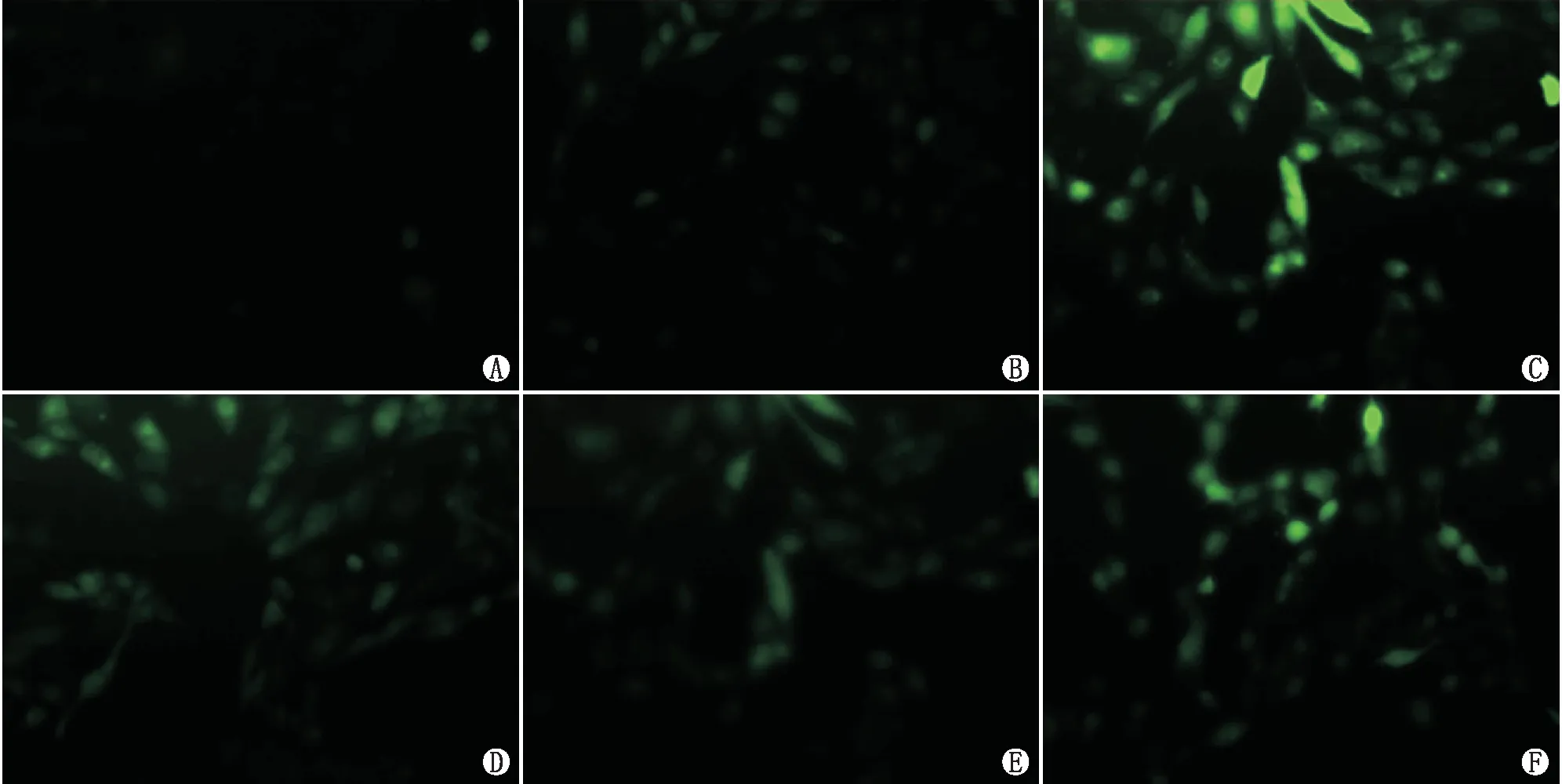
图2 各组荧光显微镜下双氯荧光素染色结果 A:对照组;B:SS31+Nec-1 组;C:H2O2 组;D:SS31+H2O2 组;E:SS31+Nec-1+H2O2 组;F:Nec-1+H2O2 组(×400)
2.3 各组细胞线粒体膜电位和PI阳性率变化线粒体膜电位的变化可以反映早期线粒体的功能状态。JC-1在正常线粒体聚集呈现红色荧光,而在线粒体损伤、膜电位降低时呈现绿色荧光,该膜电位降低的细胞比例以百分率来表示。流式细胞仪结果分析得出:与对照组相比,H2O2组线粒体膜电位降低的细胞比例升高,差异有统计学意义(P<0.05);与H2O2组相比,SS31+H2O2组线粒体膜电位降低的细胞比例降低(P<0.05)。与SS31作用相类似,Nec-1+H2O2组线粒体膜电位降低的细胞比例亦降低,其差异有统计学意义(P<0.05)。AnnexinV/PI双染色结果显示:与对照组相比,H2O2组PI阳性率增加;与H2O2组相比,SS31+ H2O2组、Nec-1+H2O2组PI阳性率均明显降低,差异均有统计学意义(均为P<0.05)。具体数据见表1。这些结果表明,H2O2诱导的ARPE-19细胞程序性坏死中,线粒体功能障碍可能参与了这一过程,而SS31和Nec-1都可降低H2O2诱导的ARPE-19细胞线粒体损伤及程序性坏死。
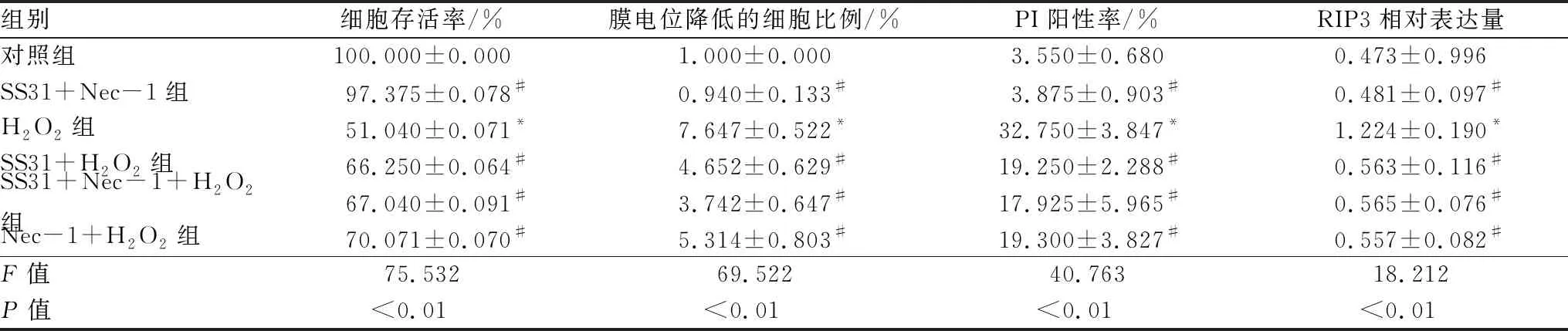
表1 各组细胞存活率、膜电位降低的细胞比例、PI阳性率、RIP3 蛋白相对表达量
2.4 各组细胞RIP3蛋白表达情况Western blot检测结果显示,H2O2处理ARPE-19细胞6 h后,RIP3蛋白的表达开始升高,24 h时RIP3 蛋白表达水平最高(P<0.05)。与对照组相比,H2O2组RIP3 蛋白表达水平明显升高,差异有统计学意义(P<0.05);与H2O2组相比,SS31+ H2O2组、Nec-1+H2O2组RIP3 蛋白表达上调作用显著减弱,差异均有统计学意义(均为P<0.05)。见表1。
3 讨论
AMD的发病机制与补体系统、炎症通路及氧化应激等因素密切相关。RPE细胞是维持视网膜内环境稳定的重要细胞,氧化应激损伤RPE细胞在AMD发病中发挥重要作用。以往的研究发现,H2O2诱导的氧化应激损伤会导致RPE细胞凋亡[14-15]。最近的研究表明,程序性坏死是RPE细胞在氧化应激下死亡的主要机制[5-6,16]。程序性坏死是近年来发现的一类受死亡信号的调控、非依赖Caspase的新型细胞死亡方式[17],在此过程中,受体相互作用蛋白RIP发挥极其重要的调控作用,是反映程序性坏死的重要指标。程序性坏死的特异性阻断剂Nec-1正是通过作用于RIP1和RIP3的激酶部分而发挥作用。Hanus等[6]证实,在氧化应激作用下,RPE细胞出现ATP耗竭、RIPK3聚集,核膜和质膜渗漏及破坏,这是RPE细胞发生程序性坏死的主要特征;应用RIP的抑制剂Nec-1或敲除RIPK3都可挽救氧化应激引起的RPE细胞死亡。这表明RIPK3对氧化应激诱导的RPE细胞程序性坏死至关重要。与他们的研究结果相类似,本研究观察到H2O2引起RPE细胞损伤的同时,可上调RPE细胞RIP3蛋白的表达水平,从细胞学水平进一步证实,H2O2可诱导RPE细胞发生程序性坏死。为了进一步证实程序性坏死在H2O2损伤RPE细胞中的作用,我们观察了程序性坏死的特异性抑制剂Nec-1对H2O2诱导的ARPE-19细胞损伤的影响;结果表明,Nec-1不仅能抑制RIP3蛋白表达上调,还能减轻H2O2引起的RPE细胞多种损伤,使细胞存活率升高,ROS生成和线粒体膜电位的下降均减少,降低H2O2诱导的RPE细胞坏死。
SS31是一种线粒体靶向性小分子短肽[18],具有内在抗氧化活性。研究表明,SS31能消除H2O2、羟基自由基和过氧亚硝酸根离子的活性,SS31还能够降低生理及病理条件下细胞及线粒体中ROS的含量,抑制线粒体通透性转换,防止线粒体肿胀[19-20],SS31能保护661W细胞、小梁网细胞及人晶状体上皮细胞对抗氧化应激引起的细胞毒性、氧化应激损伤、线粒体损伤、凋亡等一系列的损伤过程[21-22]。本研究探讨SS31对H2O2诱导的ARPE-19细胞程序性坏死是否具有保护作用,为 SS31的临床应用提供一定的理论依据。我们研究发现,线粒体靶向肽SS31可通过抑制RIP3激酶的激活,从而抑制程序性坏死通路的下游事件,具有抑制氧化应激诱导的程序性坏死的能力。SS31对ARPE-19细胞有明显的抗氧化应激损伤作用,也能抑制线粒体膜电位的下降、减少坏死率、提高细胞的存活率。此外,SS31与Nec-1共处理氧化应激损伤的ARPE-19细胞也产生类似的保护作用。
综上所述,SS31对氧化应激损伤诱导程序性坏死和线粒体功能障碍有明显的抑制作用。SS31作为靶向抗氧化肽为AMD治疗提供了基础证据。但是,SS31对细胞的保护作用是否涉及其他未知的分子机制及程序性坏死相关信号通路,还有待进一步研究。
