miRNA-let-7c在逆转大鼠糖尿病视网膜病变中的作用
2020-07-24欧玉仑邝国平周小平
欧玉仑 邝国平 周小平
糖尿病视网膜病变(DR)是常见的糖尿病微血管并发症[1],超过1/3的糖尿病患者有DR,并且增加其他系统性血管并发症的风险[2]。临床现有的DR治疗方法疗效不理想。研究表明,许多miRNAs在角膜、晶状体、视网膜和其他眼组织中都有表达[3]。其中miRNA let-7c参与糖脂代谢过程,是胰岛素调节的信号途径之一[4],其在体内的过表达导致DR的特征,包括曲折的视网膜血管和有缺陷的周细胞覆盖[5]。而研究发现,抑制STAT3依赖的方式可减弱病理性视网膜血管生成[6],而miRNA let-7c的表达可抑制STAT3的磷酸化,使STAT3的表达明显降低[7]。因此,STAT3是调节视网膜生理和病理信号通路的关键介质[8]。目前,关于STAT3和miRNA let-7c在DR发病中的作用研究不多,而本研究旨在探讨miRNA let-7c如何通过调节糖尿病大鼠模型中的STAT3表达影响DR的发展。
1 材料与方法
1.1 材料雄性Sprague Dawley(SD)大鼠56只,体质量(200±20)g,购自上海斯莱克实验动物有限责任公司(合格证编号:2016-0005)。将动物饲养在温度为(25±20)℃、湿度为(50±2)%、光照12 h/黑暗12 h的动物房中。所有动物均可自由饮水和进食。
293T细胞(美国模式培养物集存库);链脲佐菌素(STZ,溶于0.01 mol·L-1柠檬酸盐,pH 4.4;美国Sigma公司);戊巴比妥(国药集团化学试剂有限公司)、荧光素钠注射液(广州白云山明兴制药有限公司);抗STAT3、miRNA-let-7c模拟物和Anti-miRNA-let-7c寡核苷酸序列(广州市锐博生物科技有限公司);RNA提取试剂盒、PrimeScript RT试剂盒(美国Invitrogen公司),SYBR Premix Ex TaqII试剂盒、RIPA缓冲液(上海碧云天生物技术有限公司);BCA蛋白质测定试剂盒(美国Thermo Fisher Scientific公司);PVDF膜(美国Merck Millipore公司);STAT3抗体(1500)、VEGFA抗体(1800)、BAX抗体(11000)、Bcl抗体(11000)及GAPDH抗体(12000)均购自美国Santa Cruz Biotechnology公司;二次抗体IgG(15000;美国Santa Cruz Biotechnology公司);K801-200荧光素酶测定试剂盒(美国Biovision公司);ABI Prism 7300系统(美国Applied Biosystems公司);一触式血糖仪(美国Johnson Lifecan公司);Micron-Ⅲ视网膜影像系统(美国Phoenix Research Labs公司);凝胶成像系统(美国Bio-Rad公司);miRNA let-7c、STAT3 mRNA和GAPDH的引物由日本TaKaRa公司合成。
1.2 DR大鼠模型的建立56只SD大鼠瞳孔大小形状一致,屈光介质清晰,光觉良好,无眼底异常。将大鼠分为DR组(n=48只)和正常组(n=8只),DR组大鼠空腹注射链脲佐菌素(STZ,45 mg·kg-1)诱导糖尿病,正常组大鼠注射等量柠檬酸盐缓冲液,所有大鼠自由饮水和进食。造模后每周称一次体质量,每3 d测一次血糖。大鼠尾部提取的静脉血血糖浓度≥16.7 mmol·L-1的被视为糖尿病模型。常规喂养12周后,进行视网膜电生理检查。此外,每组各取3只,釆用Micron-Ⅲ视网膜影像系统对各组大鼠右眼进行眼底观察和荧光造影检查。如果F-ERG波和Ops波的潜伏期延长,波幅降低,视网膜血管显影不清晰,则认为DR模型是成功建立的。
1.3 STAT3和miRNA-let-7c质粒载体的建立在抗STAT3寡核苷酸序列的末端合成BamHI和XhoI酶切位点,将片段克隆到pRNA-Lenti-EGFP慢病毒载体中以形成相应的重组表达载体pRNA-Lenti-miR-let-7c-EGFP(miRNA-let-7c过表达质粒)、pRNA-Lenti-anti-miRNA-let-7c-EGFP(miRNA-let-7c干扰表达质粒)、pRNA-Lenti-anti-STAT3-EGFP(STAT3干扰表达质粒)和pRNA-Lenti-vector-EGFP(空质粒)。对大肠杆菌DH5α进行转染,并采用PCR,双酶切和测序等方法进行检测。
1.4 细胞转染用胰蛋白酶消化对数生长的293T细胞,然后将细胞密度调整为106个·mL-1,并接种到96孔板中(每孔100 μL)。混合相应的质粒和慢病毒包装以转染293T细胞。收集转染48 h后的细胞,并使用RNA提取试剂盒提取总RNA。然后,进行qRT-PCR检测细胞中miRNA-let-7c和STAT3的mRNA表达。
1.5 动物分组将DR组大鼠再次分组如下:空白模型组,8只未经治疗的DR大鼠;miRNA-let-7c模拟物组:8只DR大鼠,玻璃体内注射4 μg miRNA-let-7c过表达质粒;Anti-miRNA-let-7c组:8只DR大鼠,玻璃体内注射4 μg miRNA-let-7c干扰表达质粒;阴性对照(NC)组:8只DR大鼠,玻璃体内注射4 μg空质粒;Anti-miRNA-let-7c+Anti-STAT3组:8只DR大鼠,玻璃体内注射4 μg miRNA-let-7c干扰表达质粒和4 μg STAT3干扰表达质粒;Anti-STAT3组:8只DR大鼠,玻璃体内注射4 μg STAT3干扰表达质粒。共注射两次质粒,2次注射间隔约10 d,最后一次注射后20 d大鼠采用腹腔内注射30 g·L-1戊巴比妥钠麻醉(2 mL·kg-1)处死。取出大鼠眼球前段视网膜组织,用于后续研究。
1.6 定量逆转录聚合酶链反应(qRT-PCR)采用RNA提取试剂盒,从每个转染组的细胞以及大鼠视网膜组织中提取总RNA。随后,根据厂家说明书使用PrimeScript RT试剂盒将RNA反转录为cDNA,反转录系统体积为10 μL。反应条件如下:37 ℃,15 min×3次(逆转录反应),85 ℃×5 s(逆转录酶失活反应)。将反应溶液用于以GAPDH为内部参照的定量荧光PCR,该反应按照SYBR Premix Ex TaqII试剂盒说明进行,反应系统的体积为50 μL,包含25 μL SYBR Premix Ex TaqII、2 μL PCR上游引物、2 μL PCR下游引物、1 μL ROX参考染料(50×),4 μL DNA模板和16 μL双蒸水,使用ABI Prism 7300系统进行定量荧光PCR,反应条件总共40个循环,在95 ℃预变性15 min,在95 ℃变性15 s,在60 ℃退火并延伸60 s。以GAPDH作为内部参照,使用2-ΔΔCt计算miRNA let-7c和STAT3的mRNA表达。引物序列如下:miRNA let-7c正向引物为5’-ACCTGTCACTGTCTTGTACCCTTGT-3’,反向引物为5’-CGGCGTTTGGAGTGGTAGAA-3’;STAT3正向引物为5’-GATGCGCACAAGGTCCTG-3’,反向引物为5’-CAGGGTGCTGTCCACACTGGCTCGC-3’;GAPDH正向引物为5’-AAGGTCATCCCAGAGCTGAA-3’,反向引物为5’-ATGTAGGCCATGAGGTCCAC-3’。
1.7 Western blot分析在大鼠视网膜组织中加入RIPA缓冲液以提取总蛋白质,然后使用BCA蛋白质测定试剂盒进行蛋白定量。采用SDS-PAGE电泳对不同相对分子质量的蛋白质进行等浓度分离,然后转移到PVDF膜上。用50 g·L-1脱脂奶粉封闭1.5 h后,加入STAT3抗体(1500)、VEGFA抗体(1800)、Bax抗体(11000)、Bcl抗体(11000)或GAPDH抗体(12000)孵育过夜,然后用辣根过氧化物酶标记的二次抗体IgG(15000)反应2 h。最后用PBS洗膜3次。使用电化学发光(ECL)溶液进行曝光和显影,并使用凝胶成像系统进行拍照。以GAPDH为内参照进行带灰度分析。将目标带与参考带的灰度值之比作为蛋白质的相对表达水平。
1.8 HE染色在用Davidson’s溶液将视网膜组织固定24 h后,进行常规脱水,透明化,蜡填充和石蜡包埋。将切片切成3 μm厚,并在50 ℃下烘烤1 h。常规HE染色后在光学显微镜下观察各组大鼠视网膜血管内皮细胞。
1.9 双荧光素酶报告基因检测分析miRNA-let-7c与STAT3的直接作用通过miRNA生物信息学目标预测软件预测了STAT3的3’非翻译区(3’UTR)中的miRNA-let-7c结合位点,并合成了包含miRNA-let-7c结合位点的STAT3 3’UTR的启动子区序列。随后,将它们插入pGL3 NC载体的5’末端的BglⅡ位点中,以构建STAT3 3’UTR的野生型(WT)质粒(命名为STAT3 3’UTR-WT)。基于STAT3 3’UTR-WT,通过突变miRNA-let-7c结合位点,构建STAT3 3’UTR的突变质粒(命名为STAT3 3’UTR-MUT)。在本实验中使用的报告载体是pcDNA3.1-LUC质粒,其编码萤火虫荧光素酶。为了测量转染效率,将pRL-TK转染为内部对照,其编码海肾荧光素酶。分别单独或与miRNA-let-7c mimic转染293T细胞。在转染后24 h,通过使用K801-200荧光素酶测定试剂盒测定荧光素酶活性。
1.10 统计学方法本研究利用SPSS 21.0分析数据,测量结果用均数±标准差表示。组间比较采用t检验,多组比较采用单因素方差分析。通过Pearson相关分析来分析测量数据之间的相关性。检验水准:α=0.05。
2 结果
2.1 DR大鼠模型的评价DR组和正常组大鼠的生存率为100%。在建立模型前,DR组和正常组大鼠的体质量分别为(196±6)g和(200±7)g;血糖浓度为(6.3±0.5)mmol·L-1和(5.2±0.4)mmol·L-1,差异均无统计学意义(均为P>0.05)。在建立模型后4周、8周和12周,DR组大鼠体质量分别为(187±15)g、(179±19)g和(168±22)g,显著低于正常组大鼠的(235±21)g、(281±19)g和(317±23)g;DR组血糖浓度分别为(21.7±3.6)mmol·L-1、(20.8±3.1)mmol·L-1和(21.5±2.9)mmol·L-1,显著高于正常组的(5.3±0.6)mmol·L-1、(5.2±0.2)mmol·L-1和(5.3±0.4)mmol·L-1,差异均有统计学意义(均为P<0.05)。
2.2 miRNA let-7c与STAT3 mRNA表达的相关性空白模型组和NC组之间的miRNA-let-7c和STAT3的mRNA表达差异均无统计学意义(均为P>0.05)。miRNA let-7c组的miRNA-let-7c mRNA相对表达量为1.40±0.02,显著高于空白模型组的0.62±0.01;miRNA let-7c组的STAT3 mRNA相对表达量为1.11±0.01,显著低于空白模型组的2.22±0.04;而Anti-miRNA-let-7c组的miRNA-let-7c mRNA的表达显著下降为0.21±0.01,Anti-miRNA-let-7c组的STAT3 mRNA表达显著增加为3.84±0.40(P<0.05)。在四组之间进行miRNA-let-7c和STAT3 mRNA表达的相关分析,结果显示:miRNA-let-7c与STAT3的mRNA表达呈负相关(r=-0.906,P<0.001)。见图1。

图1 miRNA-let-7c与STAT3 mRNA表达的相关性分析
2.3 DR组大鼠视网膜组织病理变化HE结果显示,正常组大鼠具有清晰、连续的内界膜,视网膜内界膜附近的玻璃体中只有少数切片可见血管内皮细胞。空白模型组、NC组、miRNA-let-7c组和Anti-miRNA-let-7c+Anti-STAT3组大鼠视网膜表面呈现轻度水肿,轻度紊乱的细胞层,少量视网膜新生血管芽和略微不规则的扩张性血管腔。与NC组相比,Anti-STAT3组大鼠视网膜表面无明显的细胞水肿;此外,细胞层排列有序,偶尔可见视网膜新生血管芽,血管腔切面规则,血管内皮细胞核明显减少。Anti-miRNA-let-7c组大鼠视网膜表面出现水肿,细胞层排列不规则,视网膜新生血管芽,血管腔切面不规则扩大,而血管内皮细胞核显著增加(图2)。各组血管内皮细胞计数均高于正常组[(3±0)个];Anti-miRNA-let-7c组[(58±6)个]和Anti-miRNA-let-7c+Anti-STAT3组[(15±2)个]的血管内皮细胞计数显著高于空白模型组[(24±3)个];miRNA-let-7c组[(16±3)个]和Anti-STAT3组的[(14±3)个]的血管内皮细胞计数显著低于空白模型组,差异均有统计学意义(均为P<0.05)。
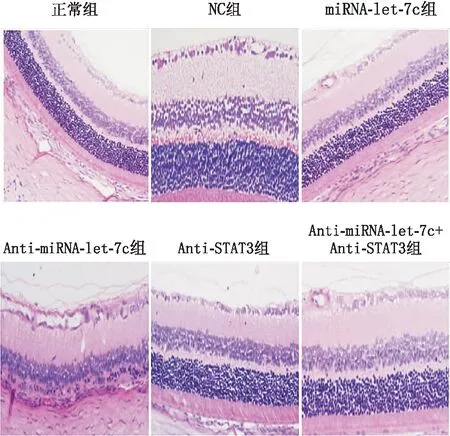
图2 各组大鼠视网膜组织HE染色结果(×200)
2.4 miRNA let-7c和STAT3与DR发展的相关性qRT-PCR结果表明,与正常组大鼠视网膜组织中miRNA-let-7c mRNA表达(2.61±0.31)比较,除miRNA-let-7c组表达[(2.24±0.25)]无显著差异(P>0.05)外,其他各组大鼠视网膜组织中的miRNA-let-7c mRNA表达均有明显差异(均为P<0.05)。与空白模型组(1.43±0.23)、NC组(1.32±0.17)大鼠视网膜组织中miRNA-let-7c mRNA表达相比,除Anti-STAT3组(0.84±0.11)无差异(P>0.05)外,miRNA-let-7c组、Anti-miRNA-let-7c组(0.62±0.05)、Anti-miRNA-let-7c+ Anti-STAT3组(0.72±0.08)均有明显差异(均为P<0.05)。
与正常组大鼠视网膜中的STAT3、VEGFA和Bax蛋白表达比较,除了Anti-STAT3组均无差异外(均为P>0.05),其他各组均有明显差异(均为P<0.05)。与空白模型组、NC组相比,miRNA-let-7c组和Anti-STAT3组大鼠视网膜中STAT3的VEGFA和Bax蛋白表达均显著降低(均为P<0.05);而Anti-miRNA-let-7c组大鼠视网膜中STAT3、VEGFA和Bax蛋白表达均显著升高(均为P<0.05)。各组Bcl-2蛋白的表达差异无统计学意义。见表1。

表1 各组大鼠视网膜中各种蛋白的表达
2.5 STAT3是否为miRNA-let-7c的靶基因验证结果根据microRNA.org(http://www.microrna.org/microrna/)在线预测miRNA靶基因的工具发现,STAT3为miRNA-let-7c的靶基因。该预测工具显示STAT3的3’UTR与miRNA-let-7c的结合域中的高度保守性(图3)。用miRNA-let-7c模拟物转染后,双荧光素酶报告基因检测结果表明,STAT3 3’UTR-WT的相对荧光素酶活性为0.55±0.03,低于WT+NC组的1.04±0.18(P<0.05);MT+miRNA-let-7c模拟组(1.05±0.11)或MT+NC组(0.87±0.06)中未观察到相对荧光素酶活性的差异。

图3 miRNA-let-7c和STAT3 3’非翻译区(3’UTR)的碱基配对
3 讨论
DR是一种慢性微血管并发症,严重威胁并最终影响糖尿病患者的视力[1]。尽管在DR的预防和治疗方面取得了重大进展,但是DR的失明率并未见下降,这表明DR的预防和抑制仍然面临多重挑战,需要进一步研究。与传统的临床检查和视网膜图像分析相比,循环microRNAs可能在预防和治疗DR进展中至关重要。因此,针对STAT3的miRNA-let-7c调控作用及其机制的见解可为治疗DR提供新的方法。
本研究在DR大鼠造模实验中发现,随着时间的推移,正常组大鼠体质量持续增加且血糖保持基本不变,而DR组大鼠体质量持续下降且血糖浓度从第4周显著增加,然后维持在约21.0 mmol ·L-1。在对miRNA-let-7c、STAT3和DR之间相关性关系的研究中发现,DR大鼠的miRNA-let-7c表达降低,而STAT3的表达显著增加,表明miRNA-let-7c和STAT3表达呈负相关。MicroRNA是非编码的小分子RNA,可以调节植物、动物和原生动物的基因表达。其中,miRNA-let-7c靶标富含与2型糖尿病相关的单核苷酸多态性的基因,已被证明可调节葡萄糖代谢和胰岛素敏感性[5,9]。研究表明,miRNA-let-7c和糖尿病相关的视网膜疾病有关,并且miRNA-let-7c-Tg小鼠显示出DR特征,其中包括弯曲的视网膜血管和有缺陷的周细胞覆盖[10]。MicroRNA可以影响胰岛素的合成和分泌,改善胰岛素抵抗性脂肪组织的代谢,从而影响糖尿病的发展和随后的并发症[11]。此外,视网膜组织中有大量的microRNA表达,与正常组织相比,病理性视网膜组织中某些microRNA的表达显著降低[12],解释了本研究观察到的DR大鼠中miRNA-let-7c表达减少。STAT3是调节视网膜生理和病理信号通路的关键介质,因此为治疗干预提供了主要靶点。对STAT3通路的直接和间接抑制在多种炎症相关的眼病中具有保护作用[13]。此外,VEGF的抑制以STAT3依赖性方式减弱病理性视网膜血管生成[14]。多项研究将STAT3活性与DR疾病进展联系在一起。首先,糖尿病大鼠视网膜中的STAT3蛋白水平升高。其次,抑制STAT3可以降低糖尿病大鼠模型中视网膜细胞的死亡,并降低 1型糖尿病小鼠模型中的视网膜炎症[15]。此外,烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶抑制剂和他汀类药物通过灭活STAT3来防止与氧化应激相关的DR病理[16]。在这项研究中,STAT3被证明是miRNA-let-7c的靶基因,该结果与生物信息学预测一致,表明miRNA-let-7c可以与STAT3 mRNA的3’UTR种子区中的碱基结合,从而导致靶向抑制作用。
本研究发现,miRNA-let-7c mRNA表达的增加和STAT3蛋白表达的减少可能会降低DR大鼠的微血管内皮细胞的数量并抑制视网膜新血管芽的形成,这对于DR的治疗具有重要意义。DR可以诱导多种血管生长因子的合成和释放,并可以促进视网膜血管内皮细胞的增殖、迁移和血管生成。然而,未成熟的新生血管组织不能形成正常的视网膜屏障,这会导致眼底出血[17]。血管生成是DR的最重要特征之一,是在先前血管的基础上生成新血管网络的过程,可能会导致玻璃体出血或牵引性视网膜脱离,甚至导致严重的视力丧失。VEGFA是促血管生成因子,在促进内皮细胞的存活、迁移和增殖以及增强血管通透性中发挥作用,并且VEGFA对于血管生长是必不可少的,特别是在血管受累和器官重塑的病理学中[18]。Arthur等[19]研究发现,在糖尿病小鼠视网膜和高糖处理的内皮细胞中,VEGFA mRNA表达增加。本研究观察到DR大鼠中VEGFA蛋白表达显著升高,而miRNA-let-7c过表达和STAT3低表达均有助于降低DR大鼠的VEGFA蛋白表达,表明miRNA-let-7c可能通过STAT3对其下游靶基因VEGFA产生负调控。由于DR是微血管并发症之一,因此可以推测,miRNA-let-7c过表达有助于降低微血管生成和内皮细胞核数目,延缓DR的发展。
Bax是一种促凋亡蛋白,在人类糖尿病视网膜中观察到Bax表达增强,而Bcl-2是一种抗凋亡蛋白,下调Bcl-2表达后,糖尿病细胞凋亡增加[20]。Pastor-Idoate等[21]认为,STAT3的上调促进了Bax的易位,随后增强了高葡萄糖诱导的线粒体功能障碍,并引发了过量的活性氧生成,从而导致了视网膜神经元的氧化应激。本研究发现,miRNA-let-7c过表达和STAT3低表达均降低了DR大鼠视网膜组织中的Bax蛋白表达,这有助于抑制细胞凋亡,并保护视网膜神经元。
总之,本研究表明,miRNA-let-7c的过表达可以下调STAT3的水平,降低DR大鼠的视网膜内皮细胞核数目,并抑制视网膜组织中的VEGFA、Bax的蛋白表达。然而,由于本实验使用的大鼠模型数量有限,未来需进行大样本量的前瞻性研究,以提供更精确的估计,以证实miRNA-let-7c在DR中的作用,并最终为DR的治疗开发新的遗传治疗策略的靶标。
