昆仑雪菊水提物通过AMPK-mTOR通路调节INS-1胰岛β细胞自噬的研究
2020-07-24新疆医科大学附属中医院新疆乌鲁木齐8300新疆医科大学药学院新疆乌鲁木齐8300
(.新疆医科大学附属中医院,新疆 乌鲁木齐 8300;.新疆医科大学药学院,新疆 乌鲁木齐 8300)
新疆昆仑雪菊为新疆特有植物,学名为两色金鸡菊(coreopsis tinctoria),属菊科金鸡菊属一年生草本植物。现代药理学研究表明昆仑雪菊具有调血脂、降血压、降血糖、抗衰老、抗凝血以及调节肠道菌群等药理作用[1-6]。本课题组前期研究结果证实昆仑雪菊水提物可显著抑制棕榈酸所致INS-1胰岛β细胞的损伤,但其作用机理尚未明确[7]。因此本研究基于棕榈酸诱导胰岛β细胞损伤模型,从调节自噬角度分析新疆昆仑雪菊水提物对胰岛β细胞的保护作用机制,为其在保护胰岛细胞、防治糖尿病方面的进一步开发利用提供理论支持。
1 材料与方法
1.1 实验材料
大鼠胰岛素瘤INS-1细胞株(购自吉凯生物公司);昆仑雪菊水提物冻干粉由本课题组自主研制。
1.1.1 主要仪器 CO2细胞培养箱(Smart Cell HF-90,上海力康仪器有限公司),生物安全柜(HF 1200 LC,上海力康仪器有限公司),荧光倒置显微镜(Eclipse TS 100-F,日本尼康公司),全光栅酶标仪(美国BIORAD公司),电子分析天平(AB304-S,德国梅特勒公司),流式细胞仪(EPICS ALTRA,美国Beckman Coulter公司),化学发光成像仪系统(Chemiscope 3000,上海勤翔科学仪器有限公司),蛋白转膜仪(Mini-PROTEAN Tetra system,美国伯乐公司),电泳仪(DYCZ-24DN,北京六一仪器厂)。
1.1.2 主要试剂 胎牛血清(FBS,批号16000044,美国Life technologies公司),RPMI 1640培养基(批号ZLI-9062,美国Gibco公司),0.25%胰酶(Trypsin-EDTA,批号25200-056,美国Gibco公司),青霉素-链霉素双抗(10 000 U)(货号SC30010,美国Gibco公司),CCK8试剂盒(货号FC101-03,北京全式金生物公司),化合物 C(货号P5499-5MG,美国Sigma公司),β-巯基乙醇(货号M3148-25ML,美国Sigma公司),棕榈酸(货号P0500-25G,美国Sigma公司),DAPI染色液(北京索莱宝科技有限公司),AnnexinV-FITC试剂盒(上海贝博生物公司)。一抗兔抗鼠LC3A/B多克隆抗体(货号12741T),兔抗鼠AMPKα多克隆抗体(货号5832T),兔抗鼠Phospho-AMPKα(Thr172)多克隆抗体(货号2535T),兔抗鼠mTOR多克隆抗体(货号2983T),兔抗鼠Phospho-mTOR(Ser2448)多克隆抗体(货号5536T),兔抗鼠Hamartin/TSC1多克隆抗体(4906S)均购自美国Cell Signaling公司。超敏发光液(批号34080,美国Thermo公司),BCA 蛋白定量试剂盒(货号PA115-02,北京天根公司),HRP标记羊抗兔IgG二抗(批号31460,美国Thermo公司)。
1.2 方法
1.2.1 试剂配制 昆仑雪菊水取物溶液配制:用DMSO溶液将昆仑雪菊水提物配置成终浓度为50 mg·mL-1的溶液,后续不同浓度的昆仑雪菊水提物溶液用完全培养基稀释获得。
棕榈酸(palmitic acid,PA)溶液配制:首先用0.1 mol·L-1的NaOH将棕榈酸固体在70 ℃水浴中溶解为100 mmol·L-1溶液,同时用蒸馏水配制5%的BSA的水溶液,70 ℃水浴,再将100 mmol·L-1的棕榈酸溶液与5%的BSA溶液(1∶9)混合,70 ℃水浴震荡10 s,70 ℃水浴10 min,取出冷却,0.22 μm滤膜过滤备用。
化合物C:用DMSO溶液将固体化合物C配置成终浓度为10 mmol·L-1的溶液,后续不同浓度的化合物C溶液用完全培养基稀释获得。
1.2.2 细胞培养 INS-1细胞用含体积分数10%FBS的RPMI-164培养基(含11.1 mmol·L-1葡萄糖、10 mmol·L-1HEPES、50 μmol·L-1β-巯基乙醇,1 mmol·L-1丙酮酸钠,100 U·mL-1青霉素、100 μg·mL-1链霉素)培养,置于37 ℃、5%CO2培养箱孵育。
1.2.3 细胞分组与药物干预 将INS-1细胞按70%汇合率接种到细胞培养瓶中,37 ℃、5%CO2、饱和湿度培养24 h贴壁后,将细胞分为:正常对照组(加入完全培养基),棕榈酸组(加入棕榈酸190 μmol·L-1进行干预),0.1 μg·mL-1昆仑雪菊水提物+棕榈酸组(加入昆仑雪菊水提物0.1 μg·mL-1预处理2 h+棕榈酸190 μmol·L-1进行干预),5 μg·mL-1昆仑雪菊水提物+棕榈酸组(加入昆仑雪菊水提物5 μg·mL-1预处理2 h+棕榈酸190 μmol·L-1进行干预),10 μg·mL-1昆仑雪菊水提物+棕榈酸组(加入昆仑雪菊水提物10 μg·mL-1预处理2 h+棕榈酸190 μmol·L-1进行干预),化合物C+10 μg·mL-1昆仑雪菊水提物+棕榈酸组(加入化合物C 20 μmol·L-1+昆仑雪菊水提物10 μg·mL-1预处理2 h+棕榈酸190 μmol·L-1进行干预)。
1.2.4 Western Blotting检测自噬相关蛋白LC3-I/LC3-Ⅱ 将INS-1细胞按70%汇合率接种到细胞培养瓶中,37 ℃、5%CO2、饱和湿度培养24 h贴壁后,按“1.2.3”项下方法进行分组及药物干预,每组3个重复。36 h后取出细胞,弃去瓶中的培养基,加入3 mL无菌的PBS缓冲液反复冲洗2遍,弃去PBS缓冲液,用胰酶消化细胞离心后弃去上清留细胞沉淀,用5 mL无菌PBS洗一遍后收集细胞,按照Western Blotting实验标准操作。
1.2.5 Western Blotting检测AMPK、mTOR、p-AMPK、p-mTOR、TSC1的表达水平 将INS-1细胞按70%汇合率接种到细胞培养瓶中,37 ℃、5%CO2、饱和湿度培养24 h贴壁后,按“1.2.3”项下方法进行实验分组及药物干预,每组3个重复。36 h后取出细胞,弃去瓶中的培养基,加入3 mL无菌的PBS缓冲液反复冲洗2遍,弃去PBS缓冲液,用胰酶消化细胞离心后弃去上清留细胞沉淀,用5 mL无菌PBS洗一遍后收集细胞,后续实验按照Western Blotting实验标准操作。
1.2.6 统计学分析 采用SPSS19.0统计软件进行分析,多组间比较应用单因素方差分析,方差齐时采用LSD法进行组间多重比较,方差不齐时采用Dunnett's T3法进行组间多重比较,实验数据以均数±标准差表示,P < 0.05为差异具有统计学意义,采用GraphPad Prism 5.0软件辅助作图。
2 结果
2.1 昆仑雪菊水提物对棕榈酸作用下INS-1细胞自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ表达的影响
实验结果表明,与正常组相比,棕榈酸组LC3-Ⅱ/LC3-Ⅰ蛋白表达比值水平明显降低(P < 0.05),说明细胞自噬被抑制;与棕榈酸组比较,昆仑雪菊水提物剂量依赖性的上调LC3-Ⅱ表达水平,降低LC3-Ⅰ表达水平,LC3-Ⅱ/LC3-Ⅰ比值明显升高,表明细胞自噬被激活,且呈剂量依赖性,在10 μg·mL-1组作用最明显(P < 0.05)。具体结果见表1和图1。
2.2 昆仑雪菊水提物对AMPK-mTOR信号通路关键分子蛋白表达水平的影响
实验结果表明,与正常组比,棕榈酸组AMPK蛋白磷酸化水平明显降低(P < 0.05),mTOR蛋白磷酸化水平显著升高(P < 0.05),TSC1蛋白水平明显降低(P < 0.05);与棕榈酸组比较,昆仑雪菊水提物可以上调AMPK蛋白磷酸化水平,可显著降低mTOR蛋白磷酸化水平,上调TSC1蛋白水平,其中10 μg·mL-1组作用最明显(P < 0.05)。说明昆仑雪菊水提物可通过激活AMPK-mTOR信号通路来激活细胞自噬。具体结果见表1、图2。
2.3 AMPK抵制剂化合物C干预可逆转昆仑雪菊水提物对AMPK-mTOR信号通路的调控作用
实验结果表明,与昆仑雪菊水提物+棕榈酸组比较,AMPK抑制剂化合物C可以逆转昆仑雪菊水提物对AMPK-mTOR信号通路关键分子蛋白表达水平的调节作用(P < 0.05)。详见图3。
3 讨论
昆仑雪菊为新疆地产药用植物资源,在民间多作茶饮,常用于改善高血压、高血脂、糖尿病等慢性疾病。作为药食两用植物,其在食品保健、医药学等方面具有很大研究开发价值。本课题组前期动物实验研究证实昆仑雪菊可以降低糖尿病动物血糖,改善胰岛素抵抗,提高胰岛素敏感性,抗氧化和保护胰岛细胞,对2型糖尿病具有一定的防治作用[8-9]。细胞水平研究发现昆仑雪菊水提物对高脂环境下的胰岛β细胞有保护作用,能够显著抑制PA致INS-1细胞的损伤,且对INS-1细胞损伤的保护作用呈剂量依赖性[7]。但上述研究对昆仑雪菊降血糖和保护胰岛β细胞的机制尚不清楚。
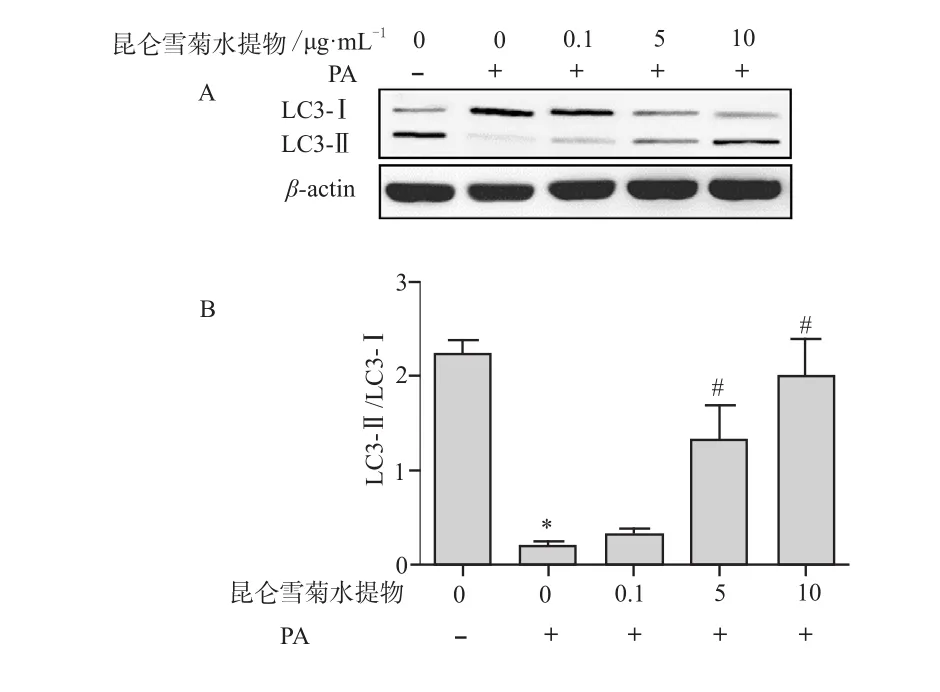
图1 昆仑雪菊水提物对PA作用下INS-1细胞中LC3-Ⅱ/LC3-Ⅰ蛋白的影响A - Western Blotting法检测LC3-Ⅱ/LC3-Ⅰ蛋白水平,B - LC3-Ⅱ/LC3-Ⅰ蛋白表达水平的半定量分析注:与正常对照组比较,*P < 0.05;与PA组比较,#P < 0.05Fig 1 The effect of Kunlun coreopsis tinctoria aqueous extract on the LC3-Ⅱ / LC3-Ⅰ protein expression in INS-1 cells under the action of the PAA - Western Blotting method to detect LC3-Ⅱ /LC3-Ⅰ protein levels,B - LC3-Ⅱ /LC3-Ⅰ protein levels of half quantitative analysisNote: compared with control group, *P < 0.05; compared with PA group, #P < 0.05
表1 昆仑雪菊水提物对棕榈酸作用下的INS-1细胞中自噬相关蛋白表达的影响. ±s,n = 18Tab 1 Effect of Kunlun coreopsis tinctoria aqueous extract on the autophagy protein expression in INS-1 cells by palmitic acid.±s, n = 18

表1 昆仑雪菊水提物对棕榈酸作用下的INS-1细胞中自噬相关蛋白表达的影响. ±s,n = 18Tab 1 Effect of Kunlun coreopsis tinctoria aqueous extract on the autophagy protein expression in INS-1 cells by palmitic acid.±s, n = 18
注:与正常对照组比较,*P < 0.05;与PA组比较,#P < 0.05;与昆仑雪菊水提物(10 μg·mL-1)+ PA组比较,▲P < 0.05Note: compared with control group, *P < 0.05; compared with PA group, #P < 0.05; compared with Kunlun coreopsis tinctoria aqueous extract (10 μg·mL-1) + PA group, ▲P < 0.05
组别 LC3-Ⅰ/LC3-Ⅱ AMPK p-AMPK mTOR p-mTOR TSC1正常对照组 2.283±0.180 0.692±0.018 0.659±0.029 0.678±0.071 0.372±0.064 0.607±0.127 PA组 0.217±0.034* 0.708±0.069 0.388±0.051 0.731±0.090 0.830±0.070* 0.308±0.119*0.1 μg·mL-1昆仑雪菊水提物+PA组 0.342±0.066* 0.670±0.038 0.511±0.114 0.689±0.045 0.739±0.014* 0.371±0.162*5 μg·mL-1昆仑雪菊水提物+PA组 1.179±0.320*# 0.713±0.035 0.505±0.124 0.677±0.051 0.560±0.090*# 0.416±0.049 10 μg·mL-1昆仑雪菊水提物+PA组 2.170±0.363# 0.703±0.043 0.683±0.130# 0.680±0.086 0.439±0.070# 0.517±0.103#化合物C+10 μg·mL-1昆仑雪菊水提物+PA组1.188±0.051*#▲ 0.683±0.031 0.471±0.012*▲ 0.655±0.061 0.606±0.067*#▲ 0.300±0.098*▲
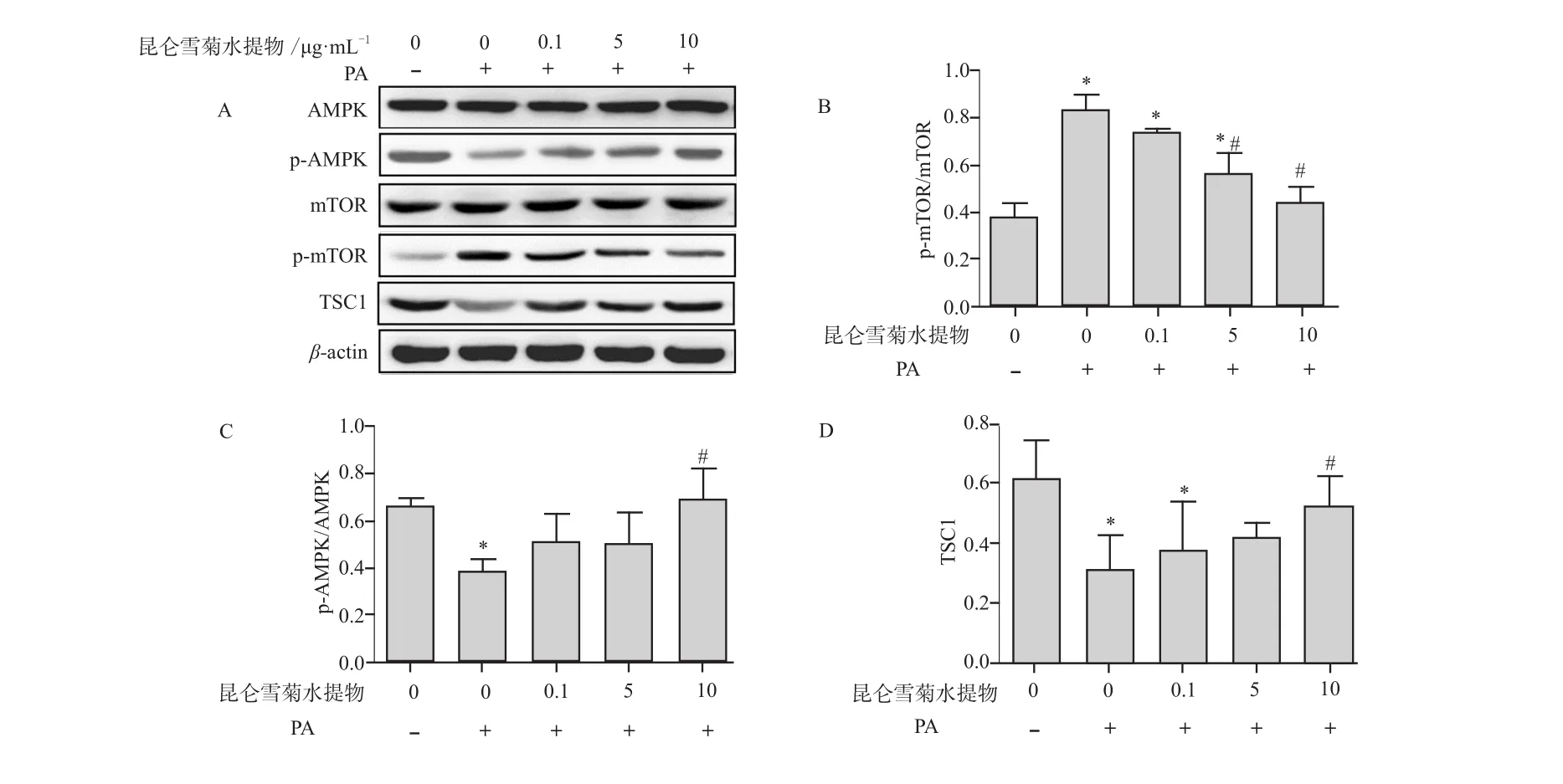
图2 昆仑雪菊水提物对PA作用下INS-1细胞中AMPK-mTOR信号通路的影响A - Western Blotting法检测p-AMPK、p-mTOR及TSC1蛋白水平,B - p-mTOR表达的半定量分析,C - p-AMPK表达的半定量分析,D -TSC1蛋白的半定量分析注:与正常对照组比较,*P < 0.05;与PA组比较,#P < 0.05Fig 2 The effect of Kunlun coreopsis tinctoria aqueous extract on the AMPK-mTOR pathway in INS-1 cells under the action of the PAA - Western Blotting method is used to detect p-AMPK, p-mTOR and TSC1 protein levels, B - Half quantitative analysis of p-mTOR protein levels,C - Half quantitative analysis of p-AMPK protein levels, D - Half quantitative analysis of TSC1 protein levelsNote: compared with control group, *P < 0.05; compared with PA group, #P < 0.05

图3 AMPK抑制剂对AMPK-mTOR信号通路的影响A - Western Blotting法检测p-AMPK、p-mTOR及TSC1蛋白水平,B - p-mTOR表达的半定量分析,C - p-AMPK表达的半定量分析,D -TSC1蛋白的半定量分析注:与正常对照组比较,*P < 0.05;与PA组比较,#P < 0.05;与昆仑雪菊水提物(10 μg·mL-1)+ PA组比较,▲P < 0.05Fig 3 The effect of AMPK inhibitors on the AMPK-mTOR signaling pathwayA - Western Blotting method is used to detect p-AMPK、p-mTOR and TSC1 protein levels,B - Half quantitative analysis of p-mTOR protein levels,C - Half quantitative analysis of p-AMPK protein levels,D - Half quantitative analysis of TSC1 protein levelsNote: compared with control group, *P < 0.05; compared with PA group, #P < 0.05; compared with Kunlun coreopsis tinctoria aqueous extract (10 μg·mL-1) + PA group, ▲P < 0.05
自噬是溶酶体降解受损的细胞器、蛋白质聚集体以及回收营养物质的一种分解代谢的过程。众多研究提示,自噬在维持细胞内环境稳态,胰岛β细胞含量及胰岛素抵抗等方面发挥重要作用[10-13]。自噬可以保护胰岛β细胞的结构,维持胰岛素的正常分泌和稳态,减轻胰岛β细胞氧化应激,防止细胞凋亡以及清除泛素化蛋白聚集物等。说明自噬在糖尿病的发生和发展过程中起着重要作用,可能成为预防和治疗糖尿病的一个新靶点[14]。因此本研究以自噬作为研究靶标探讨昆仑雪菊水提物对PA诱导的INS-1细胞损伤的保护作用机制。研究结果显示,与PA对照组比较,昆仑雪菊水提物可剂量依赖性地上调自噬体标志蛋白LC3-Ⅱ/LC3-Ⅰ的比值,提示昆仑雪菊水提物可激活细胞自噬。
AMPK-mTOR作为自噬过程中的重要调控途径,在许多情况下,AMPK通过磷酸化激活ULK1进而激活自噬联级反应,而mTOR则通过磷酸化抑制自噬的发生[15-17]。本实验结果显示,昆仑雪菊水提物明显上调AMPK的磷酸化水平,同时抑制mTOR的磷酸化水平,上调TSC1蛋白表达水平。说明昆仑雪菊水提物可能通过调控AMPK-mTOR信号通路激活自噬的发生,进而保护高脂环境下的胰岛细胞。进一步实验结果显示,预先给予AMPK抑制剂化合物C处理INS-1细胞后,与昆仑雪菊水提物加PA组比较,此时p-AMPK表达水平明显降低,而p-mTOR表达水平显著增加,自噬相关蛋白TSC1表达明显下调,说明昆仑雪菊水提物诱导的细胞自噬被抑制。研究结果表明,昆仑雪菊水提物通过AMPK-mTOR信号通路激活细胞自噬,进而发挥其抗脂毒性的胰岛β细胞保护作用。
综上所述,本研究探讨了昆仑雪菊水提物对棕榈酸作用下胰岛β细胞损伤的保护作用机制,阐明昆仑雪菊水提物可通过调控AMPK-mTOR信号通路激活细胞自噬,进而保护胰岛β细胞的脂毒性损伤,从而为其在保护胰岛细胞功能、防治糖尿病方面的进一步开发利用提供了实验和理论的支持。
