乳腺炎对牛奶外泌体功能的影响:基于乳腺上皮细胞的观察
2020-07-24应易恬杨璟严冰璇邵冯金谭勋
应易恬,杨璟,严冰璇,邵冯金,谭勋
(浙江大学动物科学学院,杭州310058)
外泌体(exosome,exo)是一种具有双层质膜结构的细胞外小囊泡,广泛存在于各种体液中,是细胞-细胞间通讯联系的重要介导者之一[1]。外泌体携带有其母细胞所具有的蛋白质、DNA、mRNA 和微RNA(microRNA,miRNA)等功能性分子,这些分子随着外泌体被受体细胞摄取而被整合到受体细胞中,对受体细胞的生物学功能发挥起着重要的作用[2-4]。乳腺炎是奶牛最常见的感染性疾病之一,给养牛业带来巨大经济损失[5-6]。牛奶中含有丰富的外泌体[7-8]。既往的研究发现,牛奶外泌体的成分可因乳腺感染而发生改变[9],但有关乳腺炎牛奶外泌体的病理效应尚未见报道。乳腺上皮细胞(mammary epithelial cells, MECs)具有表达抗菌物质和促炎细胞因子的能力,在乳腺天然免疫机制中发挥重要作用[9-10]。本研究通过观察乳腺炎牛奶外泌体对体外培养的MECs 活力及免疫机能的影响,旨在初步明确外泌体在乳腺炎发病机制中的作用。
1 材料与方法
1.1 MECs 细胞及乳腺炎病原来源
原代培养的MECs 细胞由本实验室保存,冻存于-196 ℃液氮中。大肠埃希菌(Escherichia coli)菌株分离自临床型乳腺炎牛奶,经16S rRNA 测序鉴定后,保存于甘油中。
1.2 转录组测序
1.2.1 细胞处理
取培养至第4 代的MECs,用含15%小牛血清(杭州四季青生物工程材料有限公司)、1 μg/mL 胰岛素、2.5 μg/mL 两性霉素和200 μg/mL 庆大霉素的Dulbecco 改良培养基(Dulbecco’s modified Eagle medium,DMEM)稀释后,按6×105个/孔接种于6 孔板中。将细胞分为2组,一组为乳腺炎病原刺激组,一组为对照组,每组3 个重复。对大肠埃希菌计数后,将其置于70 ℃水浴锅中灭活30 min,经琼脂糖平板鉴定无菌落生长后,按1×107CFU/mL的剂量加入MECs 培养基中,在37 ℃、5% CO2条件下培养24 h 后,用磷酸缓冲盐溶液(phosphate buffer saline,PBS)漂洗3次,收集细胞。
1.2.2 总RNA 提取
采用TRIzol 法提取细胞总RNA,利用Nano-Drop 分光光度计检测RNA 浓度与纯度,并利用Agilent 2100生物分析仪检测RNA的完整性。
1.2.3 cDNA 文库构建
质检合格的mRNA用带有Oligo(dT)的磁珠富集并进行片段化处理。以mRNA 为模板,用6 碱基随机引物合成第1 条cDNA 链,然后加入缓冲液、dNTPs、核糖核酸酶H(RNase H)和DNA 聚合酶Ⅰ来合成第2 条cDNA 链。将纯化的双链cDNA 进行末端修复,加A 尾并连接测序接头,用AMPure_XP磁珠(AMPure_XP_beads)进行片段大小选择,最后通过聚合酶链式反应(polymerase chain reaction,PCR)富集得到cDNA文库。
1.2.4 测序及数据分析
将构建好的cDNA 文库用IlluminaHiSeq 平台进行测序。使用Cufflinks 2.2.1 软件对转录本和基因的表达水平进行定量,并用edgeR 软件包筛选差异表达基因,以差异倍数(fold change)>1 且q<0.05作为筛选标准。对差异表达基因进行基因本体(gene ontology,GO)功能注释和分类富集分析。
1.3 牛奶样品
从杭州市郊区某奶牛场无菌采集奶样,置于冰盒中运输至实验室。采用牛奶体细胞自动计数仪(FossomaticTMMinor Foss Integrator,丹麦)进行体细胞计数(somatic cell count,SCC),并选择1份高SCC奶样(SCC=20.1×105mL-1)和1份低SCC奶样(SCC=5.9×103mL-1)进行细菌分离培养和鉴定,其中:从高SCC 奶样中分离出1 株细菌,经16s RNA 测序鉴定,确认为肠球菌;在低SCC奶样中未分离到细菌。选择该2份奶样进行后续试验。
1.4 外泌体提取
具体步骤如下:取25 mL 奶样置于离心管中,4 ℃、3 000g离心30 min 以去除大部分乳脂和细胞碎片;将上清液转移至新管中,重复上述步骤以去除剩余乳脂和细胞碎片;将上清液用多层纱布过滤后,4 ℃、2.15×104g离心60 min;取上清液,经0.45 μm微孔滤膜过滤以去除酪蛋白,4 ℃、1.0×105g离心60 min;再取上清液,经0.22 μm微孔滤膜过滤,去除剩余酪蛋白,4 ℃、1.35×105g离心90 min;去掉上清液,沉淀用PBS 稀释,4 ℃、1.35×105g离心60 min;再将沉淀用PBS稀释,经0.22 μm微孔滤膜过滤,于-80 ℃冰箱中保存,备用。
1.5 外泌体的表征
1.5.1 透射电子显微镜观察
取5 μL 外泌体样品滴于铜网上,自然干燥,用0.1%乙酸双氧铀溶液负染,在JEM1200-EX透射电子显微镜(JEOL公司,日本)下观察外泌体的形态。
1.5.2 外泌体标志蛋白检测
外泌体经二喹啉甲酸(bicinchoninic acid,BCA)法定量后,99 ℃变性10 min,然后在12%凝胶上进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),接着电转印至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,用5%脱脂牛奶封闭2 h 后,分别加入肿瘤特异性糖蛋白101(tumorspecific glycoprotein,TSG101)(1∶200)和膜联蛋白A2(annexin A2)(1∶200)(Santa Cruz 生物技术公司,美国)抗体,4 ℃孵育过夜。PVDF膜用Tris-盐酸缓冲液(Tris buffered saline Tween-20,TBST)洗涤3 次,每次10 min,然后加入辣根过氧化物酶标记的羊抗鼠IgG(1∶2 000)(武汉博士德生物工程有限公司),室温孵育1 h,用TBST洗涤3次后,采用增强化学发光(enhanced chemiluminescence,ECL)法显色。
1.6 细胞活力检测
将MECs用DMEM完全培养基稀释后(培养血清预先进行去外泌体处理),按1.2×104个/孔接种于96 孔板中;向培养基中分别加入1 μg/mL 正常牛奶外泌体(N-exo)和乳腺炎牛奶外泌体(M-exo),置于37 ℃、5%CO2培养箱中培养20 h后,加入200 mL含10 mg/mL 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(methyl-thiazol-diphenyltetrazolium, MTT)的新鲜培养基,继续培养4 h后,离心去上清液,沉淀用200 μL二甲基亚砜(dimethylsulfoxide,DMSO)溶解,于540 nm波长处检测吸光度值。以不加外泌体处理的细胞为对照(CK)。
1.7 实时荧光定量PCR
将MECs接种于6孔板中(6×105个/孔),加入外泌体(1 μg/mL)处理24 h 后,用PBS 洗涤3 次,采用Trizol 法提取细胞总RNA;取1 μg mRNA,采用PrimeScript cDNA合成试剂盒(TaKaRa公司,日本)逆转录合成cDNA,操作方法按说明书进行。根据GenBank上发表的牛血清白细胞介素8(interleukin-8,IL-8)、白细胞介素1β(interleukin-1β,IL-1β)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)基因序列,采用Primer Blast 在线软件(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计跨内含子PCR 引物(表1)。实时荧光定量PCR(quantitative real-time PCR,qPCR)反应总体系为20 μL:上下游引物各0.6 μL、SYBR qPCR 混合物10 μL、cDNA 2 μL、ddH2O 6.8 μL。qPCR反应程序为:95 ℃预变性60 s;95 ℃变性15 s,60 ℃退火60 s,40 个循环。以参考基因RPL19和PGK1的CT值的几何平均值为参照,采用2-△△CT法计算目的基因的相对表达量。
1.8 统计处理
数据用“平均值±标准误”表示,采用SPSS 22.0软件中的单因素方差分析(analysis of variance,ANOVA)进行组间差异显著性检验,并采用最小显著性差数法(least significant difference, LSD)进行事后检验,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 差异表达基因
与正常培养的MECs 相比,乳腺炎病原刺激共引起1 478条基因的表达发生显著改变,其中933条表达上调,545条表达下调(图1)。

表1 qPCR引物信息Table 1 Primer information for qPCR analysis
2.2 差异表达基因的GO 分类富集
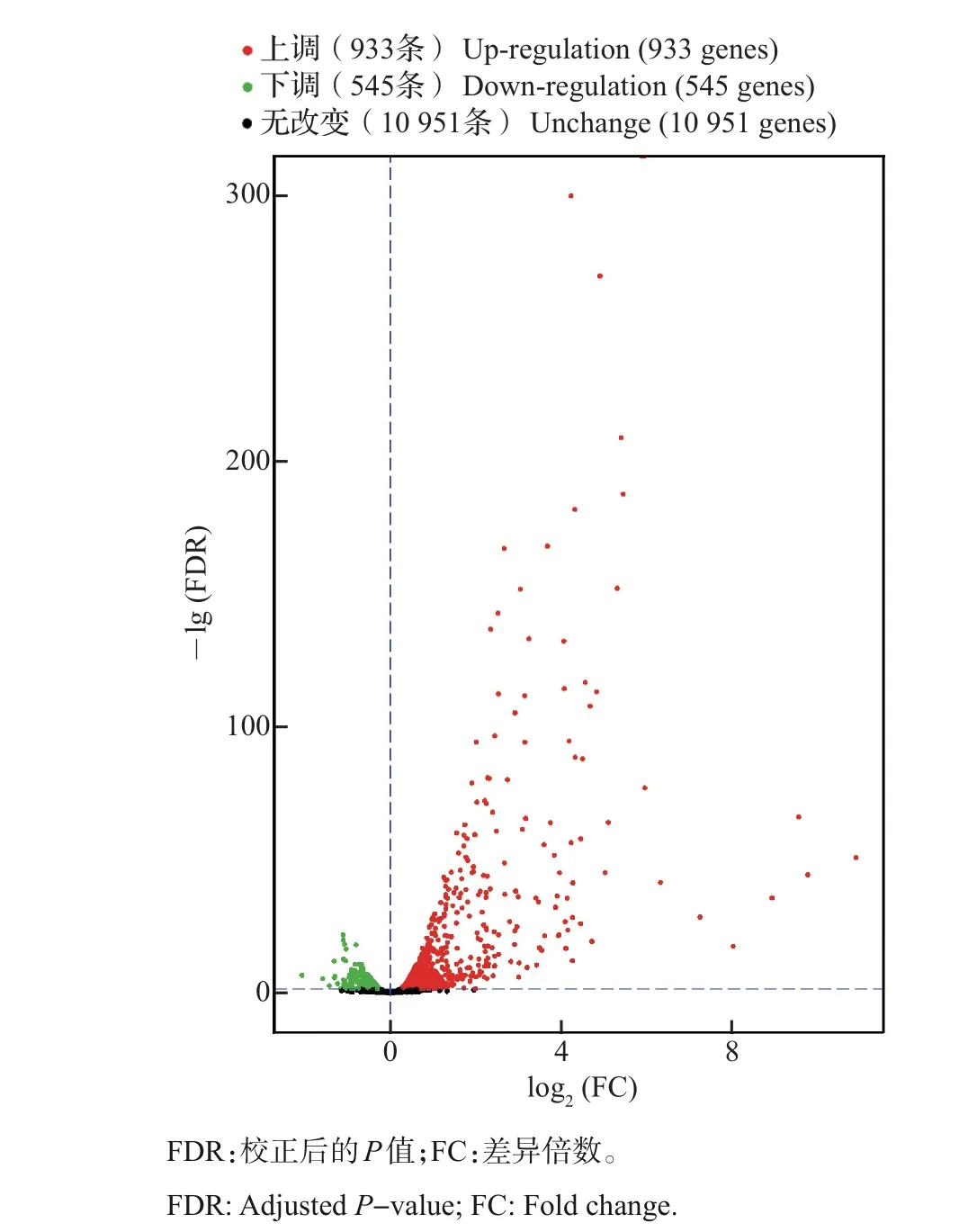
图1 大肠埃希菌刺激细胞和对照细胞之间的差异表达基因火山图Fig.1 Volcano plot of the differential expression genes between E.coli-stimulated cells and normal cells
对差异表达基因进行GO 分类富集统计,同时根据P值对生物过程(biological process)、分子功能(molecular function)和细胞组分(cellular component)的分类富集结果进行排序,筛选前10个最显著富集的GO。如图2 所示:在生物过程方面,E.coli刺激显著影响蛋白酶结合和锌离子结合;在分子功能方面,E.coli刺激引起的差异表达基因主要参与对血管形成、病毒基因组复制、T 细胞介导的细胞毒性、免疫反应和NF-κB转录因子活性的调控;在细胞组分方面,E.coli刺激引起的差异表达基因显著富集于细胞外囊泡外泌体、细胞外间隙和细胞质,其中定位于细胞外囊泡外泌体的差异表达基因共有21条(表2)。
2.3 牛奶外泌体的表征结果
从牛奶中分离得到的外泌体呈圆形或椭圆形,具有完整的膜结构,直径为50~100 nm;正常牛奶外泌体(N-exo)和乳腺炎牛奶外泌体(M-exo)在形态上无明显差别,但N-exo 具有较深的蛋白质背景,可能与正常牛奶蛋白质含量较高有关(图3A)。N-exo 和M-exo 均表达外泌体标志蛋白TSG101,并富含膜联蛋白A2(图3B)。
2.4 牛奶外泌体对MECs 活力的影响
如图4 所示,N-exo 处理组细胞活力与对照组细胞相比无显著差异,但M-exo处理组细胞活力较对照组细胞显著下降(P<0.001)。
2.5 外泌体对MECs 表达炎症介质的影响
N-exo处理组细胞IL-1βmRNA表达水平较对照组显著升高(P<0.01);M-exo组细胞IL-1βmRNA的表达水平与对照组相比无显著影响(P>0.05),但较N-exo 组细胞显著降低(P<0.01)(图5A);与对照组相比,N-exo和M-exo对IL-8mRNA的表达均无显著影响(P>0.05)(图5B)。然而,在对照组、Nexo 和M-exo 处理组细胞中均未检测到TNF-αmRNA的表达。
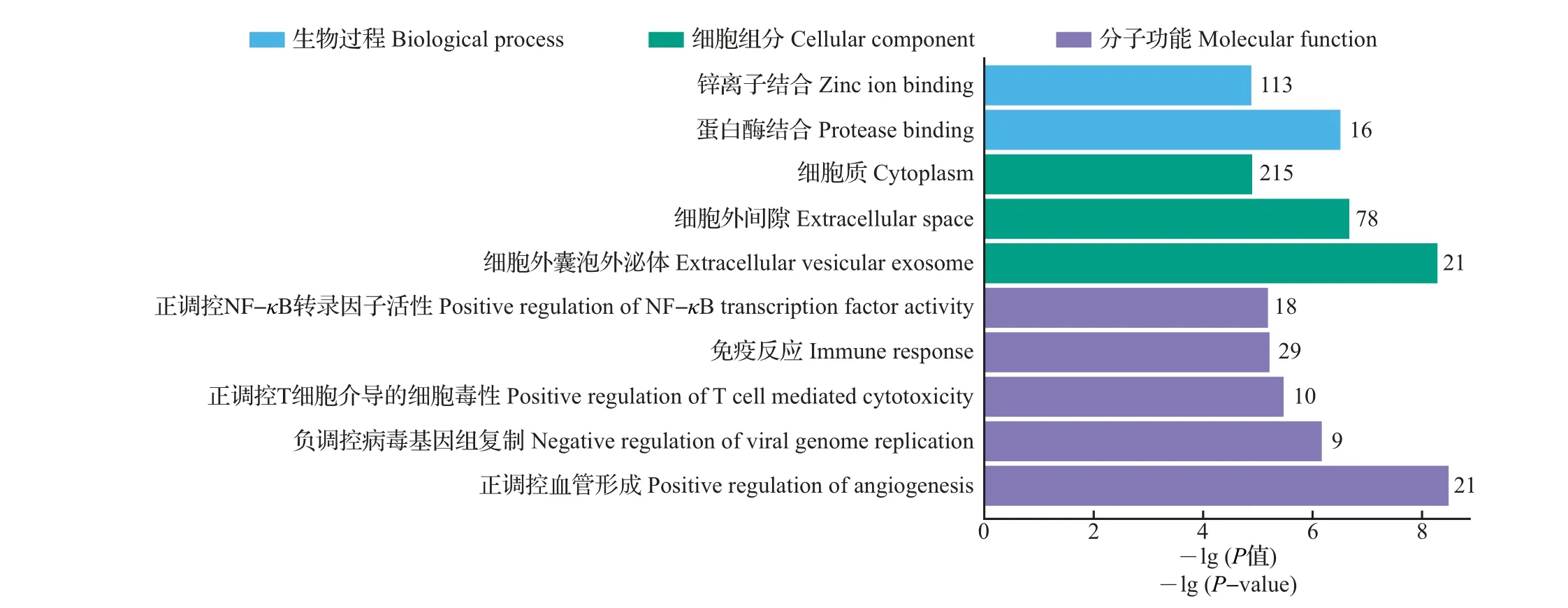
图2 差异表达基因中最显著富集的GO条目Fig.2 Most enriched gene ontology(GO)terms of differential expression genes
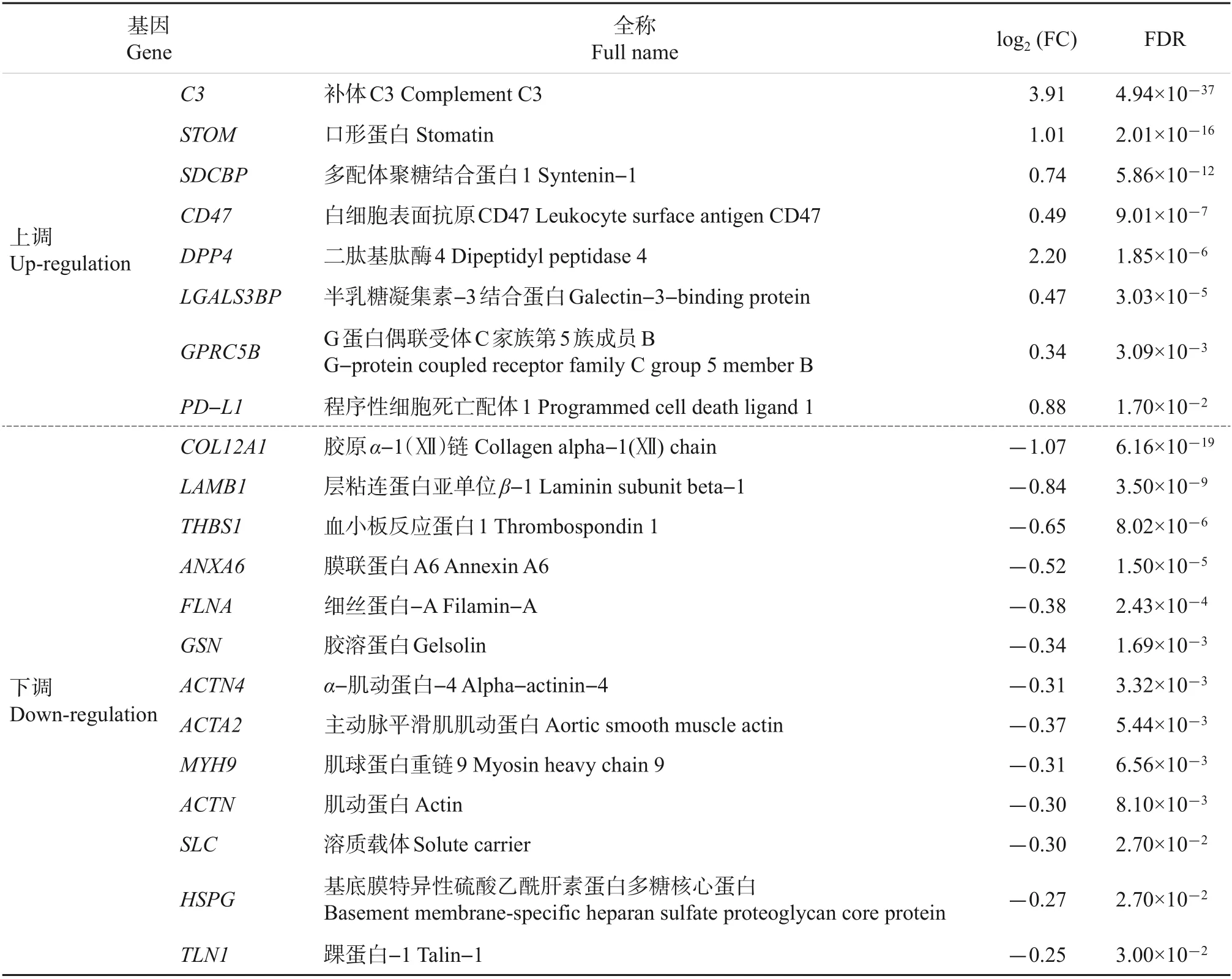
表2 富集于细胞的组分“细胞外囊泡外泌体”(GO:0070062)的差异表达基因Table 2 Differential expression genes enriched in the cellular component“extracellular vesicular exosome”(GO:0070062)
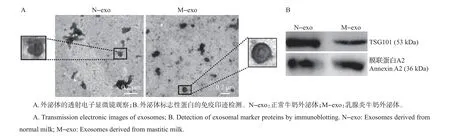
图3 外泌体表征Fig.3 Characterization of milk-derived exosomes
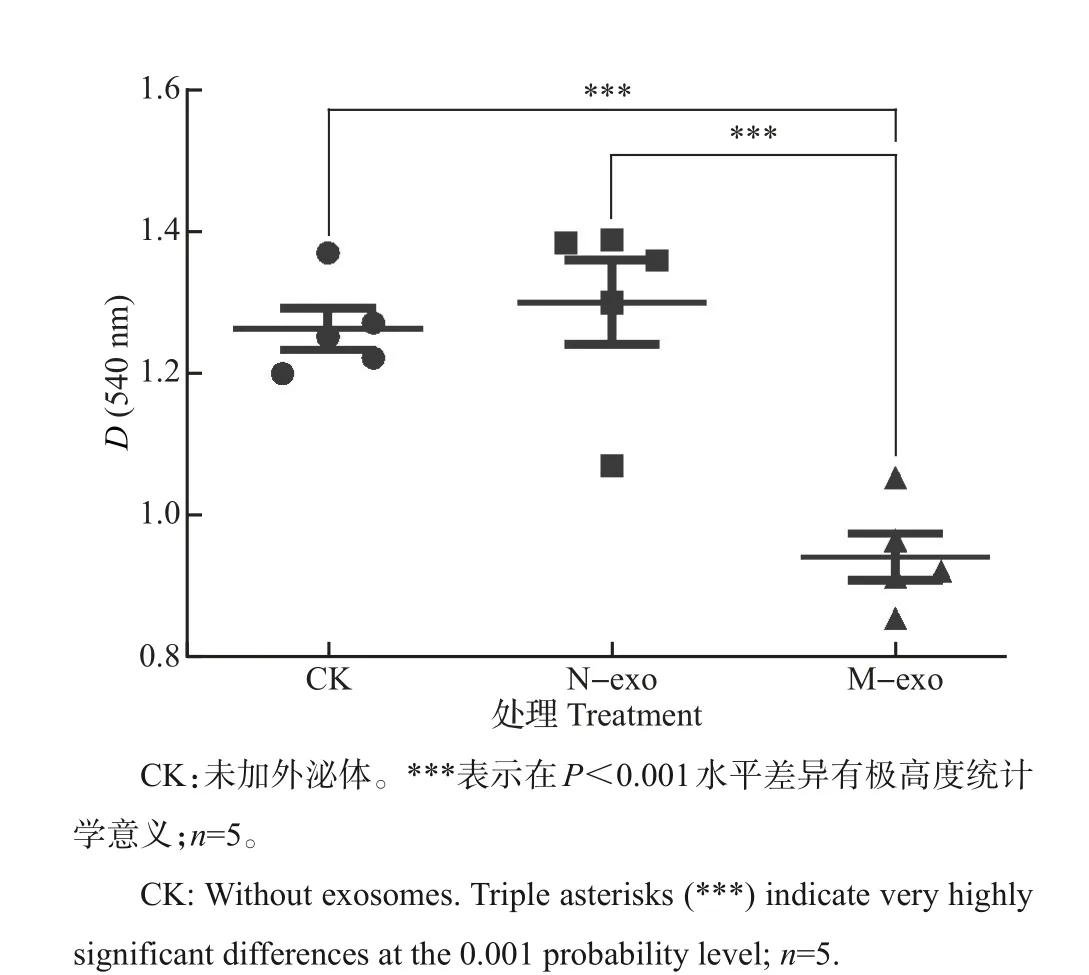
图4 正常牛奶外泌体(N-exo)和乳腺炎牛奶外泌体(Mexo)对奶牛乳腺上皮细胞活力的影响Fig.4 Effect of exosomes derived from normal milk(N-exo)and mastitic milk (M-exo) on the viability of bovine mammary epithelial cells
3 讨论
感染性疾病是病原微生物与宿主复杂互作的结果。病原微生物可采取多种策略以逃避或抑制宿主的免疫反应[11],从而得以在宿主内存活和复制,最终导致疾病发生。近年来的研究发现,在感染过程中,病原微生物和被感染的宿主细胞均可产生外泌体,这些外泌体可抑制宿主的免疫反应,是病原逃避免疫并建立急、慢性感染的重要机制[12]。但外泌体是否在奶牛乳腺炎发病机制中发挥作用尚未见报道。

图5 牛奶外泌体(N-exo 和M-exo)对奶牛乳腺上皮细胞IL-1β(A)和IL-8(B)表达的影响Fig.5 Effect of exosomes derived from normal milk(N-exo)and mastitic milk (M-exo) on the expression of IL-1β(A)and IL-8(B)in bovine mammary epithelial cells
热灭活病原刺激的MECs模型被广泛用于乳腺炎发病机制的研究[13-14]。本研究发现,在热灭活大肠埃希菌刺激下,MECs中有1 478条基因发生差异表达。GO 分类富集分析结果发现,上述差异表达基因中有21条定位于外泌体,表明乳腺炎病原感染可引起宿主细胞所分泌的外泌体成分发生改变。REINHARDT等[15]也证实乳腺感染可引起牛奶外泌体蛋白组分发生改变,支持本研究结果。除含有编码膜蛋白(SDCBP、CD47、DPP4)、膜结合蛋白(ANXA6)、膜受体(GPRC5B)、胶原蛋白(COL12A1)、细胞骨架蛋白(ACTN4、ACTA2)、细胞骨架蛋白结合蛋白(FLNA、GSN)、细胞外基质(LAMB1、THBS1)和肌动蛋白微丝(MYH9)的基因外,定位于外泌体的基因中还包含具有免疫抑制作用的PD-L1[16]和LGALS3BP[17]。这一结果提示,乳腺炎病原感染可引起外泌体免疫机能改变。
在上述研究结果的基础上,本试验对比了正常牛奶和乳腺炎牛奶来源的外泌体对体外培养的MECs活力和免疫机能的影响。为避免非牛奶来源的外泌体对试验结果的干扰,本试验所使用的细胞培养基和小牛血清均进行了去外泌体处理。结果发现,正常牛奶外泌体可诱导MECs 表达促炎介质IL-1β。这说明在正常生理情况下,牛奶外泌体具有调节乳腺免疫的功能。ADMYRE等[18]发现,人乳中的外泌体也具有免疫调节作用,支持本研究结果。与正常牛奶外泌体不同,乳腺炎牛奶外泌体可显著降低MECs活力,并失去刺激MECs表达IL-1β的能力。上述结果提示,在乳腺感染过程中,进入到牛奶中的外泌体可引起MECs 活力下降,并可能通过改变乳腺内免疫微环境而为病原逃避免疫创造有利条件。除IL-1β外,MECs还可表达促炎介质TNF-α和IL-8[19]。但本研究发现,正常牛奶外泌体和乳腺炎牛奶外泌体对IL-8和TNF-α的表达均无显著影响,其机制尚待进一步研究。
需要指出的是,本研究用于构建细胞感染模型的病原菌与从乳腺炎牛奶中分离到的病原菌不同,因而,在感染细胞模型上观察到的定位于外泌体的差异表达基因可能与乳腺炎牛奶外泌体中发挥生物学效应的基因不同。此外,虽然牛奶外泌体主要来自MECs,但病原微生物[20-21]也可形成外泌体,因而,在本研究中观察到的乳腺炎牛奶外泌体的生物学效应可能是宿主和病原微生物产生的外泌体的共同效应。
4 结论
本研究结果表明:乳腺感染可引起牛奶外泌体生物学功能发生明显改变,这类外泌体可降低MECs 活力,并可能参与介导有利于病原逃避免疫的微环境的形成,从而为病原逃避免疫创造有利条件。因而,在乳腺感染过程中,外泌体可能起着促进乳腺感染扩散的作用。观察阻断外泌体分泌对乳腺炎病理过程的影响将是下一步工作的重点。
