纵隔原发性粒细胞肉瘤二例
2020-07-24陈小丽李莎莎
杨 鹏 陈小丽 冯 娜 李莎莎 张 曦 杜 欣
粒细胞肉瘤(granulocytic sarcoma, GS)也称髓系肉瘤(myeloid sarcoma, MS),是一种由未成熟髓系细胞在髓外增生和浸润而形成的实体恶性肿瘤。GS包括白血病性(白血病髓外浸润)和非白血病性(原发性或孤立性)[1]。几乎可以发生于全身的各个部位,常累及骨骼、软组织、淋巴结、皮肤、胃肠道及睾丸[2]。GS单独发生时,其骨髓无白血病表现,称为原发性粒细胞肉瘤(primary granulocytic sarcoma, PGS),原发性粒细胞肉瘤发病率极低,发生于纵隔的粒细胞肉瘤更为罕见,国内外文献仅有少量个案报道[3]。本文报道我院确诊的2例纵隔原发性粒细胞肉瘤,以提高对本病的认识,避免误诊误治。
病例资料
病例1:男,29岁,咳嗽、咳痰1个月余,咳血10余天,咳较多白色泡沫痰及少量鲜红色血液,伴阵发性右侧胸痛。查体:浅表淋巴结未触及肿大,全身未见明显出血点。既往史、家族史无传染病及遗传病史,无特殊疾病史。入院血常规未见异常。胸部CT平扫加增强:右肺门及右中、后纵隔区软组织团块影,密度不均、CT值约40 HU,与邻近组织结构分界不清,范围约为8.1 cm×8.6 cm,增强扫描呈轻-中度不均匀强化,肿块包绕右侧肺动、静脉,右侧支气管受压变窄,右肺多发斑片状密度增高影。纵隔淋巴结增大,大小约1.5 cm×2.2 cm。考虑右肺门及右中后纵隔区占位伴右肺阻塞性炎症,恶性病变可能并纵隔受侵,见图1。心脏彩超提示左房顶部一实质样肿块影像,范围约7.0 cm×6.7 cm,形态欠规则,边界模糊,与左房壁分界不清,活动度较小,肺静脉可见受压;考虑左房顶部实性占位(与左房壁分界不清)。入院诊断右肺门、纵隔区占位,原发性支气管肺癌?淋巴瘤?入院后行纤维支气管镜检查:右主支气管全段及以下各段支气管均见大小不等结节状新生物附着,管腔扭曲狭窄,远端结构无法分辨,活检易出血,考虑气管-支气管新生物(Ca?)。纤支镜钳取物病理活检提示小细胞恶性肿瘤,考虑粒细胞肉瘤[1]。免疫组化-(1)CD20-,(2)CD3-,(3)Alkp80-,(4)CK-,(5)Ki-67约90%+,(6)CD79a-,(7)CD30-,(8)CD138-[9],免疫组化-(10)SALL-4-,(12)SYN-,(13)CgA-,(14)CD56+[1],免疫组化-(1)35BH11-,(2)TTF-1-。补:[1]免疫组化-(1)TDT散在+,(2)CD7散在+,(3)CD99弥漫+,(4)Vimentin-,(5)CD34弱+,(6)CD10弱+,(7)Desmin-,补[1]免疫组化-(1)MPO+,(2)CD43+,(3)CD68(PGM1)-,(4)CD68(KP1)+,见图2。血液科会诊后行骨髓穿刺,骨髓象检查未见明显异常。临床确诊为纵隔原发性粒细胞肉瘤,建议转血液科治疗,患者因自身原因放弃治疗、回家休养,随访于病程第4个月死亡。

图1 纵隔原发性粒细胞肉瘤胸部CT图;注:A:纵隔窗横断位;B:纵隔窗冠状位
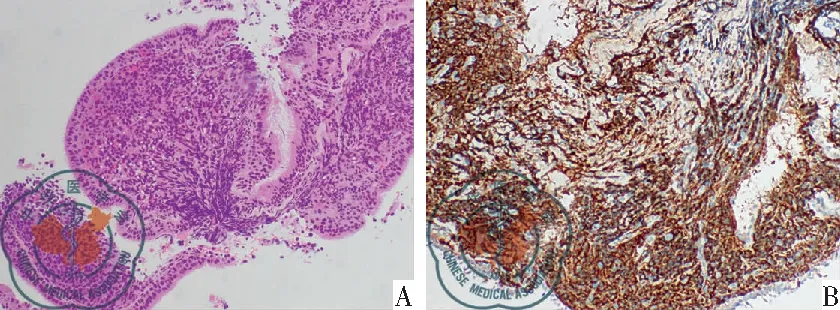
图2 纵隔原发性粒细胞肉瘤病理图像;注:A:常规病理(HE×100);B:免疫组化 MPO(+)(×100)
病例2:女,44岁,颈部肿胀不适20 d,颈部肿胀增粗逐渐加重、声音嘶哑,查体:颈部增粗、压之无明显凹陷,浅表淋巴结未触及肿大,全身未见明显出血点。既往史、家族史无传染病及遗传病史,无特殊疾病史。入院血常规未见异常。胸部CT平扫加增强:前上纵隔一软组织肿块影、大小约4.7 cm×3.8 cm,CT值约55 HU,肿块内侧缘与主动脉弓分界不清,增强扫描肿块呈轻-中度不均匀强化,肿块包绕上腔静脉并管腔狭窄。考虑前上纵隔占位,胸腺瘤?见图3。纵隔彩超提示前上纵隔偏右侧一实质性肿块,范围约6.6 cm×3.7 cm,形态欠规则,部分边界可见,CDFI 可见短棒状血流信号,考虑前上纵隔实质性占位,性质待定。入院诊断前上纵隔占位,胸腺瘤?纵隔良性肿瘤?入院后行超声引导下前上纵隔包块穿刺活检术。穿刺病理活检提示内梭形细胞恶性肿瘤伴坏死,免疫组化支持淋巴造血系统肿瘤,考虑髓系肉瘤[1]。免疫组化-:(1)CK(-);(2)CD3小灶(+);(3)CD20小灶(++);(4)CD45(++);(5)CgA(-);(6)34βE12(-);(7)35βH11(-);(8)CK7(-);(9)Ki-67 60%(+);(10)SYN(-);(11)TTF-1(-);(12)Vimentin(+);(13)CD79a(-);(14)CD21(-);(15)CD45RO(-)补:[1]免疫组化-(1)CD1a(-);(2)CD4(-);(3)CD5小灶(+);(4)CD8(-);(5)CD99(++);(6)CK14(-);(7)CK19(-);(8)TdT(-);(9)MUM1(-);(10)MP0(+-++)补:CD43(+-++),CD15(-),Lysozyme(++),CD30(-),CD117(-),CD34(-),CD38(-),见图4。血液科会诊后行骨髓穿刺,骨髓象检查未见明显异常。临床确诊为纵隔原发性粒细胞肉瘤,并转血液科进一步治疗,第一疗程予以标准剂量TA(Thp:20 mg,d1-d3;Ara-C:200 mg,d1-d5)方案化疗,纵隔包块无明显缩小。第二疗程予以中大剂量TA(Thp:20 mg,d1-d3;Ara-C:1g,d1-d3)方案化疗,纵隔包块无明显缩小。第三疗程予以FLAG(Fli:50 mg,d1-d3;Ara-C:1g,d1-d3;G-CSF:150 μg,d0-d3)方案化疗。予以三个疗程化疗后,纵隔包块无明显缩小,治疗效果不佳。考虑难治性髓系肉瘤,化疗效果差,建议行纵隔包块放疗或异基因造血干细胞移植。予以纵隔放疗27次后,纵隔包块有所缩小,大小约1.9 cm×3.2 cm,出现腹部皮下及右侧乳腺多发结节,考虑疾病进展。行乳腺包块活检,(右乳腺肿物)淋巴造血系统肿瘤:倾向髓系肉瘤。免疫组化LCA+CD20-CD3-CD99+ MPO弱+ CD34-CD68+ CD68(PMG-1)-Ki-67约90%+ PAX-5-CD7弱+ TDT-。第四疗程予以IAE(IDA:10 mg,d1-d3;Ara-C:600 mg,d1-d3;VP-16:0.1 g,d1-d3)方案化疗。乳腺及皮下肿块有所缩小。随访于病程第11个月死亡。
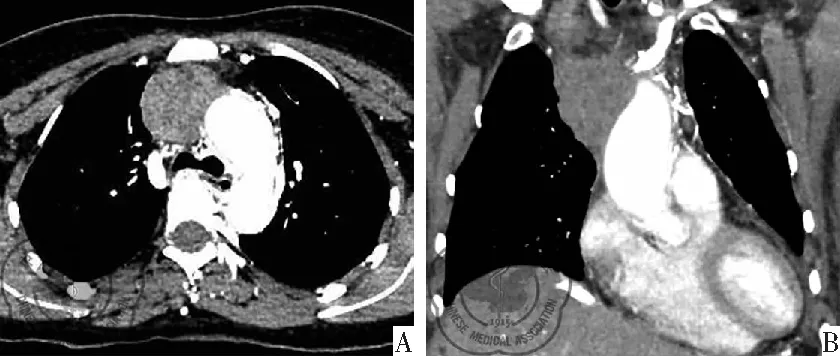
图3 纵隔原发性粒细胞肉瘤胸部CT图;注:A:纵隔窗横断位;B:纵隔窗冠状位
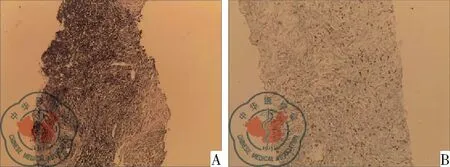
图4 纵隔原发性粒细胞肉瘤病理图像;注:A:常规病理(HE×200);B:免疫组化 Lysozyme(++)(×100)
讨 论
GS是未成熟的粒细胞髓外肿瘤,WHO将其定义为发生在骨髓外任何解剖部位的包块。根据是否伴发急性髓系白血病(acute myelocytic leukemia, AML),GS可分为孤立性GS和白血病髓外浸润GS。孤立性GS的发病率为2/100万[4],可发生于任何年龄,无明显性别差异。孤立性GS指先于AML发生,30 d内骨髓检查无异常,常进展为白血病。白血病髓外浸润性GS是指同时与AML发生或继发出现,当出现在慢性粒细胞白血病中时,也可作为疾病进展为AML的先兆[5]。
GS的临床表现主要与肿瘤的生长部位有关。表现为局部疼痛、肿胀或肿块,病情发展较为迅速。白血病性GS中大多数继发于AML,孤立性GS多因偶然间发现肿块或局部疼痛而就诊,实验室检查及骨髓检查未发现白血病的证据[6]。纵隔原发性GS临床表现主要为局部肿块对周围结构的压迫和浸润,如咳嗽、胸痛、声音嘶哑及血液回流障碍等症状[7]。临床症状缺乏特异性,诊断主要依靠组织病理学检查,极易误诊,误诊率可高达47%[8]。
纵隔原发性GS的影像学表现主要有以下特点:(1)病程发展迅速,呈弥漫性、侵润性生长,肿块常较大、形态不规则、边界不清,容易侵犯、包绕胸部大血管及气管;(2)病灶CT上多呈等密度、与肌肉密度类似、CT值约40~50 HU,MRI上T1WI呈等或稍低信号、T2WI 呈高信号;(3)病灶内密度及信号不均匀,常出现坏死灶,钙化少见,增强扫描呈不均匀强化,病灶周边区域强化程度较中心更明显[9-10]。在影像学上纵隔原发性GS 需与纵隔型肺癌、淋巴瘤、胸腺瘤相鉴别,纵隔原发性GS 极易误诊为恶性淋巴瘤[11]。总之,纵隔原发性GS影像学表现多样、缺乏特征性,CT及MRI 能够提供一定的诊断价值,但不能作为诊断的特异性标志,最终诊断需全面了解患者的病史、骨髓检查等,在病理形态学的基础上结合免疫组织化学而确诊[12]。
光镜下GS肿瘤细胞呈片状弥漫分布,形态单一、大小较一致,细胞中等或偏大,核不规则、细胞质少、淡染,部分细胞核呈空泡状或肾形,核仁明显,病理性核分裂象常见。在病变显示粒细胞分化的情况下,发现嗜酸性粒细胞的存在对于诊断GS有较大作用[13]。部分肿瘤细胞之间有纤细的纤维性组织穿插也是其特点之一。GS肿瘤细胞大多分化较幼稚,细胞背景较混杂,单纯依靠组织学形态诊断GS困难较大。随着免疫组化技术发展,对于GS的诊断准确率大大提高,误诊率已由初期75%降至25%[14]。常见阳性抗原包括MPO,lysozyme,CD43,CD68,CD117,CD99,CD34,CD31等,以MPO灵敏度和特异性最好,被认为是识别GS最有帮助的标记物[15]。李吉满等[16]研究显示:GS免疫组织化学MPO、溶菌酶、CD68、CD43 的阳性率分别为95.9%、95.5%、95.2% 和 85.7%。溶菌酶是一种主要存在于粒系细胞胞质的酶,是髓细胞最敏感的标志物[17]。但不表达于淋巴系肿瘤,可作为GS与淋巴瘤的鉴别诊断;CD68表达于单核巨噬细胞,其敏感度低于 MPO;CD43 几乎在所有的髓系细胞肉瘤中表达,但特异性不高,因此不能作为 GS 的诊断依据,若肿瘤细胞表达CD43,但不表达其他T或B细胞标志物时,应加做MPO,lysozyme等髓系标志,排除GS。
目前GS的细胞遗传学及分子检测报道较少,仅有少量个案报道和小量样本回顾性分析。Kaur等[18]研究显示,63%的GS伴有细胞遗传学异常。NPM1突变是MS中报道的最常见的突变,最常见的易位是t(8;21)(q22;q22),inv(16(p13;q22)易位也与AML中的髓外疾病有关,尤其是在腹部位置[19-22]。未来细胞遗传学及分子检测在GS诊断中的作用将变得越来越重要。
GS预后差,两年总生存率仅为6%。目前针对原发性GS的治疗尚缺乏统一、规范性的策略和指南,现有的治疗措施主要包括全身联合化疗、手术切除、放射治疗、造血干细胞移植、生物靶向治疗等。GS患者早期诊断并按AML方案接受化疗,可明显降低GS向AML的转化率,提高患者生存期。研究表明,采用AML的化学药物治疗策略、造血干细胞移植治疗GS可显著提高患者总体生存率,延长生存时间[23]。接受造血干细胞移植的GS患者,5年总体生存率和无白血病生存率分别为48%和36%。因此推荐所有孤立性GS患者一旦明确诊断均应接受联合化疗,当前仍以AML诱导缓解化疗方案使用最多[24]。同时有条件的患者行造血干细胞移植治疗。
放射疗法对于GS的治疗价值仍存有争议,局部放疗对大部分患者有效,但并非对所有患者可行,本组病例2患者行27次放疗,纵隔包块有所缩小,但出现腹部皮下及右侧乳腺多发结节,未能有效控制疾病进展。手术治疗可以切除肿块,快速缓解临床症状,且能进行病理活检,有助于明确诊断。由此可见单纯放疗或手术治疗均不是原发性GS的最佳治疗策略,但可以将放疗及手术作为联合治疗的一部分,用于快速缓解临床症状或用于巩固治疗。近年已有多种新型靶向药物应用于GS患者治疗的临床研究,如 FLT3-ITD 抑制剂、法尼基转移酶抑制剂、单克隆抗体、伊马替尼等[25-26]。期望这类药物能有效改善GS患者的预后,让靶向治疗成为GS治疗的新选择。
综上所述,纵隔原发性粒细胞肉瘤发病率低,临床表现多样化,影像表现缺乏特异性,误诊率高,预后差。临床工作中应充分结合患者病史、影像学表现、肿块及骨髓病理检查、细胞遗传学及分子检测等检查,快速、精准的诊断。诊断明确后,尽早实施个体化综合治疗,可延缓进展及复发,改善患者的预后,提高长期生存率。目前关于GS的治疗尚缺乏大型前瞻性试验, 仍需进一步研究。
