黔北麻羊TIMP1 基因编码区的克隆、表达及生物信息学分析
2020-07-24周志楠倪萌萌
洪 磊 ,敖 叶,周志楠,唐 文,阮 涌,倪萌萌,陈 祥*
(1.贵州大学高原山地动物遗传育种与繁殖教育部重点试验室,贵州省动物遗传育种与繁殖重点试验室,贵州贵阳 550025;2.贵州大学动物科学学院,贵州贵阳 550025)
基质金属蛋白酶抑制剂(TIMPs)是一种内源性的金属蛋白酶活性抑制剂[1],最初被认为主要作用于调节基质金属蛋白酶活性和抑制细胞外基质的转化,包括调节细胞增殖、分化、凋亡等,如血管生成[2],并且在细胞外基质的稳态中发挥关键作用[3]。哺乳动物的TIMP家族中有4 个成员,在大多数的细胞、组织、体液中表达[4]。TIMP1基因是在20 世纪70 年代初以胶原酶抑制剂的形式在体外培养的人皮肤成纤维细胞[5]、人血清[6]以及牛软骨和主动脉提取物中发现的[7]。有研究发现,TIMP1基因参与调控小鼠的生殖周期,主要作用于子宫和卵巢[8]。更为重要的是,TIMP1基因也被认为是类固醇生成的调节剂[9]。在绵羊上的研究发现TIMP1基因在子宫中的表达受激素影响,如雌二醇[10]。而在山羊上,Peng 等[11]研究发现TIMP1基因可以增加山羊输卵管上皮细胞的增殖,表明TIMP1基因在促进输卵管上皮细胞的存活中发挥重要作用。因此,TIMP1基因的功能除作为基质金属蛋白酶抑制剂之外,其对动物繁殖的重要作用也逐渐受到人们关注。
黔北麻羊是贵州三大地方优良山羊品种之一,具有遗传性能稳定、耐粗饲、抗病力强、合群性好、性情温顺、适应性强等特点[12],具有较高的经济价值。目前,与黔北麻羊产羔性状相关的分子水平基础研究较为缺乏。因此,本研究在同课题组对产单、多羔黔北麻羊的卵巢组织进行mRNA 转录组分析的基础上,筛选出差异性较高的TIMP1基因,对黔北麻羊的TIMP1基因编码区进行克隆,分析其分子结构序列,探究其在单、多羔黔北麻羊多组织中的表达差异,以期为探究黔北麻羊产羔性状分子机制及提高产羔性能研究提供基础数据。
1 材料与方法
1.1 材料
1.1.1 实验动物及样品采集 实验动物来自贵州省习水县富兴牧业有限公司,根据养殖场的系谱和繁殖记录,选择3 岁2 胎次的单、多羔黔北麻羊母羊各3 只(单羔组:连续2 胎产羔数为1 只;多羔组:连续2 胎产羔数为2只以上),采用同期发情处理后,在第二个情期母羊自然发情,4~5 h 后参照贵州省地方标准《羊屠宰操作规程》(DB22/T 2740-2017)进行屠宰,分别采集输卵管、垂体、下丘脑、卵巢、子宫5 个组织,置于液氮中保存,以用于组织总RNA 提取。
1.1.2 试剂与仪器 Trizol 试剂购自贵州绿盟英创生物科技有限公司;AMP、TOP10 感受态细胞购自北京全式金生物技术有限公司;高纯度质粒小提试剂盒等购自北京康为世纪生物科技有限公司;快速琼脂糖凝胶回收试剂盒、T-克隆PCR 产物克隆试剂盒购自生工生物工程技术有限公司(上海);荧光染料UltraSYBR Mixture SYBR Green I、逆转录试剂盒,均购自擎科生物科技有限公司。PCR 扩增仪(型号为C1000 Touch™)、实时荧光定量PCR 仪(型号为CFX96 Real-Time System)、凝胶成像系统(型号为Universal Hood Ⅱ),均购自美国BIO-RAD 有限公司。
1.2 方法
1.2.1TIMP1基因引物设计与合成 根据NCBI 上的山羊TIMP1基因mRNA 序列,利用Primer 5.0 软件设计mRNA 及CDS 区引物。为保证所设计引物的高特异性,并用NCBI 上的在线引物设计及分析软件Primer BLAST 进行分析,以β-actin为内参基因,送至生工生物工程技术有限公司(上海)合成,TIMP1、β-actin基因引物序列信息见表1。
1.2.2 黔北麻羊组织总RNA 提取及cDNA 第一链的合成采用Trizol 法提取单、多羔黔北麻羊的输卵管、垂体、下丘脑、卵巢、子宫5 个组织的总RNA,并吸取1 µL测定总RNA 的浓度和纯度,OD260/OD280在1.8~2.0,-80℃保存。将合格的RNA 按照Hi Fi Script cDNA 第一链合成试剂盒(北京康为有限公司)操作步骤反转录为cDNA,并进行浓度和纯度检测,OD260/OD280范围在1.7~1.9,-20℃保存。
1.2.3 目的片段的合成及回收 以cDNA 为模板,进行TIMP1基因CDS 区克隆,PCR 反应体系(20 µL):2×Es Taq Master Mix 10.0 µL,上、下游引物(10 μmol/μL)各 1.0 µL,RNase-Free Water 5.5 µL,cDNA模板2.5 µL(1 500 ng/μL)。PCR 反应程序:95℃预变性3 min;95℃变性30 s,55.6℃退火45 s,72℃延伸30 s,35 个循环;72℃终延伸5 min。将扩增产物用1%琼脂糖凝胶电泳检测。按照胶回收试剂盒回收目的片段,取1 μL 反应产物于超微量紫外分光光度计进行浓度和纯度检测。
1.2.4TIMP1基因的连接、转化及菌夜验证 按照pMD-19T 载体连接试剂盒的操作步骤,将胶回收产物与pMD-19T 载体在16℃恒温下连接过夜。将连接液加入到E.coliTOP10 感受态细胞中,冰上静置30 min,再42℃热激90 s,冰上静置20 min 后,加入700 µL 不含抗生素的液体培养基,37℃培养箱震荡培养1 h,涂布于含有氨苄青霉素的LB 固体培养基,将平板正向放置37℃培养1 h,然后倒置培养过夜。观察平板上菌落的生长情况,随机挑取10 个白色单克隆菌落接种于LB液体培养基中(含有氨苄青霉素),37℃、200 r/min振荡培养12 h,进行菌液PCR 鉴定。PCR 反应体系及条件见1.2.3。PCR 产物用1%的琼脂糖凝胶电泳进行检测。挑选与目的条带一致的菌夜送至生工生物工程技术有限公司(上海)进行测序。
1.2.5TIMP1基因在黔北麻羊不同组织表达水平检测以cDNA 为模板,采用实时荧光定量PCR 检测TIMP1基因在单、多羔黔北麻羊输卵管、垂体、下丘脑、卵巢、子宫5 个组织中的表达水平。反应体系10 μL:2×T5 Fast qPCR Mix 5 μL;上、下游引物(10 μmol/L)各0.75 μL;cDNA(1 500 ng/μL)1.5 μL;ddH2O 2 μL。程序如下:95℃预变性1 min;95℃变性10 s;58℃退火10 s;68℃延伸28 s;进行40 个循环;最后从60℃按0.5℃增值到95℃进行溶解曲线分析,荧光采集时间为5 s,每个样品进行3 个平行试验。获得扩增曲线呈光滑的“S”型曲线,可用于2-△△Ct方法的计算,溶解曲线全部呈单峰,峰值较好,即引物特异性好。
临离开美食街,忽然看见藕稀饭,明明吃饱了,还是条件反射买了一碗。回妹妹同学家吃起来,藕块,略硬,颇挂喉。要等到秋风起了,寒霜降了,江南的藕才可口,煮出铁锈红色,软糯芬芳,糯米粥煮得发亮,上面飘着厚厚一层粥油。寒冬的时候,坐在街头,喝一碗,可暖一下午,也暖了一辈子。
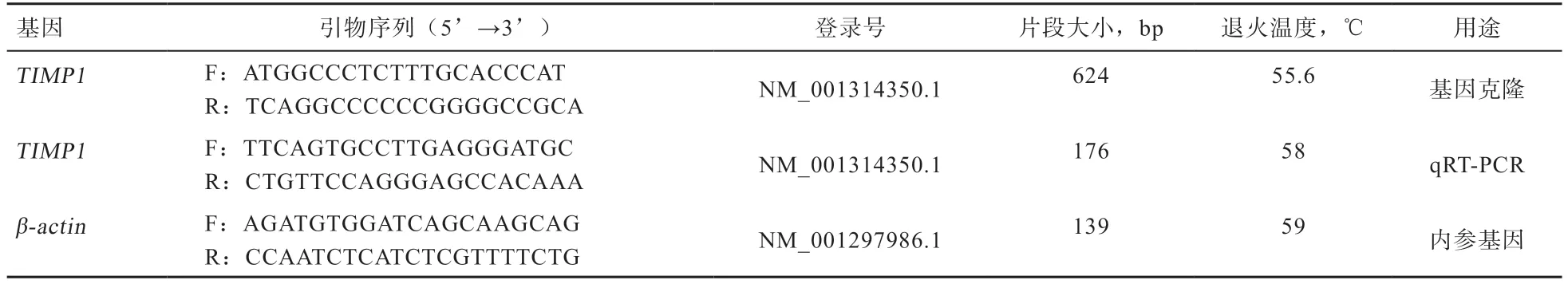
表1 引物序列
1.2.6 数据处理及统计分析 本次实验TIMP1基因和β-actin基因的Ct 值数据采用2-△△Ct法分析,得出TIMP1基因在单、多羔黔北麻羊的输卵管、垂体、下丘脑、卵巢、子宫5 个组织中的相对表达量,实验数据用SPSS 22.0 软件进行单因素方差分析,使用LSD 法进行差异显著性检验。
1.2.7 黔北麻羊TIMP1基因生物信息学分析及生物进化树构建 利用在线软件ProtParam(http://us.expasy.org/tools/protparam.html/)预测TIMP1蛋白质理化性质,使用ProtScale(http:www.expasy.org/cgi-bin/protscale.pl/)分析疏水性,使用在线软件TMHMM Server.2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析预测跨膜区域,使用在线软件SignalP(http://www.cbs.dtu.dk/services/SignalP/)、在线软件SMART(http://smart.embl-heidelberg.de/)预测分析信号肽TIMP1蛋白结构功能域,使用在线软件SOPMA 对TIMP1蛋白的二级结构进行分析预测,用在线软件SWISS-MODEL(https://swissmodel.expasy.org/interactive/EHVM5c/models/)分析蛋白质三级结构,下载并整理NCBI 上的绵羊、牛、骆驼、马、人、猪、犬等10 个物种的mRNA 序列信息,利用BioEdit 软件进行多重比对分析,然后用MEGA6 软件进行遗传距离计算和系统进化树的构建(邻接法),且Bootstrap Replication 值为1 000。
2 结果与分析
2.1 黔北麻羊TIMP1基因的扩增 利用反转录后的cDNA为模板扩增TIMP1基因的CDS 区,PCR 结果如图1 所示,片段长度大小与预期片段大小624 bp 一致,可以初步判断扩增片段为黔北麻羊TIMP1基因的CDS 区。
2.2 黔北麻羊TIMP1基因克隆及测序 如图2 所示,黔北麻羊TIMP1基因与NCBI 上的山羊序列同源性达到100%,说明已经成功构建了基因的T 克隆载体。
2.3 黔北麻羊TIMP1 蛋白序列分析
2.3.1 蛋白质理化性质分析 TIMP1 蛋白的分子式为C1020H1581N283O291S19,相对分子质量为23.073 64 ku,等电点为8.62,酸碱性质呈碱性。不稳定系数为64.5,因此TIMP1 蛋白属于碱性不稳定蛋白。氨基酸组成中含量最高的是丙氨酸,占9.2%,并且TIMP1 蛋白中带正电荷的氨基酸残基量(精氨酸+赖氨酸)为20 个;带负电荷的氨基酸残基量(天冬氨酸+谷氨酸)为15 个;脂肪族系数为69.86。

表2 黔北麻羊TIMP1 蛋白氨基酸含量及所占比例
2.3.2 蛋白质疏水性分析 由图3 可知,TIMP1 蛋白第10~20 位氨基酸之间含有一个突出的疏水区域。整个多肽链中负值氨基酸多于正值氨基酸,即肽链中亲水性氨基酸多于疏水性氨基酸,表明整个多肽链表现为亲水性。
2.3.4 蛋白质信号肽预测 由图4 可知,TIMP1 蛋白含有信号肽序列,为分泌蛋白,序列为MALFAPMASGI LLLLWLTASRACTCI。推测TIMP1 蛋白可能在跨膜运输起着信号识别作用,剪切位点位于第23 位和第24 位氨基酸之间,成熟肽始于第24 位氨基酸。
2.3.5 蛋白质结构域及亚细胞定位分析 预测分析TIMP1 蛋白结构功能域,结果显示,TIMP1 蛋白在24~199 位是个高度保守的结构功能域,由NTR 结构组成。利用PSORT Ⅱ Prediction 在线软件预测TIMP1 蛋白亚细胞定位结果显示,细胞质为55.6 %,线粒体为44.4 %,TIMP1 蛋白主要存在于细胞质和线粒体中。
2.4 黔北麻羊TIMP1 蛋白的结构预测
2.4.1 蛋白质二级结构预测 对TIMP1 蛋白的二级结构进行预测分析,结果如图5 所示,TIMP1 蛋白中无规则卷曲所占的比例最大,高达50.72%,α-螺旋占22.71%,扩展链为22.71%,β-转角区域仅为3.86%。
2.4.2 蛋白质三级结构预测 对TIMP1基因蛋白质三级结构进行预测,结果与二级结构预测一致。
2.5 黔北麻羊TIMP1基因在不同组织的表达分析 由图6 可知,TIMP1基因在各被检测组织中均有表达。单羔组中表达量为子宫>卵巢>输卵管>垂体>下丘脑;多羔组中表达量为卵巢>子宫>输卵管>垂体>下丘脑,且输卵管、垂体和卵巢在多羔组表达中极显著高于单羔组,其他组织间差异不显著。
2.6 黔北麻羊TIMP1基因的遗传进化分析 与NCBI 上绵羊、牛、猪、骆驼、马、犬、人、兔、鼠9 个物种的基因序列进行比对,序列同源性分别为98.4 %、96.0 %、87.8 %、88.8 %、86.3 %、85.5 %、84.0 %、81.3 %、74.2 %,进一步构建遗传进化树结果如图7,发现黔北麻羊与绵羊和牛的遗传距离均最近,与猪的亲缘关系较近,与骆驼、马、犬、人、兔、鼠的遗传距离较远,符合物种进化规律。
3 讨 论
TIMP家族成员主要由发育中的卵巢和睾丸分泌[13],定位于特定的细胞和组织部位,研究表明,TIMPs 的生物学作用是与细胞表面蛋白相互作用,调节细胞内的下游信号通路[14]。而且TIMP 家族成员可能在性腺发育、卵泡生长和排卵过程中发挥作用[15]。因此,TIMPs 与多种生殖过程有关[16]。TIMP1是TIMPs 家族中的一个重要基因,被认为是与哺乳动物排卵过程相关的重要基因之一[17]。Boujrad 等[9]研究表明,TIMP1主要在卵泡中表达,能够促进细胞增殖、凋亡和激素合成。TIMP1基因还与卵巢的排卵和黄体形成有关[18],可作为山羊产羔性状的候选基因。然而,TIMP1在黔北麻羊组织中的表达和功能尚不清楚。
本研究通过T-克隆获得了黔北麻羊TIMP1基因编码区序列,并与NCBI 中收录的序列进行比对,序列同源性达100%,未发现突变位点,说明黔北麻羊TIMP1基因的CDS 区与山羊相同。对黔北麻羊TIMP1基因序列所翻译的蛋白质进行在线分析,发现TIMP1 蛋白的分子式为C1020H1581N283O291S19,编码207 个氨基酸;等电点为8.62;相对分子质量为23.07364 ku,这与Brew在人上预测[19]的结果存在差异,可能是因为存在种属差异。本实验发现黔北麻羊与绵羊和牛的遗传距离均最近,与猪的亲缘关系较近,与骆驼、马、犬、人、兔、鼠的遗传距离较远,符合物种进化规律,同时说明TIMP1基因在黔北麻羊中体现出了一定的遗传保守性。
An 等[20]研究发现,与产单羔山羊相比,产多羔山羊卵巢组织中TIMP1基因的mRNA 表达增加。本实验中,多羔组山羊TIMP1在卵巢组织的表达量极显著高于单羔组且在组内表达量最高,提示其与山羊的产羔性状可能有关。此外,朱广琴[21]同样发现TIMP1基因在多羔奶山羊卵巢组织中的表达极显著高于单羔奶山羊。由于卵巢组织在动物生殖过程中起着重要作用,它能分泌与生殖有关的性腺激素,从而影响发情、卵泡发育和排卵等[22-23],结合本实验结果进一步推测TIMP1基因在卵巢组织的高表达可能对山羊卵泡发育、排卵和卵母细胞活化等过程产生重要影响。本研究结果显示,TIMP1基因在多羔组垂体中表达极显著高于单羔组,而垂体是雌激素的重要调控器官,雌二醇可以显著下调MMP 家族基因表达[24],而TIMP1基因作为其家族基因的抑制剂,推测TIMP1基因在雌激素的分泌过程中间接发挥作用,从而参与调控黔北麻羊产羔性状。本研究发现TIMP1基因在多羔组输卵管组织的表达极显著高于单羔组,这与彭甲银[25]研究相同。更为重要的是TIMP1基因可以促进山羊输卵管上皮细胞的增殖[11],而输卵管又是传递生殖细胞和受精的场所[26],因此,TIMP1基因在输卵管的高表达表明其与动物繁殖过程紧密相关,具体调控作用有待进一步研究。结合本实验研究结果,可进一步推测TIMP1基因通过在垂体、卵巢和输卵管中高表达从而对黔北麻羊产羔数量产生积极影响。综合上述研究推测,TIMP1基因可能与黔北麻羊高产羔数有关。
4 结 论
本研究克隆获得黔北麻羊TIMP1基因CDS 区序列,发现TIMP1基因在单、多羔黔北麻羊5 个组织中的表达存在差异性。推测TIMP1基因可能通过在输卵管、垂体和卵巢的高表达影响黔北麻羊的产羔数量,具体的分子调控机制还有待进一步研究。
