可切除胰腺导管腺癌CT强化程度与病理的相关性
2020-07-23蔡小丽纪若云张显怡
蔡小丽,纪若云,张显怡,石 喻
(中国医科大学附属盛京医院放射科,辽宁 沈阳 110004)
胰腺癌中的80%~90%为胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC),恶性程度高,预后差,患者5年总体生存率仅约7%[1]。胰腺癌发病隐匿,确诊时多已属进展期或发生转移,可切除者仅占15%~20%[2-3]。根据美国国家综合癌症网(National Comprehensive Cancer Network, NCCN)标准[4],目前胰腺双期增强CT是术前诊断胰腺癌最常用的手段。既往研究[5]提出增强后胰腺实质期肿瘤与周围实质密度差异与胰腺癌恶性程度相关,但未分析其与预后的关系。本研究基于弹性配准后的胰腺CT图像,定量分析增强后PDAC与周围实质的CT值差及PDAC增强与平扫CT值差,观察各CT值差与PDAC病理级别的关系及其对评估预后的价值。
1 资料与方法
1.1 一般资料 回顾性收集2014年1月-2018年12月150例于盛京医院接受手术治疗的PDAC患者,男89例,女61例,年龄35~86岁,平均(59.3±9.3)岁;参照文献[6]胰腺癌分期标准,T1期31例, T2期73例,T3期46例。纳入标准:①术前接受64层以上标准胰腺双期增强CT检查;②术前未接受放射及化学治疗;③经术后病理证实为PDAC;④随访资料完整。排除标准:①术前CT资料不全;②CT图像层厚>2 mm或无法以2 mm层厚重建;③图像存在伪影等问题而无法分析。术后对患者进行随访,每3~6个月复查胰腺增强CT或胰腺MRI,并行血清生化检查,记录患者总生存时间,即手术日至死亡或末次随访的时间间隔。
1.2 仪器与方法 检查前患者禁食6~8 h。采用Tokyo Aquilion ONE 320排(640层)螺旋CT机行胰腺平扫及双期增强扫描,进床速度46.8 mm/r;管电流250 mA;转速0.75 s/r;探测器配置0.625 mm×0.625 mm;管电压120 kV;矩阵512×512。之后以2.5~3.0 ml/s流率经肘静脉注入非离子型对比剂(碘普罗胺,370 mgI/ml)行增强扫描,胰腺实质期(实质期)平均成像时间延迟45 s,门静脉期平均成像时间延迟70 s,三期相扫描层厚均为2 mm。
将所有数据导入3D Slicer 4.10(www.slicer.org)软件,以实质期图像为固定相,对平扫期及门静脉期图像进行配准(图1)。由2名具有10年以上腹部影像学诊断经验的主治医师在实质期图像上避开钙化灶、胰胆管、胰周血管及伪影手动勾画肿瘤各个层面感兴趣区(region of interest, ROI),并尽可能于肿瘤同一层面勾画周围胰腺实质ROI,重建肿瘤及周围胰腺实质的三维容积感兴趣区(volume of interest, VOI)。以Matlab R2018a(Math Works, USA)软件提取3期图像中肿瘤及胰腺实质VOI的CT值,将VOI内点对点CT值相减后,取其均值为最终结果,由此获得肿瘤实质期、门静脉期及平扫期CT值差(CT实质期-平扫期和CT门静脉期-平扫期)和实质期、门静脉期肿瘤与胰腺实质CT值的差值,即实质期CT胰腺-肿瘤和门静脉期CT胰腺-肿瘤。
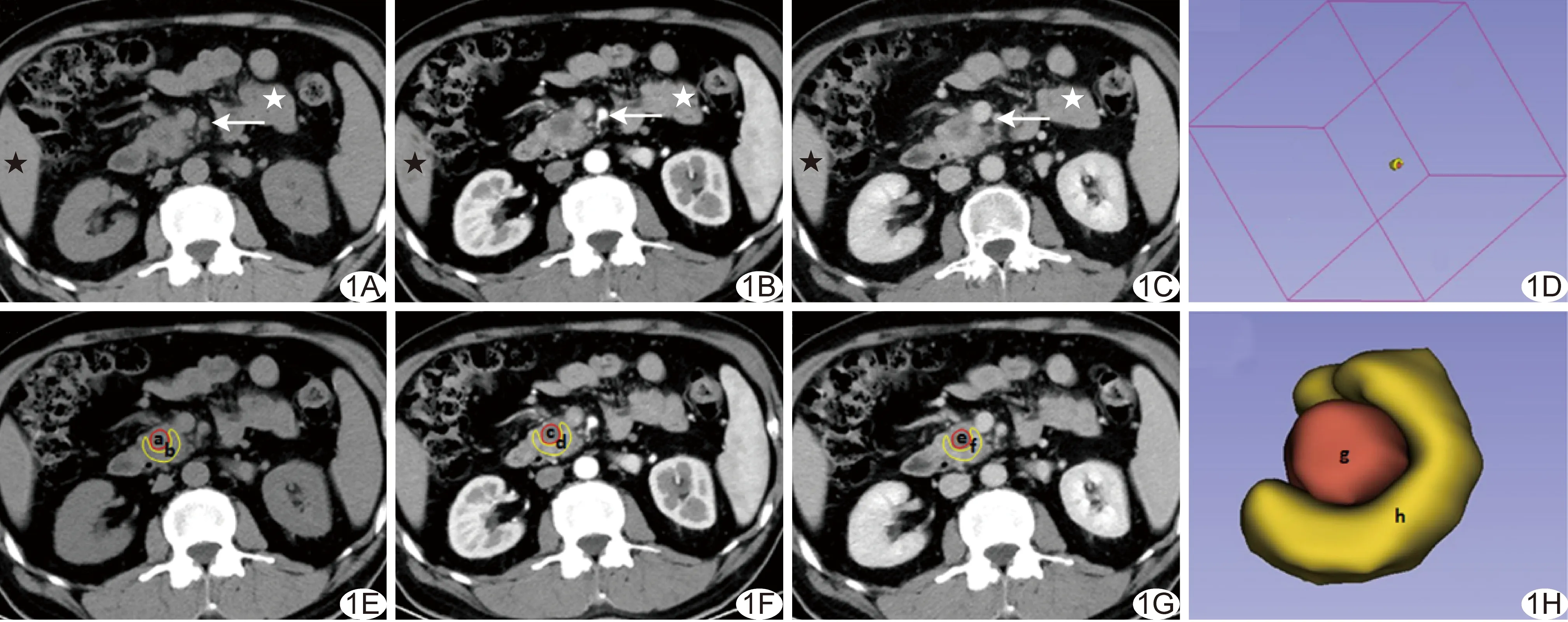
图1 勾画肿瘤及胰腺实质VOI示意图 A~C.分别为配准前平扫期(A)、实质期(B)及门静脉期(C)胰腺CT图像,配准前同一肿瘤层面3期肝脏(黑星)、肠管(白星)及肠系膜上动脉(箭)未在同一层面; D.重建配准前肿瘤及胰腺实质VOI; E~G.分别为配准后平扫期(E)、实质期(F)及门静脉期(G)胰腺CT图像,同一肿瘤层面结构基本一致,实质期CT胰腺-肿瘤为CTd-CTc,门静脉期CT胰腺-肿瘤为CTf-CTe,肿瘤CT实质期-平扫期为CTc-CTa,肿瘤CT门静脉期-平扫期为CTe-CTa; H.重建配准后肿瘤(g)及胰腺实质(h)VOI
1.3 临床及病理资料分析 由2名具有10年以上病理学诊断经验的主治医师共同观察大体标本中肿瘤位置(胰头、体、尾)、大小、分化程度(高、中、低)、有无淋巴结转移和手术切缘状态(R0/R1,R0为肉眼及显微镜下均未见手术切缘肿瘤残留;R1为肉眼未见手术切缘肿瘤残留,显微镜下见手术切缘肿瘤残留),并评估肿瘤纤维间质含量[7]:<33%为含量低;33%~66%为含量中等;>66%为含量高。记录患者基本资料及实验室生化检查结果(CA19-9)。
1.4 统计学分析 采用IBM SPSS Statistics 25.0统计分析软件。以±s表示符合正态分布的计量资料,以中位数(上下四分位数)表示非正态分布计量资料,以频数表示计数资料。采用Spearman轶相关检验分析各CT值差与肿瘤分化程度、肿瘤纤维间质含量的关系,|r|<0.4为低度相关,0.4≤|r|<0.7为中度相关,|r|≥0.7为高度相关。采用Kaplan-Meier法分析PDAC患者总生存率,以Cox比例风险模型行单因素及多因素分析其影响因素。P<0.05为差异有统计学意义。
2 结果
150例PDAC中,高分化64例,中分化47例,低分化39例。实质期CT胰腺-肿瘤与肿瘤分化程度呈中度负相关(r=-0.67,P<0.05),余CT差值与肿瘤分化呈低度相关,见表1。实质期及门静脉期CT胰腺-肿瘤与肿瘤内纤维间质含量均呈中度负相关(r=-0.51、-0.21,P均<0.05),余CT差值与肿瘤内纤维间质含量无明显相关。见图2、3。
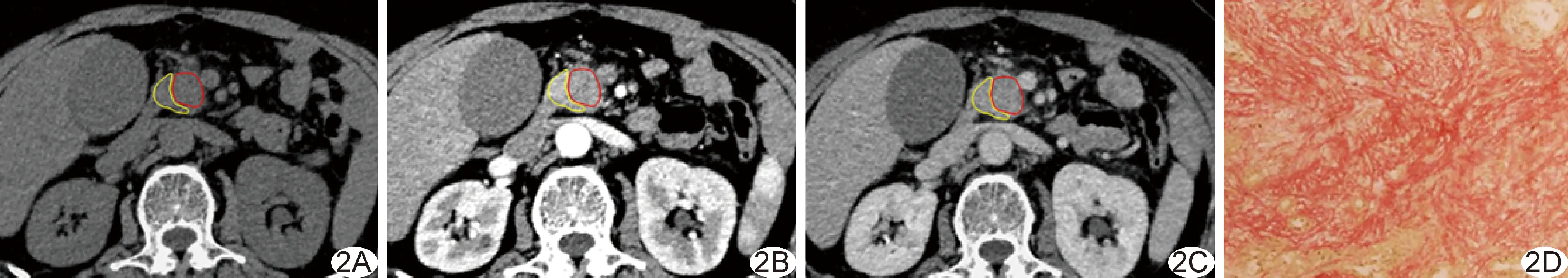
图2 患者男,45岁,胰头癌 A~C.分别为平扫期(A)、实质期(B)、门静脉期(C)增强CT图像(红色区域为肿瘤,黄色区域为胰腺实质),实质期CT胰腺-肿瘤=59 HU; D.病理图(HE, ×100),肿瘤内纤维间质含量低

表1 PDAC各VOI的CT值差(HU)与肿瘤分化程度的相关性分析结果
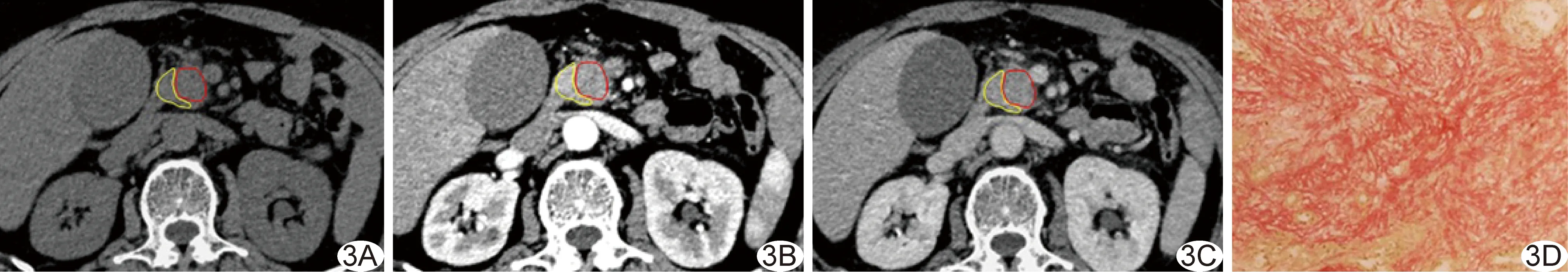
图3 患者女,57岁,胰头癌 A~C.分别为平扫期(A)、实质期(B)、门静脉期(C)增强CT图像(红色区域为肿瘤,黄色区域为胰腺实质),实质期CT胰腺-肿瘤=13 HU; D.病理图(HE, ×100),肿瘤内纤维间质含量高
随访结束时,150例中,137例死亡,总生存时间28(16,42)个月;1年、3年及5年总生存率分别为92.67%、37.33%及10.00%。分别以3.0 cm(术后病理所见肿瘤最大径的中位值)及各CT值差的中位值为分割点进行分组,分析组间生存率,实质期CT胰腺-肿瘤≥37 HU组和实质期CT胰腺-肿瘤<37 HU组1年、3年、5年总生存率分别为75.32%、19.48%、3.89%和97.26%、46.58%、13.69%(P均<0.05);门静脉期CT胰腺-肿瘤≥23 HU组和门静脉期CT胰腺-肿瘤<23 HU组1年、3年、5年总生存率分别为79.45%、27.39%、4.11%和92.21%、37.66%、12.99%(P均<0.05);以CT实质期-平扫期、CT门静脉期-平扫期中位值分组,组间总生存率差异无统计学意义(P=0.08、0.07),见图4。
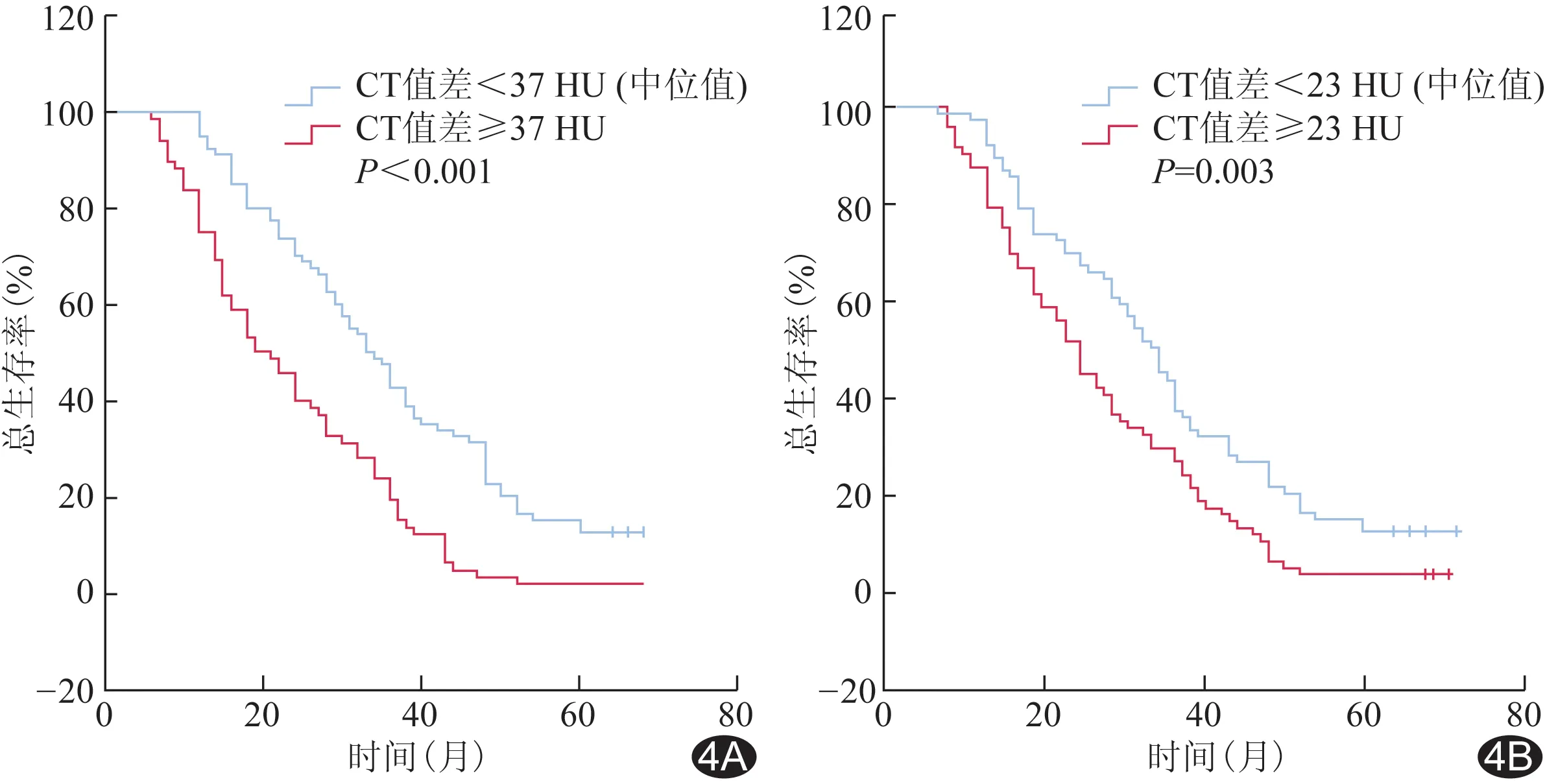
图4 PDAC患者生存曲线 A.以实质期CT胰腺-肿瘤中位值分组; B.以门静脉期CT胰腺-肿瘤中位值分组
150例PDAC患者血清CA19-9为200.62(79.89,542.93) U/mL;肿瘤最大径为3.00(1.80,6.50) cm。其中103例PDAC位于胰头,18例位于胰体,29例位于胰尾。47例存在淋巴结转移。137例手术切缘状态为R0,13例为R1。单因素生存分析结果显示肿瘤最大径、分化程度、淋巴结转移、手术切缘状态、实质期CT胰腺-肿瘤及门静脉期CT胰腺-肿瘤是PDAC患者总生存时间的影响因素(P均<0.05);将其中差异有统计学意义的变量纳入Cox比例风险模型进行多因素分析,结果显示肿瘤分化程度、淋巴结转移、手术切缘状态及实质期CT胰腺-肿瘤是PDAC患者总生存时间的独立影响因素(P均<0.05)。见表2。
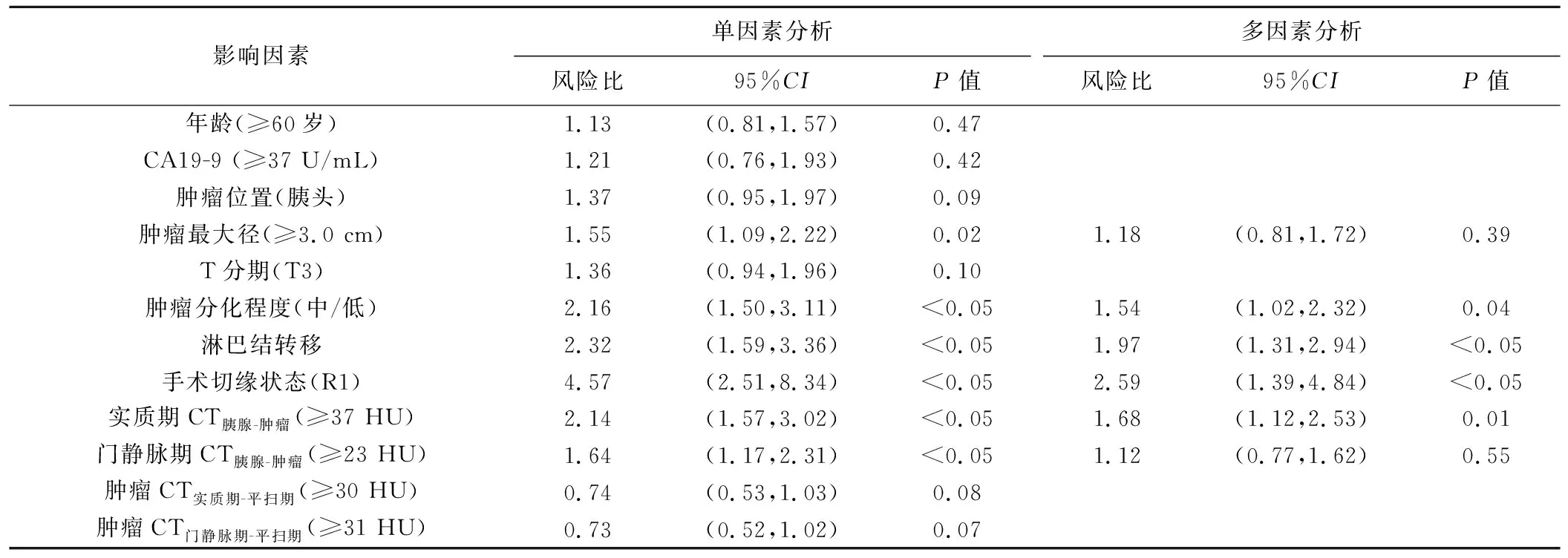
表2 影响PDAC患者生存时间的单因素及多因素分析结果
3 讨论
目前标准双期动态CT增强是诊断胰腺癌最有价值的手段,肿瘤强化方式反映其血供,与其生物学特性、恶性程度密切相关。刘鹏等[8]提出动脉期CT值差对诊断胰腺癌具有重要价值。YOON等[9]发现58%与周围实质强化差异小的胰腺肿瘤为高分化肿瘤。朱玉春等[5]发现肿瘤恶性程度与其强化程度成反比。本研究对肉眼所见PDAC平扫和增强CT强化差异进行量化分析,发现前述CT值差均与肿瘤分化程度相关,其中实质期CT肿瘤-胰腺与肿瘤分化程度呈中度负相关。
胰腺癌预后受多种因素影响,其中肿瘤分化程度、淋巴结转移、手术切缘状态及临床分期最为重要[10],但多须经手术获得,可用于术前评估预后的参数较少。KIM等[11]报道,相比周围胰腺实质,增强CT中PDAC呈等密度强化者总生存时间长于呈较低密度者。FUKUKURA等[12]发现实质期强化程度高的PDAC患者总生存时间长于强化程度较低者,且实质期强化是影响PDAC患者预后的独立因素。本研究中
实质期及门静脉期CT胰腺-肿瘤小于中位值的PDAC患者总生存时间长于差值大于中位值者,提示实质期CT胰腺-肿瘤是PDAC患者的独立影响因素。
CT值差能校准个体差异,反映CT增强程度与肿瘤病理的关系。胰腺癌恶性程度不同,肿瘤在胰腺组织中所占比例亦不同。决定低级别肿瘤强化程度的是其内占比较高的残存胰腺组织,故其实质期强化程度较高,CT胰腺-肿瘤较小;高级别肿瘤中很少或无胰腺组织残留,决定其强化程度的是瘤体本身,实质期肿瘤强化程度低,CT胰腺-肿瘤大,且肿瘤较大时,中心可出现灶性或片状更低密度坏死区,CT胰腺-肿瘤更大[5]。另一方面,实质期CT胰腺-肿瘤小的肿瘤较差值大者残存胰腺腺泡更多,纤维间质含量更高[13]。纤维间质多由疏松纤维组成,对血供影响较小;但致密纤维可压迫小动脉而减少肿瘤血供,对肿瘤血液循环影响较大,使其强化程度较低[14]。
综上,PDAC实质期CT胰腺-肿瘤与肿瘤分化程度及纤维间质含量均呈负相关,值差越小,肿瘤级别越低,患者生存时间越长,预后越好。但本研究为单中心回顾性研究,不可避免存在选择性偏倚;增强CT无法精确定量肿瘤新生血管;观察对象均为可切除性PDAC,且排除了接受新辅助治疗者,导致结果存在偏倚。
