抗菌肽Jelleine-I的抑菌稳定性及Jelleine-I系列脂肽对柑橘果实绿霉病的控制效果
2020-07-23李心丹马佳宏王文军曾凯芳
李心丹,马佳宏,王文军,曾凯芳,2,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学食品贮藏与物流研究中心,重庆 400715)
柑橘类水果在贮藏过程中易被真菌侵染而发病,造成重大经济损失[1]。其中,由指状青霉(Penicillium digitatum)引起的绿霉病是柑橘贮藏期主要的侵染性病害之一[2]。目前,人们多采用抑霉唑、咯菌腈和咪鲜胺等传统化学杀菌剂来控制绿霉病害。但化学杀菌剂会威胁到环境和人体健康,并可能使病原菌产生耐药性,这使其应用受到一定限制[3-4]。近年来,抗菌肽因具有广谱抑菌性、对宿主细胞低毒性和不易诱导病原菌产生抗性等优点,得到越来越多的关注,研究人员期待能将抗菌肽开发为一种可替代化学杀菌剂的新型药物或防治方法[5-8]。
Jelleine-I(PFKLSLHL-NH2)是一种从蜜蜂(Apis mellifera)蜂王浆中分离得到的抗菌肽[9]。前期研究表明,Jelleine-I能有效控制柑橘果实绿霉病的发生,且对血红细胞几乎无溶解性[10]。此外,Jelleine-I对细菌和酵母也具有独特的抑菌活性[11-12]。Jelleine-I的广谱抑菌性和低溶血性使其具有极大的开发应用价值。但在抗菌肽的研究过程中,研究者们发现抗菌肽的抑菌活性容易受到温度、pH值、阳离子和蛋白酶等的影响[13-15],这将严重阻碍抗菌肽在实际生产中的应用。然而,关于Jelleine-I对P. digitatum的抑菌稳定性尚不清晰。为提高现有抗菌肽的抑菌活性,获得更多能有效抑菌的抗菌肽,研究者们开始致力于改造抗菌肽,如替换多肽序列某些位点的氨基酸、修饰氨基酸、连接天然抑菌物质和形成杂合肽等[16-22]。但对于抗菌肽Jelleine-I的改造,仅限于对序列中苯丙氨酸进行卤化修饰[12],其他改造方法鲜见报道。
前期研究表明,抗菌肽Jelleine-I能抑制P. digitatum的生长,最小抑菌浓度(minimum inhibitory concentration,MIC)为6.25 μmol/L[10]。本实验旨在通过研究不同因素对抗菌肽Jelleine-I抑菌活性的影响,评价Jelleine-I的抑菌稳定性。同时,通过将有抑菌活性的脂肪酸[23-24]、肉桂酸(cinnamic acid,cin)[25]和对羟基肉桂酸(p-hydroxy cinnamic acid,pHCA)[26]与Jelleine-I连接形成脂肽,评价脂肽对柑橘果实绿霉病的控制效果,从而为拓宽抗菌肽Jelleine-I的应用范围和防治柑橘采后绿霉病提供理论依据。
1 材料与方法
1.1 材料、菌株与试剂
实验所用柑橘品种为‘锦橙447’(Citrus sinensic(L.)Osbeckcv.Jingcheng 447#),采摘于重庆市北碚区果园,采摘后当天运回实验室。选用大小、颜色、形状和质量均匀、无机械伤的果实作为实验材料。
指状青霉分离于自然发病的丰脐果实,并通过分子生物学方法鉴定,为本实验室保藏菌种。使用前接种于马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA),25 ℃培养7 d,收集孢子并用无菌水调至所需浓度。
以抗菌肽Jelleine-I为基础设计的一系列脂肽(表1),于南京金斯瑞公司使用固相合成方法进行化学合成,纯度均大于90%。
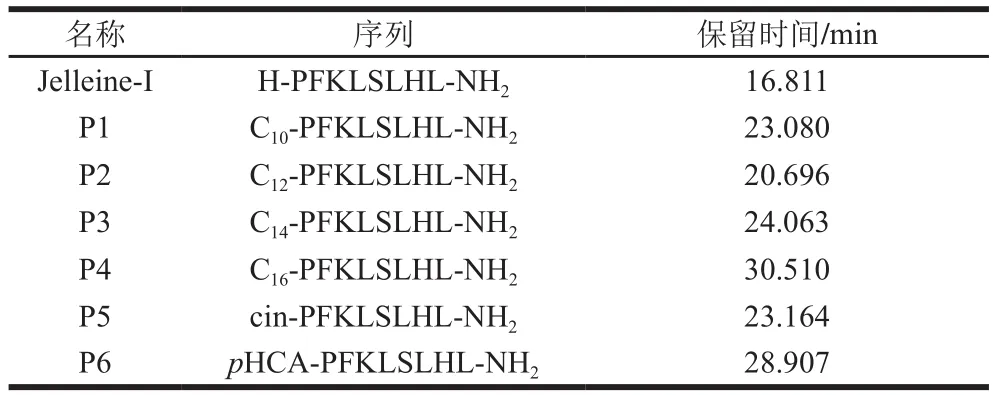
表1 实验所用抗菌肽序列和保留时间Table 1 Sequences and retention time of peptides used in the experiments
蛋白酶K、胰蛋白酶、β-胰凝乳蛋白酶 上海麦克林生化科技有限公司;琼脂粉 北京索莱宝科技有限公司。
1.2 仪器与设备
BXM30R立式高压灭菌锅 上海博迅实业有限公司医疗设备厂;SW-CJ-1F超净工作台 苏净集团安泰有限公司;DHP-9082电热恒温培养箱 上海齐欣科学仪器有限公司;B203生物显微镜 重庆奥特光学仪器有限公司;XB-K-25型血细胞计数板 上海求精生化试剂有限公司;SYNERGYH1MG全自动酶标仪 美国BioTek公司;WH-2漩涡混合仪 上海沪西分析仪器厂有限公司。
1.3 方法
1.3.1 温度对抗菌肽Jelleine-I抑菌活性的影响
实验参照Thery等[27]的方法并进行了一定的修改。将Jelleine-I干粉用无菌水配制10 MIC的溶液,分别在40、50、60、70、80 ℃下静置15 min后,快速冷却至室温。以常温下静置15 min的10 MIC Jelleine-I溶液为对照,将180 μL含有20 倍稀释马铃薯葡萄糖液体培养基(potato dextrose broth,PDB)的P. digitatum孢子悬浮液(1×104CFU/mL)和20 μL的抗菌肽Jelleine-I溶液(10 MIC)进行混合,使Jelleine-I的终浓度达到MIC。混合后立即加入96 孔板中,置于25 ℃恒温培养箱,培养48 h后经酶标仪测定OD600nm。实验重复3 次。
1.3.2 pH值对抗菌肽Jelleine-I抑菌活性的影响
实验参照Wu Guoqiu等[15]的方法并进行一定的修改。用5 mol/L的HCl或者NaOH溶液将抗菌肽Jelleine-I溶液(10 MIC)的pH值分别调节至3、4、5、6、7、8、9、10,室温静置1 h后,调节pH值至7.0。以不调节pH值的Jelleine-I溶液(10 MIC)为对照,按1.3.1节的方法测定OD600nm。
1.3.3 阳离子对抗菌肽Jelleine-I抑菌活性的影响
实验参考López-García[28]和Boziaris[29]等的方法并进行一定修改。配制不同浓度的KCl、NaCl和CaCl2溶液,121 ℃灭菌20 min。将不同浓度的KCl、NaCl和CaCl2溶液与抗菌肽Jelleine-I溶液进行混合,使Jelleine-I终浓度为10 MIC,KCl终浓度分别为5、20、35、50 mmol/L,NaCl终浓度分别为50、100、150、200 mmol/L,CaCl2终浓度分别为1、5、25、125 mmol/L。实验以不加阳离子的Jelleine-I溶液(10 MIC)为对照,按1.3.1节的方法测定OD600nm。
1.3.4 蛋白酶对抗菌肽Jelleine-I抑菌活性的影响
实验参考Kim[30]和Zhao Yanyan[31]等的方法并进行一定修改。将蛋白酶K、胰蛋白酶和β-胰凝乳蛋白酶用50 mmol/L的Tris-HCl缓冲液(pH 7.0)进行溶解,并进行10 倍梯度稀释。将不同质量浓度的蛋白酶溶液与Jelleine-I溶液混合,使Jelleine-I终浓度为10 MIC,蛋白酶的终质量浓度分别为1、10-1、10-2、10-3、10-4mg/mL,并在37 ℃条件下反应4 h,以80 ℃灭活处理5 min。实验以不进行蛋白酶处理的Jelleine-I溶液(10 MIC)为对照,按1.3.1节的方法测定OD600nm。
1.3.5 抗菌肽Jelleine-I系列脂肽对P. digitatum生长抑制的剂量曲线
实验参照Jia Fengjing等[11]的方法并进行一定修改。将180 μLP. digitatum孢子悬浮液(1×104CFU/mL,含20 倍稀释的PDB)和20 μL抗菌肽溶液混合,再立即加入96 孔板中,使抗菌肽的终浓度分别为0、0.78、1.56、3.12、6.25、12.5、25、50 μmol/L和100 μmol/L,然后置于25 ℃恒温培养箱中培养48 h后用酶标仪测定其OD600nm。以48 h时抗菌肽依旧能完全抑制病原菌生长的最低浓度作为MIC。
1.3.6 抗菌肽Jelleine-I系列脂肽对柑橘果实绿霉病的控制效果
实验参照Zhou Yahan等[32]的方法并进行一定的修改。果实用体积分数2%的次氯酸钠溶液浸泡2 min,清水冲洗干净后室温晾干。果实表面赤道部位用体积分数75%乙醇溶液擦拭消毒后,用无菌打孔器在果实赤道对称部位打两个孔(直径4 mm、深3 mm)。将新鲜孢子悬浮液与抗菌肽溶液混合后,立即接种10 μL混合液(孢子悬浮液浓度为1×104CFU/mL、抗菌肽浓度为100 μmol/L)于每孔中。实验以无菌水为阴性对照组,Jelleine-I为阳性对照组,P1、P2、P3、P4、P5和P6为处理组。每组处理15 个果实,重复3 次。待液体完全吸收后,用聚乙烯薄膜袋(170 mm×140 mm)将果实单果包装,置于25 ℃、相对湿度90%~95%的环境中贮藏,每天统计发病率和病斑直径。当果实伤口区以外腐烂区超过1 mm宽时,被认为是发病的果实。发病率为腐烂果数和总果数的比值,病斑直径为腐烂区的测量直径。
1.4 数据处理与分析
采用Excel 2013软件统计分析数据,运用Graph Pad Prism 5软件和Adobe Photoshop CS 6软件制图;用SPSS 21.0软件对数据进行方差分析,利用Duncan’s多重比较进行差异显著性检验,P<0.05表示差异显著。
2 结果与分析
2.1 温度对抗菌肽Jelleine-I抑菌活性的影响

图1 不同温度对抗菌肽Jelleine-I抑制P. digitatum的影响Fig. 1 Effect of different temperatures on the antifungal activity of peptide Jelleine-I against P. digitatum
随着P. digitatu培养时间的延长,孢子开始萌发,孢子萌发后的菌丝会悬浮在培养液中,使OD600nm增加。因此,OD600nm与P. digitatum的生长呈正相关,与Jelleine-I的抑菌活性呈负相关。由图1可知,各处理组的OD600nm与对照组无显著差异(P>0.05)。表明抗菌肽Jelleine-I对P. digitatum的抑菌活性不受温度(40~80 ℃)的影响,Jelleine-I具有热稳定性。
2.2 pH值对抗菌肽Jelleine-I抑菌活性的影响
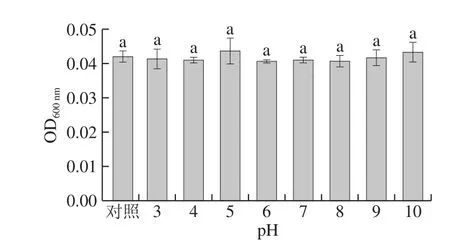
图2 不同pH值对抗菌肽Jelleine-I抑制P. digitatum的影响Fig. 2 Effect of different pHs on the antifungal activity of peptide Jelleine-I against P. digitatum
如图2所示,抗菌肽Jelleine-I在不同pH值条件下处理1 h后,其对P. digitatum的生长抑制作用与对照组无显著性差异(P>0.05)。表明抗菌肽Jelleine-I对P. digitatum的抑菌活性不受pH值的影响,Jelleine-I具有酸碱稳定性。
2.3 阳离子对抗菌肽Jelleine-I抑菌活性的影响
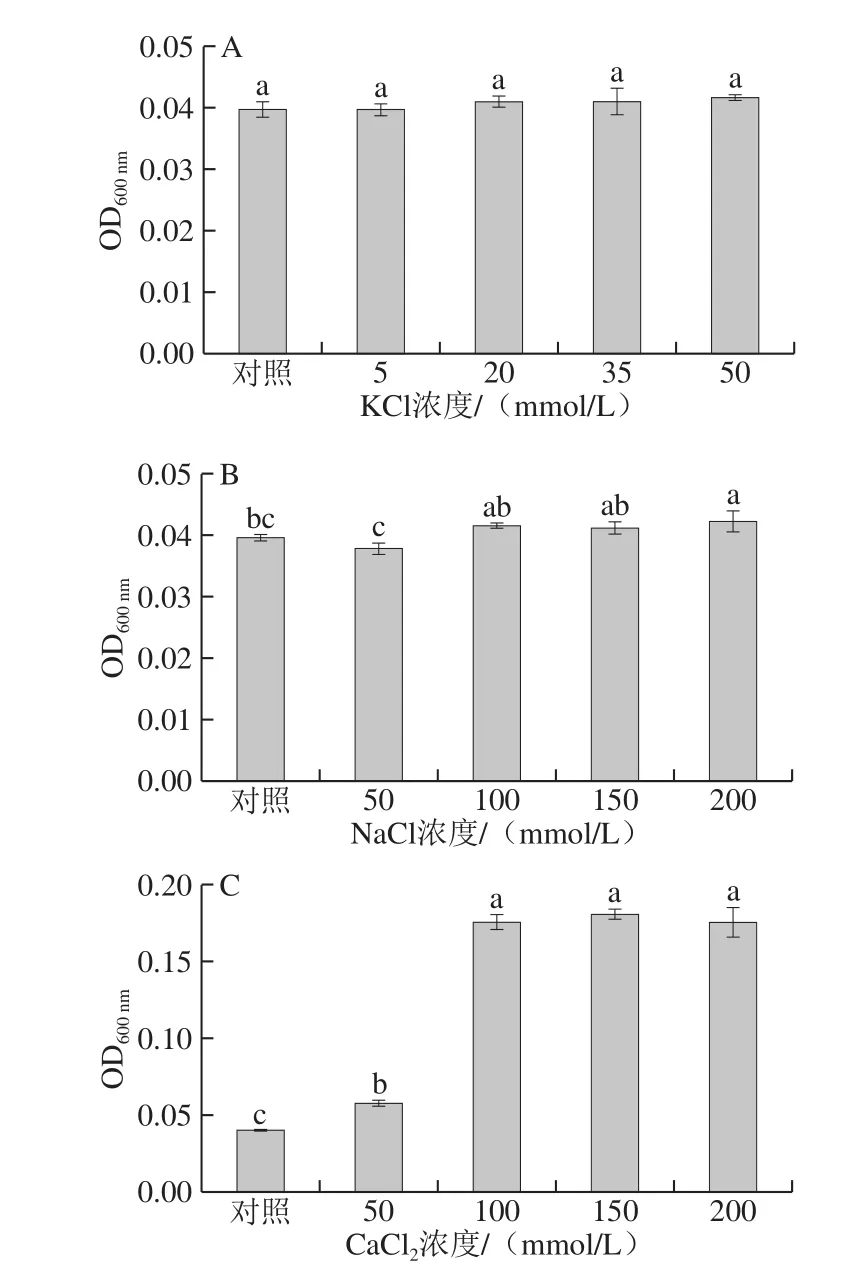
图3 阳离子K+(A)、Na+ (B)和Ca2+(C)对抗菌肽Jelleine-I抑制P. digitatum的影响Fig. 3 Effects of K+ (A), Na+ (B) and Ca2+ (C) on the antifungal activity of peptide Jelleine-I against P. digitatum
如图3A所示,在不同浓度的K+溶液中,抗菌肽Jelleine-I仍能保持对P. digitatum的抑制作用,且抑菌活性与对照无显著性差异(P>0.05)。由图3B可知,Jelleine-I经Na+处理后,仅在高浓度Na+溶液(200 mmol/L)中,Jelleine-I对P. digitatum的抑菌活性减弱,抑菌活性与对照组存在显著性差异(P<0.05)。由图3C可知,存在Ca2+的条件下,Jelleine-I的抑菌活性随着溶液中Ca2+浓度的增加出现减弱现象。结果表明,不同阳离子会对Jelleine-I的抑菌活性产生不同的影响。
2.4 蛋白酶对抗菌肽Jelleine-I抑菌活性的影响
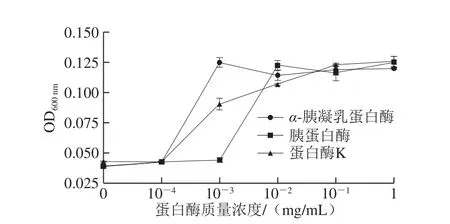
图4 不同蛋白酶对抗菌肽Jelleine-I抑制P. digitatum的影响Fig. 4 Effects of different proteases on the antifungal activity of peptide Jelleine-I against P. digitatum
如图4所示,经3 种低质量浓度(10-4mg/mL)蛋白酶处理后,Jelleine-I抑菌活性不发生改变。但随着蛋白酶质量浓度的增加,Jelleine-I抑菌活性逐渐减弱。其中,当β-胰凝乳蛋白酶和蛋白酶K的质量浓度增加至10-3mg/mL时,Jelleine-I抑菌活性明显减弱,与对照组比较,OD600nm分别增加了0.086和0.048。当胰蛋白酶质量浓度增加至0.01 mg/mL时,OD600nm增加了0.084。
2.5 抗菌肽Jelleine-I系列脂肽对P. digitatum生长抑制的剂量曲线
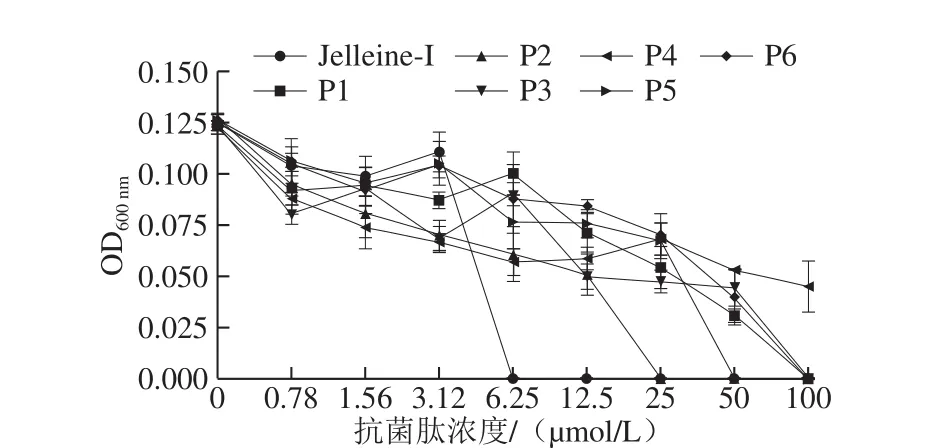
图5 抗菌肽Jelleine-I系列脂肽对P. digitatum生长抑制的剂量曲线Fig. 5 Dose-response curves for growth inhibition of P. digitatum by lipopeptides derived from Jelleine-I
如图5所示,随着抗菌肽浓度的增加,P. digitatum的生长受到抑制的程度不断增加。当抗菌肽P2浓度为25 μmol/L,P5浓度为50 μmol/L,P1、P3和P6浓度均为100 μmol/L时,能完全抑制P. digitatum的生长。而抗菌肽P4在实验浓度范围内没有出现完全抑菌的效果。因此,实验所用抗菌肽Jelleine-I、P1、P2、P3、P5和P6的MIC分别为6.25、100、25、100、50、100 μmol/L。
2.6 抗菌肽Jelleine-I系列脂肽对柑橘果实绿霉病的控制效果
如图6所示,在损伤接种后的3~5 d内,Jelleine-I和所有处理组的发病率都显著低于阴性对照无菌水处理组(P<0.05),抗菌肽P1和P2处理组的发病率和病斑直径与阳性对照Jelleine-I组之间无显著性差异(P>0.05)。在接种后4~5 d内,抗菌肽P4、P5和P6处理组病斑直径整体上显著高于阳性对照Jelleine-I处理组(P<0.05),与阴性对照组无显著性差异(P>0.05)。在接种后第3天和第4天,抗菌肽P3处理组的发病率和病斑直径与Jelleine-I处理组之间无显著性差异(P>0.05),在第5天时,抗菌肽P3处理组的发病率与病斑直径分别增加至53.33%和37.28 mm,显著高于阳性对照Jelleine-I处理组(P<0.05)。

图6 抗菌肽Jelleine-I系列脂肽对柑橘果实绿霉病发病率(A)和病斑直径(B)的影响Fig. 6 Effects of lipopeptides derived from Jelleine-I on disease incidence (A) and lesion diameter (B) of citrus fruit caused by P. digitatum
3 讨 论
抗菌肽因具有广谱抑菌性、低毒性以及不易产生耐药性等优点,有望成为一种能替代传统化学杀菌剂的新型抑菌物质。对于任何一种新型抑菌物质,厘清其抑菌活性、抑菌稳定性和抑菌机理对其后期的开发应用都具有重要意义。本实验首先探究了温度、pH值、阳离子和蛋白酶对Jelleine-I抑菌活性的影响。实验结果表明,在经过不同的温度和pH值处理后,Jelleine-I均能保持原有抑菌活性,说明Jelleine-I对P. digitatum的抑菌作用具有热稳定性和耐酸碱性。这与大多数抗菌肽的热稳定性和酸碱稳定性[27,33-34]一致。而Jelleine-I经不同阳离子处理后,不同阳离子会对Jelleine-I的抑菌活性产生不同的影响。Jelleine-I经一价阳离子(K+和Na+)处理后,仅高浓度Na+(200 mmol/L)能减弱其抑菌活性,在其他的处理中均能保持其原有抑菌活性。而经二价阳离子(Ca2+)处理后,Jelleine-I抑菌活性显著减弱。经研究表明,现有的抗菌肽大部分为阳离子抗菌肽,其主要通过静电作用与细胞膜结合后发挥作用[15,35]。然而细胞外阳离子的存在使细胞膜表面的净电荷增加,从而减弱或者阻止了抗菌肽与细胞膜的静电作用,最终导致抗菌肽抑菌活性减弱或丧失[36-38]。Jelleine-I经不同质量浓度的3 种蛋白酶处理后,在低质量浓度的3 种蛋白酶中,能保持其原有的抑菌活性,但随3 种蛋白酶质量浓度的增加,Jelleine-I的抑菌活性逐渐减弱。因抗菌肽是由基因编码、核糖体合成的多肽,所以其抑菌活性可能会受蛋白酶的影响[27,36,39],在高浓度蛋白酶处理后,Jelleine-I的结构可能被蛋白酶破坏,从而造成其抑菌活性的衰减。
基于前期研究表明,Jelleine-I能控制柑橘果实绿霉病,特异性识别宿主细胞[10],且其抑菌活性具有热稳定性、耐酸碱性和对低浓度蛋白酶和一价阳离子不敏感等特性,具有潜在的应用价值。为了进一步提高Jelleine-I的抑菌活性,获得更多能有效控制柑橘果实绿霉病的抗菌肽,本实验将Jelleine-I与天然抑菌物质连接形成脂肽,并研究脂肽对柑橘绿霉病的控制效果。结果表明,6 种脂肽的MIC都高于母肽Jelleine-I,且其抑菌作用均弱于母肽Jelleine-I。损伤接种实验中,6 种脂肽都能控制绿霉病的发生,P1和P2的控病效果与Jelleine-I无明显差异,但其余4 种脂肽的控病能力均弱于Jelleine-I。在对多肽结构与功能研究时发现,多肽的氨基酸排列顺序、长度、两亲性、疏水性、净电荷和二级结构等参数均会影响多肽的抑菌活性,其中,疏水性起着非常重要的作用[40-42]。多肽的疏水性可以通过测定多肽在反相高效液相色谱中的保留时间来确定。而在探究疏水性与抑菌活性的关系时发现,多肽的疏水性应保持在一定范围,疏水性过高会导致抗菌肽自身聚集,降低抑菌活性;疏水性过低会降低抗菌肽对膜的插入能力,降低抑菌活性[21,43]。由表1可知,实验中所用脂肽的保留时间都长于Jelleine-I,表明脂肽的疏水性都高于Jelleine-I,这可能也是脂肽抑菌效果弱于母肽的原因。
4 结 论
实验结果表明,能有效控制柑橘绿霉病的抗菌肽Jelleine-I对P. digitatum的抑菌活性具有热稳定性、耐酸碱性,对低质量浓度蛋白酶和K+、Na+不敏感的特点,具有极大的应用价值。将天然抑菌物质和Jelleine-I连接后,脂肽P1和P2的控病效果与Jelleine-I无明显差异,但其余4 种脂肽可能由于疏水性过高,使其控病能力均弱于Jelleine-I。实验结果可为后期改造抗菌肽以及拓宽抗菌肽Jelleine-I的应用范围和防治柑橘采后绿霉病提供理论依据。
