原花青素对铁超载大鼠肾脏铁含量、氧化应激及Fas、Bax基因表达的影响
2020-07-23云少君褚东阳何兴帅张文芳冯翠萍
云少君,褚东阳,何兴帅,张文芳,冯翠萍*
(山西农业大学食品科学与工程学院,山西 太谷 030801)
铁元素广泛存在于各种生物体中[1-2]。体内铁过量除会发生Fenton反应外[3],还能够直接和不饱和脂肪酸结合,导致脂质过氧化[4]。体内过量的铁可以在多种组织诸如肝脏、心脏和肾脏中蓄积,导致相应脏器的氧化损伤。研究表明,体内铁过量可以引起肾脏功能性异常,如尿毒症和肾癌等[5-6]。因此,体内铁代谢的平衡对于机体的健康是至关重要的。
目前临床上对抗铁负荷的方法主要是采用药物治疗,多采用一些重金属螯合剂[7],如去铁胺、去铁酮等。药物的治疗虽然迅速有效,但是多伴随着如皮肤红疹、恶心、呕吐等副作用。此外,机体抗氧化能力的提升也被认为是对抗铁负荷所致氧化损伤的有效措施,已有研究表明,使用抗氧化蛋白[8]、大麻二酚[9]以及金花草[10]等一些中草药都能够改善铁过量造成的损伤。
原花青素(proanthocyanidins,PAs)拥有很强的生物活性和药理作用[11-13]。体内外实验均表明,PAs能够抑制自由基生成,提高抗氧化酶的活性,其清除氧自由基的能力要强于VC、VE以及β-胡萝卜素[14-15]。同时,PAs所含的酚类结构亦是有效的铁螯合剂[16]。葡萄籽原花青素(grape seed proanthocyanidins,GSPAs)含量丰富,其作为营养补充剂被人们广泛使用。而本课题组之前的实验结果表明GSPAs能够抑制大鼠吸收大豆铁蛋白中的铁;在单纯给予缺铁大鼠安全摄入量范围的GSPAs后,缺铁大鼠均出现死亡现象,而缺铁对照组大鼠则未出现死亡现象[17]。目前,针对PAs的研究多集中在其抗氧化特性上,对于其如何影响机体铁代谢尚不清楚,而过量的铁会对肾脏功能产生损伤,原花青素是否对这一作用有抑制和改善作用尚未得知。因此,本实验拟通过构建铁超载大鼠模型,进一步探究GSPAs对铁超载的营养改善作用及其机制,为开发安全、高效的控铁制剂提供一定的理论依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性SD大鼠(8 周龄)由北京维通利华实验动物技术有限公司提供,生产许可证号:SCXK(京)2012-0001。
GSPAs(多聚体纯度为95%) 天津尖峰有限责任公司;血清总铁结合力(total iron binding capacity,TIBC)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、总抗氧化力(total antioxidant activity,T-AOC)、肌酐(creatinine,CR)和尿素氮(urea nitrogen,BUN)测定试剂盒 南京建成生物工程研究所;RNAiso Plus、SYBR®Premix Ex TaqTMII试剂盒、PrimeScriptTMRT Master Mix试剂盒、Loading Buffer 日本TaKaRa公司;DNA Marker 华美生物工程公司;聚合酶链式反应(polymerase chain reaction,PCR)引物 生工生物工程(上海)股份有限公司;焦碳酸二乙酯(diethyl pyrocarbonate,DEPC) 上海基康生物技术有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
ADVIA 2120型全自动血液分析仪 德国西门子公司;Optima 5300DV电感耦合等离子发射光谱仪美国PerkinElmer公司;BX51型显微镜 日本Olympus公司;BioPhotometer plus核酸蛋白分析仪 德国Eppendorf公司;DYCP-31CN型琼脂糖凝胶电泳仪北京六一生物科技有限公司;Mx3000P实时荧光定量PCR(real-time PCR,qPCR)仪 美国Stratagene公司。
1.3 方法
1.3.1 动物与分组
40 只雄性SD大鼠适应环境7 d后随机分成对照组(NC组)、铁超载模型组(Model组)、原花青素组(GSPAs组)、实验组(Test组)。大鼠自由摄食、饮水。参照文献[18]的方法,Model组和Test组隔天腹腔注射右旋糖酐铁(100 mg/kgmb),GSPAs组和Test组大鼠每天灌胃100 mg/kgmb的GSPAs,以生理盐水消除应激性误差。10 d实验期结束后,取大鼠肾脏组织并保存于-80 ℃。
1.3.2 红细胞、血红蛋白及TIBC的测定
取大鼠血液测定红细胞(red blood cell,RBC)数目及血红蛋白(hemoglobin,Hb)水平,依试剂盒说明书测定TIBC。
1.3.3 肾脏组织Fe含量测定
将浓硝酸与高氯酸以4∶1体积比加入一定量肾脏组织中,摇匀并封口,于室温下静置过夜,使其完全消解。次日缓慢低温加热进行消化,直到三角瓶中的液体变得澄清透明后停止加热,冷却后过滤,以体积分数1%稀硝酸溶液定容之后,通过电感耦合等离子体质谱检测Fe含量。
1.3.4 肾脏氧化应激状态的检测
按照相应试剂盒说明书对GSH-Px、SOD、MDA水平以及T-AOC进行测定。
1.3.5 CR及BUN浓度的测定
根据试剂盒说明书检测CR及BUN的水平。
1.3.6 肾脏组织HE染色及观察
参照文献[19]的方法,按照常规操作对HE染色后的肾脏组织进行组织形态学观察。
1.3.7 逆转录qPCR检测Fas、Bax基因的表达
将1 mL RNAiso Plus加入至30~50 mg肾脏组织中,充分匀浆后提取RNA。检测RNA的浓度及纯度后,将3 µL的PrimeScriptTMRT Master Mix和一定量的总RNA提取物加入EP管中,并用RNase Free ddH2O加至15 µL(反应液的配制在冰浴上进行),轻柔混合,按照37 ℃ 15 min、85 ℃ 5 s、4 ℃保存的条件进行反转录。之后按照95 ℃ 30 s;95 ℃ 5 s、62 ℃ 34 s(42 个循环);95 ℃ 15 s、62.8 ℃ 1 min、95 ℃ 15 s的条件进行PCR扩增。引物序列为:β-actin:(5’-3’)上游:TACCCAGGCATTGCTGACAG;下游:AGCCACCAATCCACACAGAG。Fas:上游:CGCAGCGGTTAGCTTTTCTG;下游:ATTTGCTCGGCAGCACAAGA。Bax:上游:TGGCGATGAACTGGACAACA;下游:CCCAGTTGAAGTTGCCGTCT。最后用MXPro-MX3000P软件对数据进行处理。
1.4 数据统计分析
采用SPSS 16.0软件,进行方差齐性检验之后选用单因素方差分析,再以Tukey法进行均数间的两两比较。以P<0.05为差异有统计学意义的判定标准。
2 结果与分析
2.1 大鼠RBC数目、Hb含量及TIBC
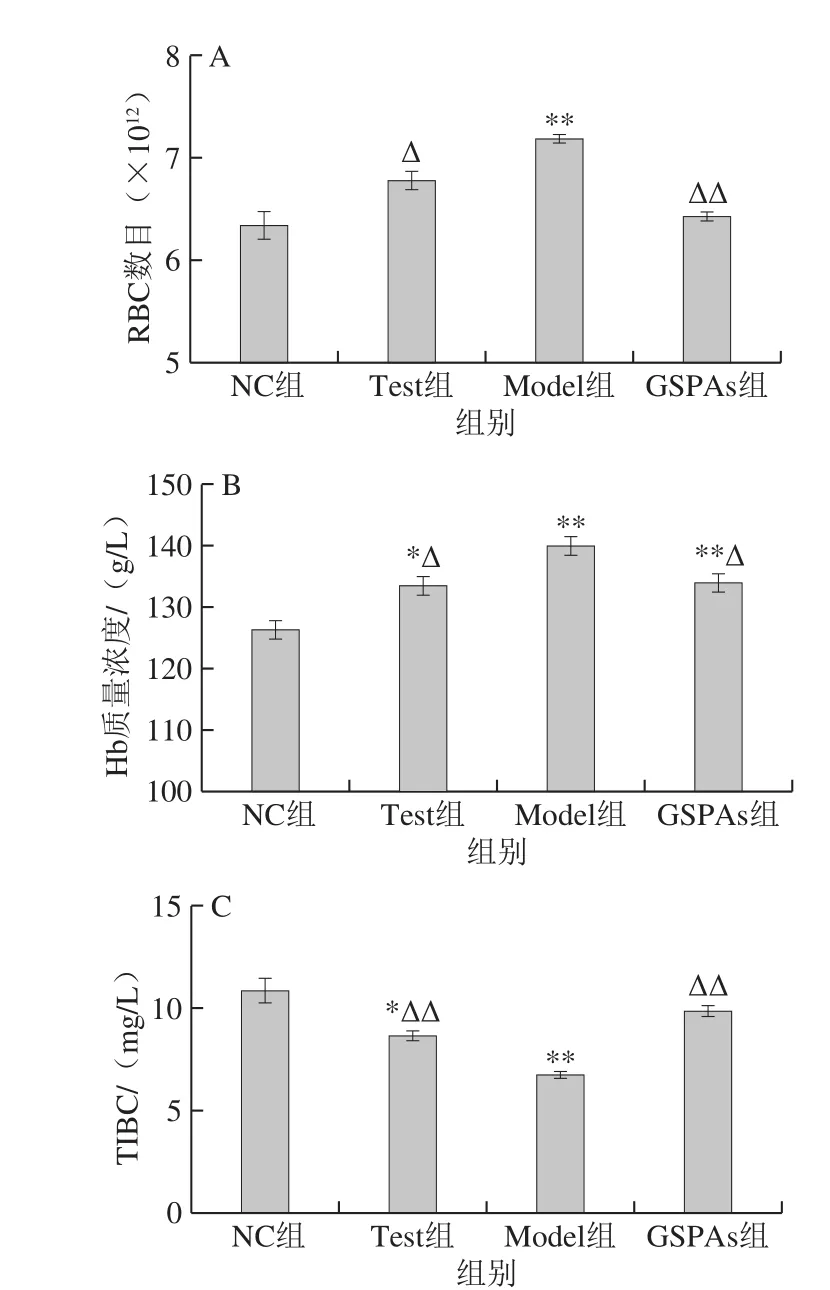
图1 GSPAs对铁超载大鼠RBC数目、Hb质量浓度和TIBC的影响Fig. 1 Effect of GSPAs on RBC content, Hb concentration and TIBC of rats with iron overload
由图1可见,Model组较NC组,大鼠血液中的RBC、Hb水平升高,TIBC降低;GSPAs组与NC组相比,Hb质量浓度极显著升高(P<0.01)。与Model组比较,Test组中的RBC数目、Hb质量浓度显著降低,TIBC显著升高(P<0.05或P<0.01)。
2.2 大鼠肾脏组织的铁含量

图2 GSPAs对铁超载大鼠肾脏Fe含量的影响Fig. 2 Effect of GSPAs on renal iron content of rats with iron overload
由图2可见,相较于NC组,Model组肾脏Fe含量极显著升高(P<0.01),GSPAs组Fe含量无明显变化。与Model组相比较,Test组Fe含量降低,但差异不显著。
2.3 大鼠肾脏组织氧化应激状态
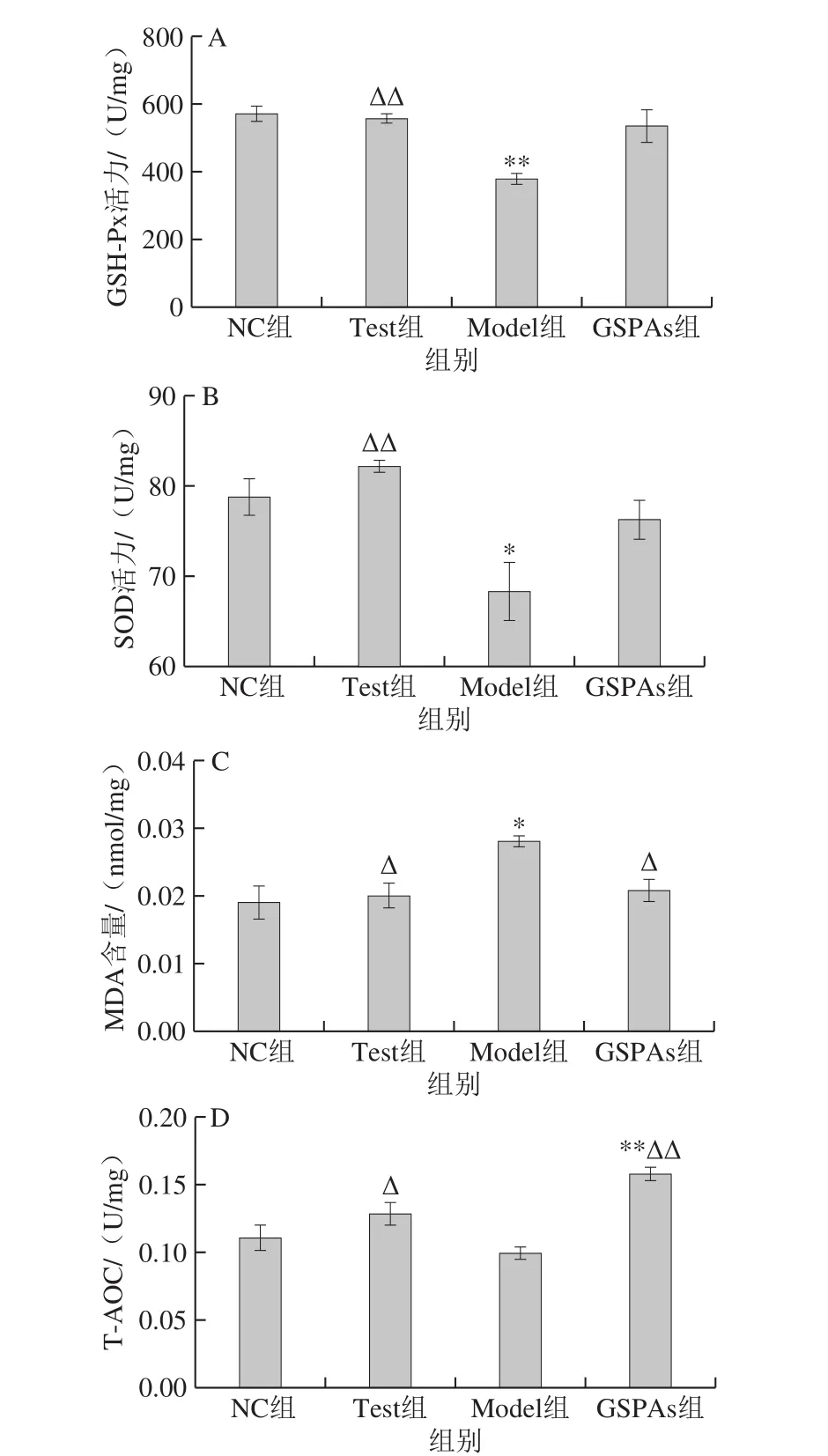
图3 GSPAs对铁超载大鼠肾脏GSH-Px、SOD活力、MDA含量、T-AOC的影响Fig. 3 Effect of GSPAs on GSH-Px activity, SOD activity, MDA content and T-AOC of kidney tissues in rats with iron overload
由图3可见,与NC组比较,Model组中的GSH-Px、SOD活力显著降低(P<0.05或P<0.01),T-AOC差异不显著,MDA含量显著升高(P<0.05);GSPAs组大鼠GSH-Px、SOD活力和MDA含量差异不显著,T-AOC极显著升高(P<0.01)。与Model组比较,Test组中GSH-Px、SOD活力以及T-AOC显著升高(P<0.05或P<0.01),MDA含量显著降低(P<0.05)。
2.4 大鼠CR和BUN水平
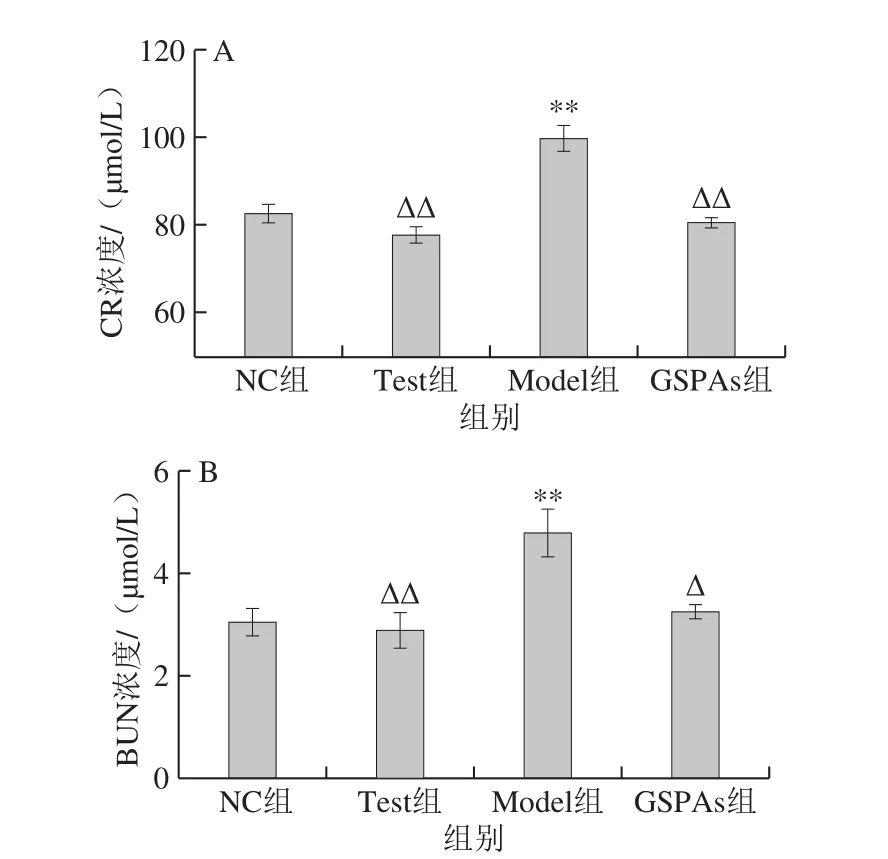
图4 GSPAs对铁超载大鼠CR和BUN浓度的影响Fig. 4 Effect of GSPAs on CR and BUN levels in rats with iron overload
从图4可见,相比NC组,Model组中的CR和BUN浓度极显著升高(P<0.01);GSPAs组差异不显著。Test组较Model组CR、BUN浓度极显著降低(P<0.01)。
2.5 大鼠肾脏组织形态学变化
HE染色结果(图5)显示各组大鼠肾脏无明显的形态学改变,肾小球和肾小管结构清晰,肾小管上皮细胞排列整齐。
2.6 大鼠肾脏组织Fas和Bax的相对表达量
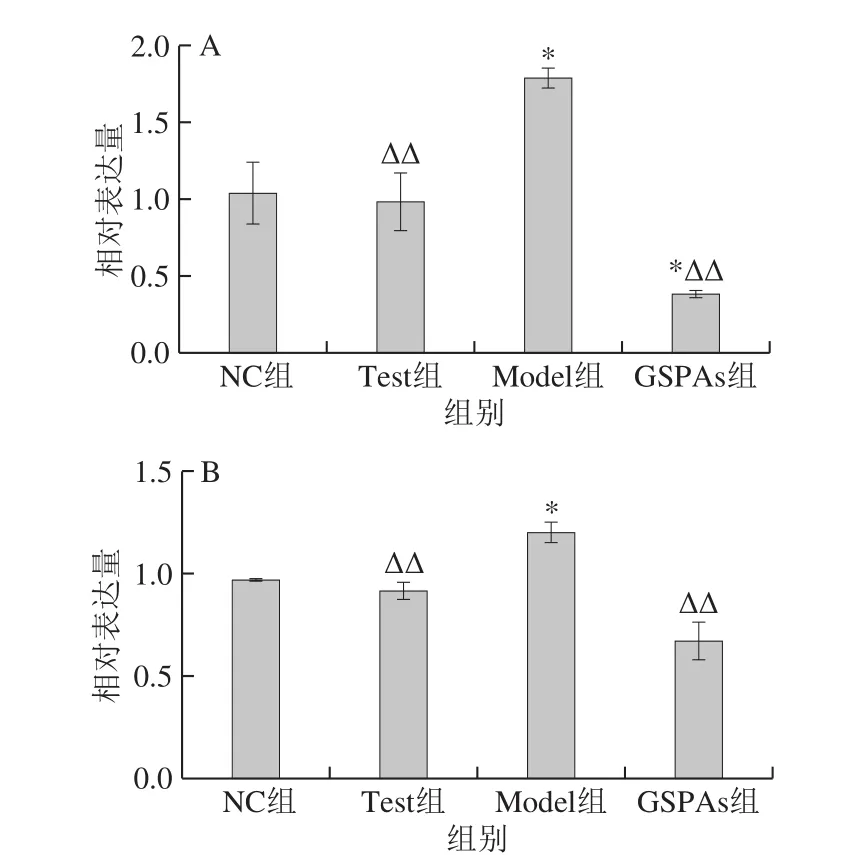
图6 GSPAs对铁超载大鼠肾脏Fas和Bax基因表达的影响Fig. 6 Effect of GSPAs on mRNA expression levels of Fas and Bax in rats with iron overload
由图6可知,较之NC组,Model组大鼠肾脏组织Fas的表达量显著升高72.17%(P<0.05);GSPAs组中Fas的表达量显著降低62.94%(P<0.05)。与Model组进行比较,Test组、GSPAs组中Fas的表达量分别极显著降低44.98%和78.48%(P<0.01)。相较于NC组,Model组大鼠肾脏组织Bax表达量显著上调23.79%(P<0.05);GSPAs组中Bax表达量降低30.67%,但差异不显著。相比Model组,Test组、GSPAs组中Bax的表达量分别极显著下调23.78%、43.99%(P<0.01)。
3 讨 论
机体的铁稳态对于细胞活动及生命的维持至关重要,而铁过量则会对机体产生一系列的损伤作用。本实验首先通过腹腔注射右旋糖酐铁的方法构建了铁超载大鼠模型,并试图进一步通过补充GSPAs探讨其对机体铁过量的影响。
机体内铁含量直接关系到Hb的水平和质量[20]。TIBC则可以反映机体中转铁蛋白的水平,从而间接反映机体的铁水平。本研究中大鼠补充过量的铁后,其RBC、Hb水平显著升高,TIBC显著降低。而Test组在补充GSPAs后,以上指标均发生显著性逆转。研究发现多酚提取物可调控铁代谢相关蛋白和转铁蛋白受体[21]。Li Changhong等[22]的研究发现多酚可直接清除氧自由基,同时还可螯合铁离子。结合本课题组前期研究结果[17],推测本实验中GSPAs同样通过其螯合特性拮抗了铁过量的发生,使体内铁水平趋于正常。
为了进一步探讨GSPAs对于机体铁水平的影响,选取铁过量时铁沉积最为常见的肾组织进行研究。结果发现,在补铁10 d后,Model组大鼠肾脏组织中铁含量极显著升高,而铁负荷大鼠同时给予GSPAs干预后,其肾脏组织中铁含量虽无显著差异,但有下降趋势。与以上结果保持一致,说明GSPAs通过螯合铁离子,有降低其在肾脏组织中沉积的作用。
过多的铁沉积在肾脏处会通过氧化应激产生肾毒性,推动肾病的发生[23]。本实验发现Model组大鼠肾脏组织发生明显的氧化应激,而GSPAs可显著改善这一状态。研究表明,PAs能直接清除活性氧自由基、螯合金属离子,进而降低其氧化特性[24]。此外,其能够诱导内生的抗氧化酶的活性进而发挥间接的抗氧化特性[25]。另有研究发现GSPAs可以提高肾脏组织的抗氧化能力[26]。本研究同样表明铁过量导致了肾脏组织的氧化应激,而GSPAs则对铁超载所致大鼠肾脏氧化损伤具有明显的拮抗效应。
此外,肾组织的损伤程度可以通过CR、BUN水平以及组织形态学来反映。CR的含量在一定程度上能够反映肾小球的滤过率,肾脏功能障碍越严重,血浆中CR含量越高[27]。同时肾小球滤过功能受损也会导致血浆中的BUN含量增高[28-29]。本实验中,Model组大鼠CR、BUN含量明显升高,说明铁过量引起了大鼠肾脏功能受损,与之前报道结果一致[30-31]。而铁超载大鼠进行GSPAs干预后,大鼠血清中的CR、BUN浓度极显著降低,说明GSPAs以其螯合金属以及抗氧化的特性对由铁超载而导致的肾脏功能损伤产生了拮抗作用。本实验进一步从组织形态学观察铁超载对肾脏的影响,但是未发现铁过量大鼠肾脏组织出现病理损伤,推测可能是由于铁超载的建模时间太短,从而未对肾脏组织造成可见的病理性损伤。GSPAs的补充同样也未对肾脏组织形态学产生明显影响。
凋亡是在疾病进程中淘汰有害细胞的一个必需的生理过程,而先前的研究显示凋亡与氧化应激有着密切的联系[32]。为了进一步探讨GSPAs对于铁过量所致肾组织损伤的保护作用,进一步探讨了其对肾脏组织凋亡的影响。研究表明,Fas和Bax是体内重要的凋亡诱导蛋白[33]。本实验中发现Model组大鼠肾脏组织中的Fas及Bax基因表达显著上调,而GSPAs的干预对Fas、Bax基因的表达具有抑制作用。这可能是由于过量的铁能够引起氧化应激,从而刺激特定的凋亡途径,进而启动细胞凋亡。GSPAs则能够有效清除自由基,并且螯合部分铁,从而抑制凋亡相关信号,使得Fas、Bax基因表达下调。
综上,机体铁超载可以引起机体铁含量升高、肾脏氧化应激、肌酐和尿素氮含量升高以及Fas、Bax基因表达的上调,而GSPAs则可通过螯合铁和抗氧化特性对铁过量产生的效应进行拮抗,从而对铁超载所致的肾损伤起到保护作用。
