关节镜下治疗髋关节盂唇炎性钙化的临床研究
2020-07-22鞠晓东徐雁张辛王健全
鞠晓东 徐雁 张辛 王健全
北京大学第三医院运动医学研究所(北京 100191)
羟基磷灰石(hydroxyapatite,HA)沉积症是一种病因未明的系统性疾病,表现为关节周围和(或)关节内HA 晶体的沉积[1],临床上以肩关节的钙化性肩袖炎最常见[2,3]。髋关节周围钙化性肌键炎并不常见,好发于股骨大粗隆的旋转袖(也就是臀中肌和臀小肌肌腱)止点部位。研究发现股骨髋臼撞击综合征(femoroacetab⁃ular impingement,FAI)中也有少部分病例伴随小的(约2~3mm)盂唇钙化灶,或者髋臼小骨(os acetabuli),但二者与FAI 撞击以及髋痛等临床症状是否有关尚不明确[4-6]。目前,对于独立的、较大范围并单纯因钙化灶而引起明显临床症状的髋关节盂唇炎性钙化的诊治,国内外均未见相关报道。本文对2015 年4 月至2017 年8月期间采用髋关节镜进行治疗的5 例髋关节盂唇炎性钙化患者进行回顾性分析,旨在探讨髋关节镜治疗髋关节盂唇炎性钙化的手术方法和临床效果。
1 资料与方法
1.1 一般资料
本组患者 5 例,男性 1 例,女性 4 例,3 例左髋,2 例右髋,年龄29~47 岁,平均37.8 ± 6.5 岁,病史3 月~1年。1 例有患髋扭伤史,其余4 例无明显诱因。症状以腹股沟区和大转子周围疼痛为主,查体髋关节屈曲、内旋或外旋活动受限,髋关节前方撞击试验阳性,“4”字试验阳性。所有患者术前均经过口服药物、局部理疗等保守治疗2~3个月,症状无改善。
1.2 影像学检查
所有患者均在术前进行全面的影像学检查,包括髋关节X 线片,患侧的单髋三维CT 以及单髋MRI。X线片包括骨盆正位和Dunn 位片。在X 线正位片观察钙化灶的位置、形态、大小;测量外侧中心边缘角(later⁃al central-edge angle,LCE 角),股骨头中心点的垂线与髋臼外侧边缘的夹角,LCE 角>40°为Pincer 畸形,LCE 角<20°为髋关节发育不良;观察是否有交叉征,以判断是否存在前外侧的Pincer畸形。在Dunn位片上观察股骨头颈交界区的形态并测量α角(以股骨头中心点为圆心,股骨头正常最大半径画圆,从股骨头颈交界处与这个圆的交点到股骨头中心点作直线,该直线与股骨颈轴线构成的夹角即为α角),α角>50°说明存在Cam畸形。单髋三维CT 可以更直观地显示钙化灶的位置、形态、大小,有利于手术中定位处理病灶。单髋MRI评估是否存在髋臼盂唇撕裂、软骨损伤、关节腔积液等情况。
1.3 治疗方法
手术在全麻下进行,患者仰卧位,髋关节镜专用牵引床牵开髋关节间隙,在C 型臂引导下制备前外侧入路和前中入路,镜下切割刀切开两入路之间的关节囊。70°关节镜探查髋关节中央间室,可见所有患者盂唇炎症反应严重,盂唇实质内有钙化灶,使用刨刀和射频清理钙化灶,清理后的盂唇行盂唇缝合术或盂唇部分切除术。然后放松牵引,屈膝屈髋探查髋关节外周间室,清理增生的炎性滑膜组织等。伤口缝合敷料包扎。术后第1 天即可开始在无痛范围内被动活动髋关节,并拄双拐下地。缝合盂唇者患肢4 周可部分负重,6周后完全负重,按照相应的康复程序进行功能练习。
1.4 观察指标
在正位X 线片观察髋臼覆盖情况,测量LCE 角,有无交叉征。Dunn 位片和CT 上测量α角。三维CT 上记录钙化灶的位置、大小。记录手术中观察到的盂唇和钙化灶的形态、性状和手术方式。术前及终末随访时采用疼痛视觉评分(visual analogue scale,VAS)、改良的 髋 关 节 Harris 评 分(modified Harris hip score,mHHS)及髋关节非骨关节炎评分(nonarthritic hip score,NAHS)评估髋关节的症状和功能情况。同时对患者进行满意度评估。
1.5 统计学方法
所有数据以SPSS16.0 软件进行统计学分析,以均数±标准差表示。术前及术后各项评分数据采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床资料
5例患者均有髋关节疼痛、屈髋、内外旋活动受限,从起病到手术时间为3 个月到1 年,平均7.8 ± 3.5 个月。术后随访时间34.4 ± 9.9个月(24~51个月)。5例患者的 LCE 角平均 31.9 ± 3.6 度,28.8~36.4 度之间,均小于 40 度;α角平均 40.2 ± 5.3 度,33.6~48.2 度之间,均小于50度;X线正位片上均未发现交叉征,提示5例患者均无Cam 和Pincer 畸形,不存在股骨髋臼撞击表现。
三维CT 显示所有钙化灶均位于髋关节前上及前外侧(12 点~3 点位),钙化灶直径大小为11.2 ± 1.4 mm(9.5~13.2 mm)。盂唇钙化灶在X 线片上密度均一,无骨小梁结构,与周边髋臼的骨密度不同(图1)。这与髋臼小骨有明显区别,髋臼小骨有骨小梁,与髋臼的骨密度基本相同(图2)。
关节镜下见5 例患者的前外上侧盂唇肥厚肿大,充血炎症反应严重,钙化灶均位于12 点至3 点之间。刨刀刨开盂唇,在盂唇实质内沉积大量不成形的乳白色石膏粉样钙化物,多位于盂唇的关节囊侧,而且部分钙化灶侵蚀髋臼骨质,用刨刀刨掉钙化灶(图1)。这与髋臼小骨不同,髋臼小骨是一块完整的骨块,被包绕在盂唇之内,刨刀刨削不掉,只能用抓钳或髓核钳取出(图2)。刨刀清除沉积物后,3 例盂唇可以缝合,髋臼缘植入锚钉缝合盂唇;2 例盂唇所剩无几,行盂唇部分切除术。所有患者无Cam 和Pincer 畸形,未行股骨头颈或髋臼成型。
术后复查X 线、CT,显示髋臼缘高密度影像消失。盂唇缝合患者免负重6周。

表1 髋关节盂唇炎性钙化患者的临床资料(n=5)
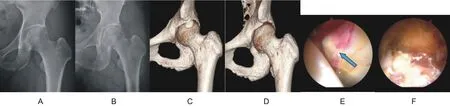
图1 47岁女性,左髋关节无诱因疼痛伴活动受限5个月
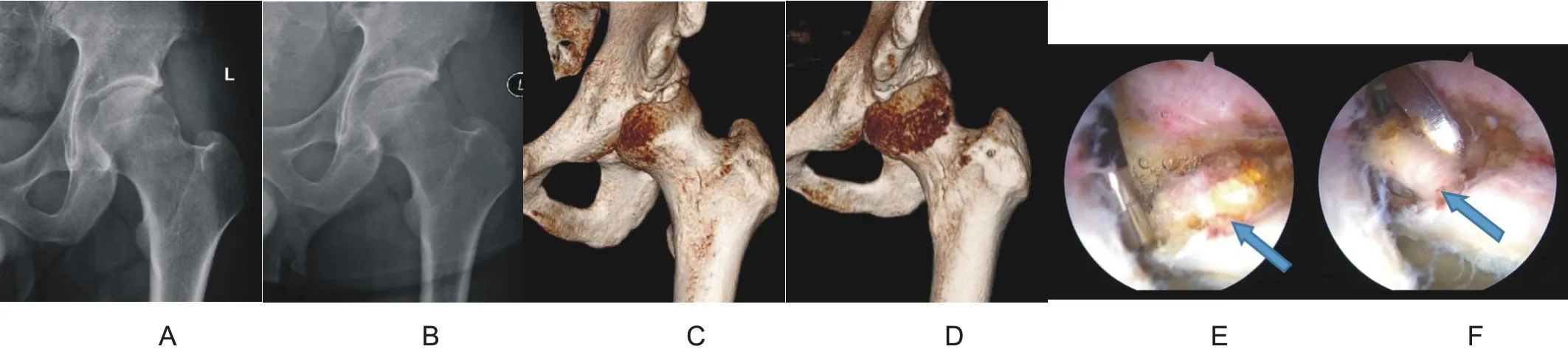
图2 32岁男性,左髋疼痛、活动受限1年
2.2 临床评估
术后患者疼痛症状迅速缓解或消失,VAS 评分由术前的5.8 ± 1.6分降至末次随访时的1.1 ± 0.3分,差异有统计学意义(P<0.01)。
末次随访时,mHHS 评分由术前的 57.2 ± 10.3 分提高至 90.3 ±8.7 分(P<0.01);NAHS 评分由术前的60.2 ± 11.5 分提高至84.0 ± 8.5 分(P<0.01)。所有患者未发生神经、血管损伤、伤口感染、异位骨化等并发症。
表2 手术前后VAS评分、mHHS评分及NAHS评分结果比较(± s,分)

表2 手术前后VAS评分、mHHS评分及NAHS评分结果比较(± s,分)
* P<0.01,与术前比较
VAS mHHS NAHS末次随访1.1 ± 0.3 *90.3 ± 8.7 *84.0 ± 8.5 *术前5.8 ± 1.6 57.2 ± 10.3 60.2 ± 11.5
3 讨论
自从2003 年Ganz 教授提出股骨髋臼撞击综合征的概念,人们逐渐认识到髋臼盂唇对于髋关节功能的重要性[7],并随着影像学检查及关节镜技术的巨大进步,髋关节镜手术得到了飞速的发展,手术量逐年上升。在影像学检查和手术过程中,人们就发现一部分患者的髋臼盂唇内有钙化灶。Jackson 等[6]报道,在1872 例因髋部疼痛行髋关节镜手术的患者中,共发现16例髋臼盂唇钙化,多出现于髋盂唇前外侧,与髋盂唇撕裂好发部位一致。Byrd 等[8]研究自2004年至2013年共3745 例行髋关节镜手术的患者,其中有56 名FAI 合并髋臼盂唇钙化性疾病。因此Ganz 等认为[7],FAI 持续的撞击常引起髋臼盂唇受损、退变,髋臼盂唇钙化物形成,即髋臼盂唇钙化可能是FAI 的继发性改变,也是诊断FAI 的一种标志。在上述报道的盂唇钙化病例中,均存在FAI 或盂唇撕裂等病变,而且我们在关节镜术中也观察到,这种钙化灶较小,直径大约3 mm,大多数钙化灶周围的盂唇和关节囊组织没有炎症反应。还有一些钙化灶包裹在正常的盂唇实质内部,仅仅在X 线和CT 上显影,而关节镜术中则观察不到。因此,这种小的盂唇钙化灶是否在髋关节疼痛中起作用尚不明确,可能仅仅是一种无症状的存在。另外,很多学者也发现,在正常无症状人群中也有髋臼盂唇钙化的现象。Cooke 等[9]在106 例无症状人群的髋关节三维CT上,发现16 例髋臼缘存在钙化物。所以,髋臼盂唇中小钙化灶的临床意义尚待进一步研究明确。在本研究中,5 例患者无FAI、髋关节发育不良、髋关节骨关节病等伴随疾病,前外侧髋臼盂唇实质内存在最大直径为13.2 mm 的钙化灶,关节镜下盂唇肥厚肿大充血,炎症反应严重,在关节镜下行钙化灶清理和盂唇缝合/清理,术后疼痛彻底缓解,mHHS和NAHS评分显著提高,显著改善患者的髋关节症状和功能,满意度100%。对于这种独立的、较大范围并单纯因钙化灶而引起髋关节疼痛和活动受限的髋臼盂唇炎性钙化,与前述的FAI伴发的小盂唇钙化有显著区别,国内外均未见报道。
钙化作为一种常见的病理改变,常发生于外伤、炎症等各种损伤之后,可累及全身肌腱、肌肉以及关节周围相关结构,具体发病机制尚不明确[10,11]。外伤引起的一过性损伤或过度活动引起的反复微损伤可引起局部组织内细胞受损、缺血缺氧,导致细胞内代谢障碍、钙质沉积[12]。遗传因素可能导致机体钙磷代谢紊乱,过多的钙质沉积难以全部被重吸收,形成钙化物[11,13]。钙化性沉积症好发于30~60 岁的女性,发生于肩袖内的钙化灶最为常见,髋臼盂唇的病例报道很少[14,15]。前述文献报道的FAI 伴发的盂唇钙化,其大小为1.6~5.4 mm,且有约20%为多发钙化,这与本文中髋关节盂唇炎性钙化的钙化灶不同,这5 例钙化灶都比较大,直径9.5~13.2 mm之间,而且均为单个病灶。
还要注意的是,髋关节盂唇炎性钙化患者的钙化灶与髋臼小骨(os acetabuli)特别容易混淆。髋臼小骨的成因还不明确,大多数学者认为髋臼小骨是一种解剖变异,因髋臼外缘的次级骨化中心不愈合,在髋臼外缘出现的多余的化骨核,呈三角形或卵圆形,一般不超过1.0 cm。Martinez 等[16]则认为髋臼小骨是髋臼缘的应力性骨折造成的,Perets 等[17]也认为髋臼小骨来源于髋臼缘的应力骨折,也可能是未融合的继发性骨化中心,表现为边界清晰的“类三角形”,质地坚硬。在X 线片上,盂唇炎性钙化与髋臼小骨有明显的不同。钙化灶密度均一,无骨小梁结构或皮质骨边缘,与周边髋臼的骨密度不同。髋臼小骨有骨小梁,与髋臼的骨密度基本相同。在组织学上盂唇炎性钙化患者的钙化灶是牙膏样的不定形性状,为纤维组织钙化物,而髋臼小骨为骨质结构。虽然有学者提出,现在没有证据证明或否认钙化灶是髋臼小骨的前身,但从组织学上看这二者之间是有显著不同的,应该没有相关性。
一般情况下钙化沉积症具有自愈倾向,无临床症状、症状较轻者可以先保守治疗[18]。像肩袖钙化性肌腱炎的患者,经非甾体消炎止痛药、局部皮质类激素注射、体外冲击波疗法和超声引导穿刺等治疗,90%以上的患者可获得良好的疗效[19,20]。对于髋关节钙化性盂唇炎而言,髋关节位置深,关节周围肌肉发达,关节囊厚实坚韧,体外冲击或经皮穿刺很难到达关节,相关的文献报道很少,治疗效果有待进一步研究。传统的切开手术创伤大、出血多,容易发生异位骨化,髋关节镜微创手术治疗就显示出了明显的优越性[21]。
Schmitz 等[4]报道2 例髋臼盂唇钙化病例,疼痛剧烈,经保守治疗无效,影像学检查发现髋关节内异常钙化组织,行髋关节镜手术,发现钙化物位于盂唇及关节囊之间,刨刀清理钙化组织,术后随访4 个月,疼痛完全消失,髋关节活动度恢复正常。这种与FAI 伴发的钙化灶多位于盂唇和关节囊之间的隐窝内,而本文报道的5 例患者,钙化灶均位于盂唇内部,侵蚀盂唇实质和髋臼骨质,这也是二者的明显区别。另外,这5 例钙化性盂唇炎,需要用刨刀刨除盂唇实质内部的大量无定形乳白色石膏粉样钙化物,而髋臼小骨是一块完整的骨块,不能用刨刀刨除,需整块切除。根据钙化灶侵蚀盂唇的程度不同,5 例患者刨除钙化灶后,有3 例剩余的盂唇还可以用锚钉缝合,比较完整的保留了盂唇的功能。这与髋臼小骨不同,完整切除髋臼小骨后都会造成一段盂唇结构的缺失,会破坏盂唇吸引密封的作用和功能。
综上所述,本文介绍了一种特殊的发生于髋臼盂唇的炎性钙化性疾病,与FAI 伴发的钙化灶和髋臼小体有明显区别,临床工作中需特别注意。髋关节镜手术治疗髋臼盂唇钙化沉积病创伤小、并发症少、恢复快,术后能显著缓解疼痛、改善髋关节功能,是一种安全有效的治疗方式。
